
- •Рабочая тетрадь для записи лекций по дисциплине «Основы биоорганической химии»
- •Принцип жмко.
- •Принцип жмко (принцип Пирсона)
- •Классификация кислот и оснований по Пирсону
- •Факторы, определяющие реакционную способность органического вещества
- •Свободно-радикальные процессы
- •Электрофильные реакции.
- •1. Галогенирование алкенов:
- •Примеры реакций электрофильного замещения:
- •Региоселективность реакций электрофильного замещения
- •Факторы, влияющие на скорость реакции:
- •1. Структура субстрата
- •2. Нуклеофильная сила
- •3. Уходящая группа - должна быть хорошей
- •4. Стереохимия реакции
- •Элиминирование - побочный процесс нуклеофильному замещению
- •Замещение карбонильного кислорода на азотсодержащие группировки
- •Реакции sn для альдегидов и кетонов
- •Реакции с участием сн-кислотного центра
Примеры реакций электрофильного замещения:
Галогенирование: Роль катализатора – формирование электрофильной частицы:

Нитрование:

Сульфирование:

Алкилирование по Фриделю-Крафтсу:



Ацилирование по Фриделю-Крафтсу:

Алкилирование ароматических соединений карбкатионами в биохимических реакциях:


Региоселективность реакций электрофильного замещения

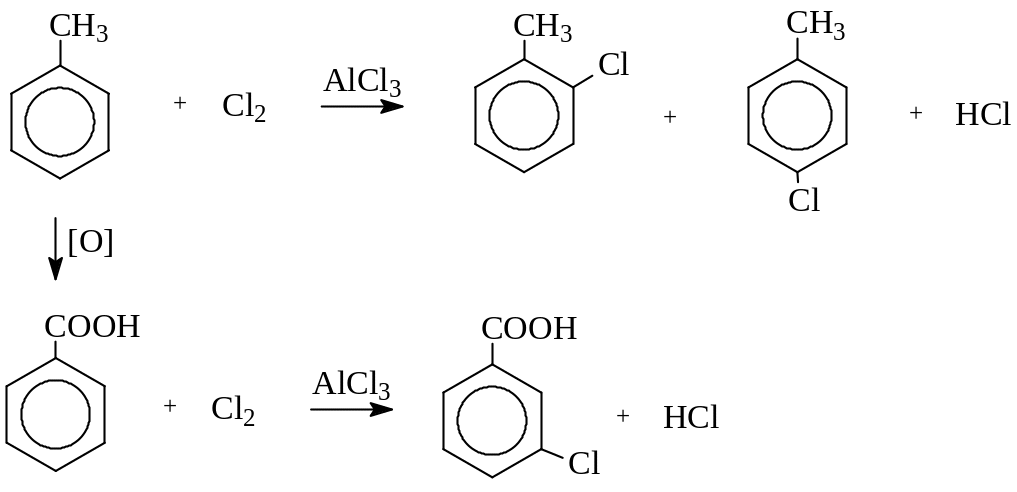
орто мета пара
X – донор X – акцептор X - донор
Тема: Реакции нуклеофильного замещения у sp3-гибридного атома углерода
Классы органических соединений, содержащих связь С-Х (углерод-гетероатом)
1. С-Hal (в организме – иодсодержащие гормоны щитовидной железы)
2. С-O (спирты, фенолы, простые эфиры, пероксиды, гидропероксиды)
3. C-S (тиолы, сульфиды, дисульфиды)
4. C-N (амины, четвертичные аммониевые основания)
Общее – полярная связь углерод-гетероатом:
Нуклеофильность – способность взаимодействовать с атомом (кроме водорода), несущем целый или частичный положительный заряд.
Общая
схема:
![]()
нуклеофил субстрат продукт уходящая
реакции группа
Реакция SN2 |
Реакция SN1 |
Синхронный одностадийный |
Асинхронный двухстадийный |
переходное состояние
|
|
|
|
Факторы, влияющие на скорость реакции:
Реакция SN2 |
Реакция SN1 |
1. Структура субстрата
Первичный алкил > вторичный алкил > третичный алкил
CH3-Cl > CH3CH2-Cl > (CH3)2CH-Cl > (CH3)3C-Cl
|
Бензильный, алильный > > третичный > вторичный > первичный
а) увеличиваются пространственные препятствия для подхода нуклеофила с тыла; б) увеличение числа электронодонорных заместителей уменьшает заряд δ+ на реакционном центре.
Возможны побочные процессы, связанные с перегруппировкой карбокатиона
|
2. Нуклеофильная сила
Уменьшение нуклеофильности
‾CH3 > ‾NH2 > ‾OH > F‾ F‾ < Cl‾ < Br‾ < J‾
Заряженные частицы сильнее нейтральных: НО- > Н2О CH3O- > CH3OH
Донорные заместители увеличивают нуклеофильность:
CH3O‾ > HO‾ > C6H5O‾ > CH3–COO‾ |
Не играет важной роли
|
Реакция SN2 |
Реакция SN1 |





