
Анализ результатов эксперимента
Если график оказался слишком «шумным», то есть искаженным помехами, рекомендуем выполнить его сглаживание. Для этого нажмите на панели инструментов графика кнопку Сгладить
 .
.Рассчитайте изменение рН в процессе растворения. Каково начальное значение рН? Каково значение рН в конце процесса? Какова разность этих значений?
Определите время достижения конечного значения рН.
Найдите изменение температуры в этом процессе и время, необходимое для достижения конечного значения температуры.
Определите интервал времени, необходимый для полного растворения NaOH.
Рассчитайте удельную теплоту реакции по формуле:
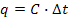 ,
где с – удельная теплоемкость, ∆t
– изменение температуры, q
– количество поглощенного (выделившегося)
тепла на 1 г вещества (Удельная
теплоемкость воды при 25°С равна 4,18
Дж/г·°С)
,
где с – удельная теплоемкость, ∆t
– изменение температуры, q
– количество поглощенного (выделившегося)
тепла на 1 г вещества (Удельная
теплоемкость воды при 25°С равна 4,18
Дж/г·°С)
Вопросы
Сколько времени заняла стабилизации величины рН? Сравните временной интервал завершения изменения рН с интервалом стабилизации температуры.
Чем объясняется разница в интервалах времени завершения изменения рН и стабилизации температуры?
Является ли процесс растворения NaOH экзотермической реакцией? Бурно ли протекает эта реакция? Обоснуйте свои выводы, используя результаты наблюдений.
Задание 2. Исследование изменения рН раствора при разбавлении или увеличении концентрации растворенного вещества
«Измерение рН раствора гидроксида натрия при увеличении концентрации щелочи в растворе»
Оборудование
Датчик рН
Электрод для измерения рН
Соединительный провод для датчика
Датчик температуры для термокомпенсации
Nova
Магнитная мешалка
Химический стакан на 150 мл, 2 шт.
Дистиллированная вода
Пипетка
NaOH 0,1 М раствор 50 мл
Настройка параметров измерения
частота измерений – каждую секунду
число замеров - 5000
Порядок проведения эксперимента:
Налейте в химический стакан на 150 мл 50 мл дистиллированной воды
Поставьте стакан на магнитную мешалку (если мешалка отсутствует, на основание штатива)
Опустите в стакан с водой стеклянный электрод, подсоединенный к датчику рН.
Поместите в стакан с водой датчик температуры для температурной компенсации.
Включите магнитную мешалку (если мешалка отсутствует, необходимо перемешивать раствор вручную).
Начинайте регистрацию данных. Для этого нажмите кнопку Пуск на панели инструментов MultiLab. Показания датчиков будут отображаться на экране в виде графика.
Прибавляйте из пипетки по каплям 0,1 М раствор гидроксида натрия. Отслеживайте изменение рН раствора.
Дождитесь стабилизации показаний датчика после прибавления всего количества гидроксида натрия.
Остановите регистрацию, нажав кнопку Стоп на панели инструментов MultiLab.
Сохраните данные опыта, запишите значение рН в исследуемом растворе.
Проведите расчет концентрации гидроксида натрия в полученном растворе
Анализ результатов эксперимента
Если график оказался слишком «шумным», то есть искаженным помехами, рекомендуем выполнить его сглаживание. Для этого нажмите на панели инструментов графика кнопку Сгладить .
Рассчитайте изменение рН в процессе растворения. Каково начальное значение рН? Каково значение рН в конце процесса? Какова разность этих значений?
Определите время достижения конечного значения рН.
Вопросы
Сколько времени заняла стабилизации величины рН?
Объясните ход изменения рН в процессе эксперимента.
Равномерно ли происходило изменение значения рН раствора?
Задание 3. Расчет значения рН раствора и экспериментальное подтверждение решения
«Расчет значения рН раствора слабого электролита
(на примере гидроксида кальция)»
Оборудование
Датчик рН
Электрод для измерения рН
Соединительный провод для датчика
Датчик температуры для термокомпенсации
Nova
Магнитная мешалка
Химический стакан на 150 мл, 2 шт.
Са(ОН)2 0,1 н раствор 50 мл
Настройка параметров измерения
частота измерений – каждую секунду
число замеров - 2000
Задача
Самый дешевый щелочной реагент для нейтрализации кислотных промышленных стоков - гашеная известь (гидроксид кальция). Используют как суспензию гидроксида кальция («известковое молоко»), так и прозрачный раствор («известковую воду»). Рассчитайте рН 0,02М раствора Ca(OH)2.
Запишем уравнение диссоциации гидроксида кальция:
Ca(OH)2 = Ca2+ + 2OH-; рН > 7
c {Ca(OH)2} = 0,02 моль/л; pH =?
В соответствии с уравнением реакции равновесная молярная концентрация анионов OH- вдвое больше концентрации гидроксида кальция c {Ca(OH)2}:
[OH-] = 2c {Ca(OH)2}
рН = 14 - pOH = 14 + lg[OH--] = 14 + lg 2c {Ca(OH)2} = 14 + lg 0,04 = 12,6
Ответ. Водородный показатель известковой воды равен 12,6.
Проверьте правильность полученных результатов опытным путем (измерьте значение рН раствора известковой воды).
