
2. Пиретрины и пиретроиды
По механизму действия более всего похожи на хлорорганические инсектициды пирет-рины и полученные в результате совершенствования структуры этих инсектицидов растительного происхождения пиретроиды. Эти вещества вызывают у пораженных ими насекомых те же самые физиологические последствия, что и многие хлорорганические препараты, имеющие совершенно иное строение.
С давних пор было известно, что высушенные листья и цветки некоторых видов диких хризантем могут быть использованы в быту для борьбы с такими насекомыми, как бло-хи, вши, тараканы и др. При экстракции низкокипящими органическими растворителя-ми из этого растительного материала извлекают инсектицидное действующее начало, которое с помощью молекулярной разгонки и хроматографии может быть разделено на шесть основных компонент (пиретрин I, пиретрин II, цинерин I, цинерин II, жасмолин I и жасмолин II), соответствующих общей формуле:
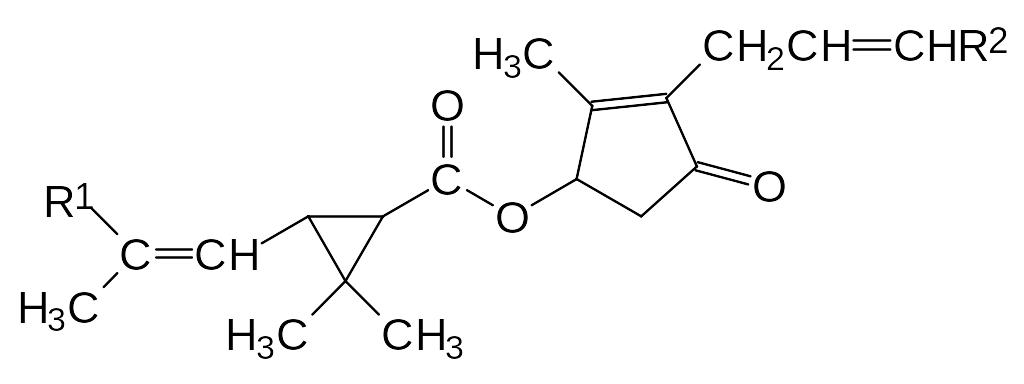 ,
,
где R1 принимает значения -СН3 или -СООСН3, а R2 означает группы -СН3, -СН=СН2 или С2Н5.
Пиретрины представляют собой контактные яды с парализующим эффектом, но невы-сокие концентрации этих веществ легко переносятся насекомыми, так как при обилии в их структуре двойных связей и сложноэфирных групп они легко включаются в метабо-лические процессы с участием неспецифических оксидаз и гидролаз с образованием безопасных метаболитов. По этой же причине пиретрины в течение нескольких минут разлагаются на воздухе и на свету, что делает невозможным использование их в поле-вых условиях. Стабильность пиретринов может быть повышена за счет добавок так называемых синергистов, обнаруженных впервые в кунжутном масле. Как природные, так и синтетические синергисты представляют собой производные метиленовых эфи-ров замещенных пирокатехинов, например сезамол и его оксиалкилированное произ-водное сезамекс:
 и
и

Здесь надо сразу сказать, что синергисты сами по себе инсектицидной активности не имеют, но в их присутствии заметно возрастает активность пиретринов, так как они не только защищают их от окисления. В присутствии синергистов ускоряется транспорт активных веществ через кутикулу (панцирь, экзоскелет) насекомых, поэтому их вводят также в составы инсектицидных препаратов с синтетическими пиретроидами, которые устойчивы к действию неспецифических оксидаз, света и кислорода воздуха. Посколь-ку защита от окисления для современных пиретроидов не обязательна, были разрабо-таны и более доступные синергисты, отвечающие только за транспорт активных начал через хитиновый панцирь насекомых. Одним из них является 2‑(2‑этилгексил)-3а,4,7,7а-тетрагидро-4,7-метано-1Н-изоиндол-1,3-(2Н)-дион (MGK 264):

Установление структуры натуральных пиретринов положило начало синтезу их струк-турных аналогов, который вначале носил довольно робкий характер. Первым синтети-ческим пиретроидом стал аллетрин, отличающийся от пиретрина I укороченной боко-вой цепью. В этом соединении присутствуют сразу три асимметрических атома углеро-да, но максимальной инсектицидной активностью отличается только один из возмож-ных пространственных изомеров. В ограниченном масштабе это соединение произво-дится и сейчас, так как оно ближе всего по строению к натуральным пиретринам. Успе-хи в области стереоспецифического синтеза позволяют получать с высокой избиратель-ностью наиболее активный пространственный изомер. Для таких однородных по сте-реоизомерному составу препаратов используется приставка био-, то есть биоаллетрин, представляющий собой эфир (d)-транс-хризантемовой кислоты и (d)-аллетролона, соответствует натуральному пиретрину со всеми присущими ему преимуществами и недостатками:

На начальной стадии модификации структуры пиретринов в качестве кислотной компо-ненты была выбрана хризантемовая кислота, основной способ получения которой осно-вывался на реакции 2,5-диметилгекса-2,4-диена с карбенами, образующимися из диазо-уксусного или диазомалонового эфира. Сначала по реакции Реппе из ацетилена и аце-тона в присутствии ацетиленида меди получают непредельный диол, который гидри-руют и дегидратируют:
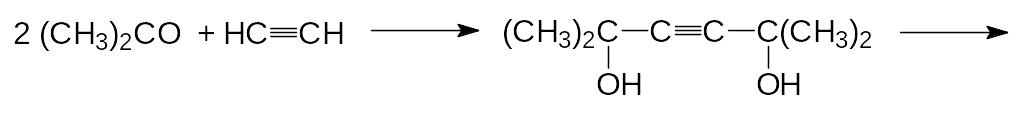
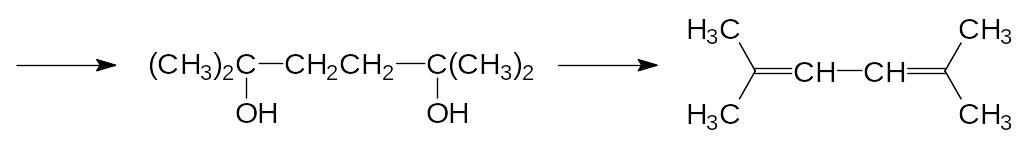
При взаимодействии взятого в избытке 2,5-диметилгекса-2,4-диена с диазоуксусным эфиром (его получают из этилового эфира глицина и азотистой кислоты) при 133С выход этилхризантемата может достигать 93 %:

Были разработаны и другие способы получения транс-хризантематов, в которых исклю-чалось использование взрывоопасного диазоуксусного эфира.
Совершенствование структуры спиртовой компоненты пиретроидов проводилось по различным вариантам. Были синтезированы эфиры хризантемовой кислоты и некото-рых замещенных бензиловых спиртов, но их активность оказалась недостаточно высо-кой. В 1964 году появился новый пиретроид – неопинамин или тетраметрин. Он пред-ставлял собой эфир хризантемовой кислоты и N-гидроксиметильного производного тетрагидрофталимида:
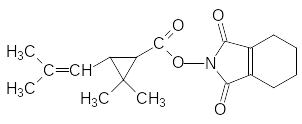
Более активные, но недостаточно стойкие соединения были обнаружены среди пирет-роидов, в которых спиртовая составляющая была представлена замещенными фурил-карбинолами (они похожи на аллетролон), например:
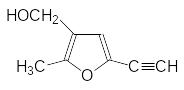


Исследования метаболизма и фотохимического окисления пиретроидов с фуранильны-ми фрагментами показали, что в основе невысокой стойкости этих веществ лежит лабильность этого гетероцикла. Логическим завершением исследований стало обнару-жение высокой инсектицидной активности у 3-феноксибензилового эфира хризантемо-вой кислоты – фенотрина, – отличавшегося также высокой персистентностью:

Структурный элемент 3-феноксибензилового спирта входит в состав всех современных пиретроидов.
Одновременно с поиском оптимальной спиртовой компоненты совершенствовалась и структура циклопропанкарбоксилатной составляющей, поскольку было показано, что именно диметилвинильный фрагмент хризантемовой кислоты стал лимитирующим в повышении персистентности этих инсектицидов. Снижение реакционной способности олефиновой двойной связи при сохранении размера заместителей может быть достиг-нуто за счет перехода к дихлорвинильной, дибромвинильной группе и замещенных иными электроноакцепторными группам винильным производным.
Первым успешным инсектицидом в этом ряду стал перметрин, получаемый, например, с использованием в качестве исходного продукта эфира винилизовалериановой кисло-ты. Сначала по двойной связи проводят присоединение четыреххлористого углерода по свободно-радикальному механизму:

При действии алкоголята полученное соединение отщепляет две молекулы хлористого водорода: образуется двойная связь и трехчленный цикл в результате -элиминирова-ния хлористого водорода:


Так получают этиловый эфир замещенной циклопропанкарбоновой кислоты, которую называют перметриновой. Ее эфир с 3-феноксибензиловым спиртов называется пермет-рином, а эфир с -циано-3-феноксибензиловым спиртом – циперметрином. Точно так-же из эфира винилизовалериановой кислоты и тетрабромметана получают дибром-винильное производное, на основе которого получают один из самых мощных пирет-роидов – дельтаметрин (декаметрин); его нормы расхода составляют несколько грамм на гектар:
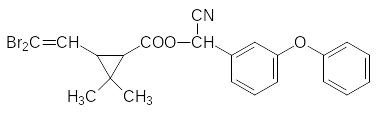
Однако, рекордсменом среди пиретроидов является цигалотрин. Его получают по аналогичной схеме, используя в качестве исходного продукта винилизовалерат и три-фтортрихлорэтан (фреон 113):
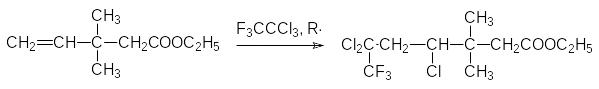
Дегидрохлорирование и циклизация этого вещества приводят к эфиру цигалотриновой кислоты:

Для получения цигалотрина этиловый эфир цигалотриновой кислоты переводят в хлорангидрид и ацилируют им циангидрин 3-феноксибензальдегида. В отличие от хризантематов у эфиров перметриновой, дельтаметриновой и циаглотриновой кислоты более активны транс-изомеры.
Для синтеза ключевого исходного продукта в получении современных пиретроидов – эфира винилизовалериановой кислоты разработано большое количество методик, осно-ванных на реакциях непредельных соединений с хлоралем. Здесь приводится синтез эфира 3-метилбут-1-ен-3-ил-малоновой кислоты, которая также присоединяет полига-лоидные соединения с образованием аддуктов, которые легко циклизуются в циклопро-пановые производные. Сначала из ацетона и ацетилена по реакции Фаворского полу-чают 3-метилбут-1-ин-3-ол, который избирательно гидрируют по тройной связи:
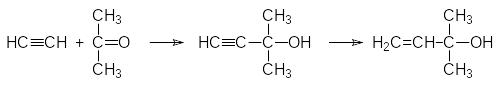
Образовавшийся винилдиметилкарбинол переводят в хлорид и алкилируют им малоновый эфир:
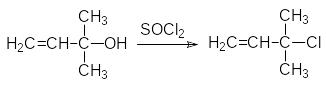
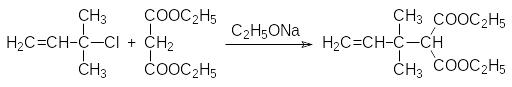
По двойной связи этого соединения присоединяют, например тетрабромметан:
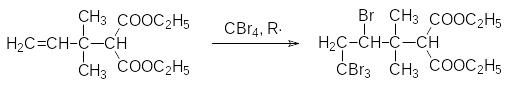
Теперь аналогитчно представленному выше проводят дегидробромирование и цикли-зацию и получают эфир замещенной циклопропандикарбоновой кислоты:
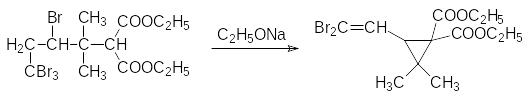
При его кипячении с кислотой идет гидролиз и декарбоксилирование и образуется дельтаметриновая кислота.
Полученную дельтаметриновую кислоту переводят в хлорангидрид действием тионил-хлорида и ацилируют им циангидрин 3-феноксибензальдегида, получаемый, например, по схеме, включающей реакцию Ульмана (взаимодействие м-крезолята и бромбензола в присутствии дисперсной меди):
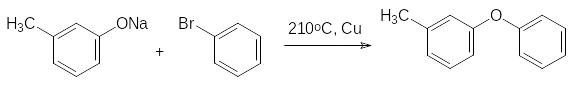
Далее 3-метилдифенилоксид хлорируют до образования смеси 3-феноксибензилхлори-да и 3-феноксибензальхлорида в присутствии инициаторов свободнорадикальных реак-ций, например, азо-бис(диизобутиронитрила). На схеме представлено образование про-дукта монозамещения:
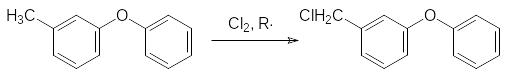
При нагревании с уротропином присутствующий в реакционной массе 3-фенокси-бензальхлорид гидролизуется с образованием 3-феноксибензальдегида, а монохлорид превращается в этот альдегид по реакции Соммле, где в роли окислителя выступает формальдегидная составляющая уротропина:
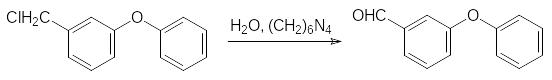
Альдегид реагирует с синильной кислотой и полученный циангидрин (I) ацилируют хлорангидридом дельтаметриновой кислоты:
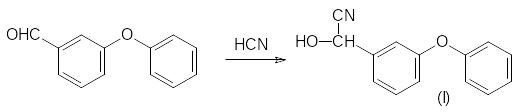

Одновременно с поиском новых производных циклопропанкарбоновых кислот шел по-иск инсектицидных препаратов с пиретриновым механизмом действия и среди соеди-нений, в структуре которых отсутствует циклопропановый фрагмент. Выход на очень эффективную феноксибензильную компоненту пиретроидов позволил получить широ-кий ряд соединений с этим видом инсектицидной активности среди ароматических производных с гем-диметильной группой.
Кислотную компоненту одного из таких соединений – фенвалерата – получают из п‑хлорбензилцианида алкилированием его изопропилбромидом в присутствии щелочи с катализаторами межфазного переноса, например солей четвертичного аммония:
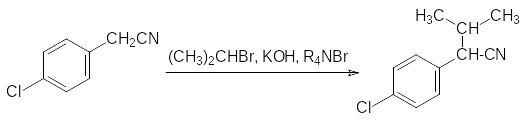
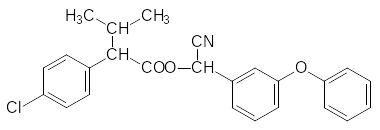
Полученный нитрил -(4-хлорфенил)изовалериановой кислоты омыляют в кислой сре-де, переводят образовавшуюся кислоту в хлорангидрид и ацилируют им циангидрин 3‑феноксибензальдегида. Так получают фенвалерат:
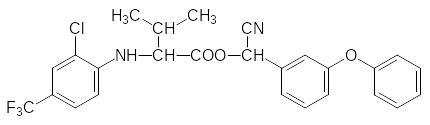
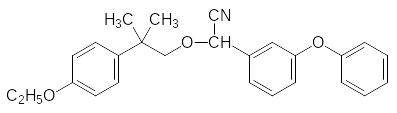
Другими соединениями с аналогичным механизмом инсектицидной активности явля-ются флувалинат (фторвалинат) и требон, в структуре которого отсутствует даже слож-ноэфирная группа:
 и
и
Понятно, что представленные здесь пиретроидные препараты являются лишь предста-вителями широкого ряда соединений с инсектицидной активностью, прототипами для которых послужили пиретрины. В настоящее время появились резистентные к пирет-роидам расы насекомых и поэтому приходится увеличивать нормы расхода или при-менять их в смеси с инсектицидами с иным механизмом биологической активности.
В частности, такими сравнительно новыми инсектицидами, которые могут применяться в качестве единственных активных веществ или в смеси с другими инсектицидами, являются неоникотиноиды, то есть вещества, полученные путем модификации струк-туры никотина и подобных ему алкалоидов. Как известно, в листьях и в стеблях расте-ний табака содержится 3-(N-метилпирролидин-2-ил)пиридин, известный нам как нико-тин, аналогичными токсическими свойствами характеризуются норникотин и анабазин:

Еще один алкалоид на основе пиридина кониин (conyrin) содержится в ядовитом расте-нии болиголове:
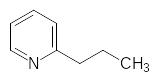
Никотин и его структурные аналоги являются агонистами нейромедиатора ацетилхо-лина, вещества, участвующего в передаче импульсов возбуждения в нервной системе. То есть они имитируют его действие на один из видов реагирующих на ацетилхолин рецепторов, но в отличие от ацетилхолина, гидролизующегося ферментом холинэсте-разой, эти замещенные пиридины достаточно стабильны и поэтому вызванное ими воз-буждение не прекращается в течение длительного времени и в конце концов приводит к исчерпанию энергетических возможностей и параличу. В молекуле ацетилхолина четвертичный атом аммония и сложноэфирную группу разделяет расстояние 0,493 нм, а у никотина расстояние в 0,476 нм разделяет два атома азота, что и объясняет оди-наковый механизм действия столь непохожих друг на друга веществ.
Никотин токсичен как для теплокровных, так и для насекомых. Собственно говоря, рас-тение с его помощью защищается от поедания его насекомыми и травоядными живот-ными. Инсектицидные свойства никотина были замечены достаточно давно и порошок табака или махорки с давних пор использовался для борьбы с насекомыми. Кстати, одна из причин столь быстрого распространения пожара в старом здании Манежа за-ключалась в том, что деревянные перекрытия потолка были засыпаны табачной крош-кой. Однако, никотин, как инсектицид, очень опасен в обращении из-за его высокой кожно-резорбтивной активности, то есть он может вызвать отравление при попадании на кожу, поэтому его нельзя было использовать для борьбы с эктопаразитами. Уже в дозе 0,01 мг/кг никотин вызывает сильное головокружение, головную боль, понос, тахикардию, делая человека недееспособным. Важно также, что на свету в присутствии кислорода воздуха никотин быстро разлагается и теряет активность.
В соответствии с этим был проведен поиск структурных аналогов никотина, которые были бы малотоксичны для теплокровных и более стабильны. Эти исследования завер-шились успехом и были получены большие группы инсектицидных препаратов, назы-ваемых неоникотиноидами. Вот лишь несколько примеров
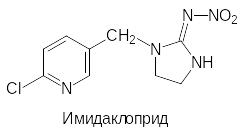
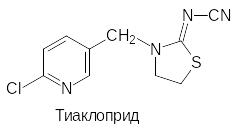
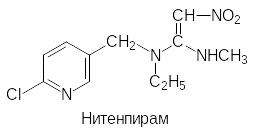
Основным исходным соединением для получения этих соединений является 6-хлор-3-хлорметилпиридин. Его синтез возможен различными путями. Например, по реакции Чичибабина при конденсации аммиака с пропионовым альдегидом и акриловой кисло-той, протекающей при температуре 200-220ºС в паровой фазе на алюмсиликатном ката-лизаторе, получают 3-метилпиридин (β-пиколин). Его в мягких условиях окисляют пер-оксидом водорода и нагревают образовавшийся N-оксид пиколина с хлорокисью фосфора:
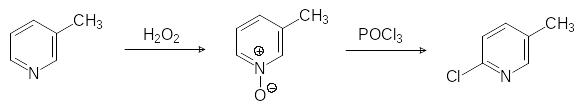
Такое превращение N-оксида начинается с образования хлорида N-дихлорфосфорил-оксипиколиния и его изомеризации в соответствующий дихлорфосфорилоксизамещен-ный пиколин с отщеплением хлористого водорода. После этого дихлорфосфорилиро-ванное производное разлагается с образованием 6-хлорпиколина. Его хлорируют и получают 6-хлор-3-хлорметилпиридин.
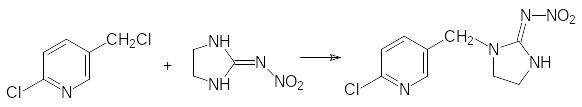
Один из путей синтеза имидаклоприда представлен реакцией алкилирования 2-нитро-иминоимидазолидина, который образуется из этилендиамина и нитрогуанидина, 6‑хлор-3-хлорметилпиридином:
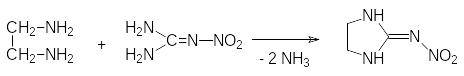
Исходное гетероциклическое соединение для получения тиаклоприда получают, напри-мер, по схеме:

Его также алкилируют 6-хлор-3-хлорметилпиридином по атому азота гетероцикличес-кого остатка.
Неоникотиноиды при попадании в желудочно-кишечный тракт теплокровных имеют токсичность около 500-1000 мг/кг, но в препаративных формах они малоопасны. Например, содержащая имидаклоприд препаративная форма «Гаучо» имеет значение ЛД50 4870 мг/кг. Но главное достоинство неоникотиноидов состоит в том, что они в отличие от никотина обладают низкой кожно-резорбтивной активностью. Благодаря этому, они часто используются для борьбы с эктопаразитами.
Механизм действия неоникотиноидов, взаимодействующих с холинорецепторами, отличается от механизма действия пиретроидов, фосфорорганических и карбаматных инсектицидов. Поэтому перекрестная резистентность на них не проявляется. Это зна-чит, что они сохраняют активность на расах насекомых, которые приобрели резистент-ность к применявшимся ранее инсектицидам.
