
- •Пособие по химии
- •Поступающих в Военно-медицинскую академию
- •Предисловие
- •Раздел I. Общая химия
- •Глава 1. Основные понятия и законы химии
- •Обучающие задачи Моль. Молярная масса
- •Расчеты по химическим формулам. Массовая доля. Вывод формул соединений
- •Законы идеальных газов
- •Расчеты по химическим уравнениям
- •1) Из 80 г оксида меди образуется 64 г меди,
- •2) C 80 г оксида меди реагирует 1 моль водорода,
- •56 Г Fe (1 моль) выделяют 2 г h2
- •24 Г Mg (1 моль) выделяют 2 г h2
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 2. Строение атома. Периодический закон и периодическая система д.И. Менделеева
- •2.1. Строение атома
- •2) В случае равных сумм сначала заполняются орбитали с меньшим значением n.
- •2.2. Периодический закон и периодическая система элементов
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Глава 3. Химическая связь
- •3.1. Ковалентная связь
- •Обучающие задачи
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4.Водородная связь
- •Задания для самостоятельной работы
- •Глава 4. Валентность и степень окисления
- •4.1. Понятие валентности
- •4.2. Степень окисления
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 5. Классификация химических реакций
- •Задания для самостоятельной работы
- •Глава 6. Окислительно-восстановительные реакции
- •6.1. Основные понятия и определения
- •6.2. Методы составления уравнений окислительно-восстановительных реакций
- •6.3. Реакции электролиза
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 7. Растворы. Теория электролитической диссоциации
- •7.1. Основные понятия
- •7.2. Ионные уравнения реакций
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 8. Химическая кинетика
- •8.1. Понятие скорости химической реакции
- •8.2. Влияние концентрации на скорость реакции
- •8.3. Влияние температуры на скорость реакции
- •8.4. Энергия активации
- •8.5. Влияние катализатора на скорость реакции
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 9. Химическое равновесие
- •9.1. Понятие о химическом равновесии
- •9.2. Способы смещения химического равновесия
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 10. Классификация неорганических соединений
- •10.1. Оксиды
- •10.2. Гидроксиды
- •10.2.1. Основания
- •I. Получение щелочей.
- •10.2.2. Кислоты
- •10.2.3. Амфотерные гидроксиды
- •10.3. Соли
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел II. Неорганическая химия
- •Часть I. Химия металлов
- •Глава 11. Общая характеристика металлов
- •I. Взаимодействие с неметаллами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 12. Химия щелочных металлов
- •I. Взаимодействие с неметаллами.
- •II. Взаимодействие со сложными веществами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 13. Химия щелочноземельных металлов
- •13.1. Общая характеристика элементов главной подгруппы II группы
- •13.2. Кальций
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения кальция
- •Ca(oh)2 - гидроксид кальция(II), гашеная известь
- •Гидрид кальция CaH2 и карбид кальция СаС2
- •13.3. Жесткость воды и способы ее устранения
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 14. Химия алюминия Простое вещество
- •II. Взаимодействие cо сложными веществами.
- •Оксид алюминия Al2o3
- •Гидроксид алюминия Al(oh)3
- •Cоли алюминия
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 15. Химия железа Простое вещество
- •II. Взаимодействие со сложными веществами.
- •Соединения железа(II) Оксид железа(II)
- •Гидроксид железа(II)
- •Соединения железа(III) Оксид железа(III)
- •Гидроксид железа(III)
- •Cоли железа(III)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 16. Химия хрома и марганца
- •16.1. Хром
- •Простое вещество
- •Cоли хрома(III)
- •Соединения хрома(VI) Оксид хрома(VI), хромовый ангидрид
- •Кислоты и соли хрома(VI)
- •16.2. Марганец
- •Простое вещество
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 17. Химия меди и цинка
- •17.1. Медь
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения меди(I)
- •Соединения меди(II) Оксид меди(II)
- •Гидроксид меди(II)
- •Cоли меди(II)
- •17.2. Цинк
- •Простое вещество
- •Соединения цинка Оксид цинка ZnO
- •Гидроксид цинка Zn(oh)2
- •Соли цинка
- •Задания для самостоятельной работы
- •Ответы:
- •Часть II. Химия неметаллов
- •Глава 18. Химия водорода
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы:
- •Соединения водорода
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 19. Химия галогенов
- •19.1. Общая характеристика галогенов
- •Водородные соединения галогенов
- •19.2. Хлор
- •Хлороводород и соляная кислота
- •Кислородные кислоты хлора
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 20. Химия элементов подгруппы кислорода
- •20.1. Общая характеристика элементов подгруппы
- •Кислорода
- •20.2. Кислород
- •Простое вещество о2
- •I. Промышленные методы.
- •Простое вещество о3 (озон)
- •Соединения кислорода (с.О. 1) Пероксиды
- •Задания для самостоятельной работы
- •Ответы:
- •20.3. Вода
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •20.4. Сера
- •Простое вещество
- •Соединения серы Сероводород н2s
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Oксид серы(IV), cернистый газ
- •Сернистая кислота h2so3
- •I. Кислотные свойства.
- •II. Окислительно-восстановительные свойства.
- •Оксид серы(VI), cерный газ
- •Серная кислота
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 21. Химия элементов подгруппы азота
- •21.1. Общая характеристика элементов подгруппы азота
- •21.2. Азот
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы.
- •Соединения азота Аммиак
- •II. Лабораторные способы.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли аммония
- •Оксиды азота
- •Азотистая кислота и ее соли
- •Азотная кислота
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли азотной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •21.3. Фосфор
- •Простое вещество
- •Фосфорные кислоты
- •I. В промышленности.
- •II. В лаборатории.
- •Соли ортофосфорной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 22. Химия элементов подгруппы углерода
- •22.1 Общая характеристика элементов подгруппы углерода
- •22.2. Углерод
- •Простое вещество
- •Неорганические соединения углерода с отрицательными степенями окисления (карбиды металлов)
- •Оксид углерода(II)
- •Оксид углерода(IV)
- •Угольная кислота
- •Соли угольной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •22.3. Кремний
- •Простое вещество
- •I. Промышленный способ:
- •II. Лабораторные способы:
- •Соединения кремния (с.О.4) Водородные соединения (силаны)
- •Оксид кремния(IV)
- •Кремниевые кислоты
- •Cоли кремниевых кислот (силикаты)
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел III. Органическая химия
- •Глава 23. Строение и номенклатура органических соединений
- •23.1 Теория строения органических соединений
- •23.2. Номенклатура органических соединений
- •Задания для самостоятельной подготовки
- •Глава 24. Химия углеводородов
- •24.1. Алканы
- •II. Лабораторные методы.
- •24.2. Циклоалканы
- •24.3. Алкены
- •24.4. Диеновые углеводороды
- •24.5. Алкины
- •24.6. Арены
- •I. Реакции электрофильного замещения.
- •III. Реакции окисления.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 25. Кислородсодержащие органические соединения
- •25.1. Спирты и фенолы
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.2. Альдегиды. Кетоны
- •I. Реакции присоединения.
- •II. Реакции полимеризации.
- •III. Реакция поликонденсации.
- •Задания для самостоятельной работы
- •Ответы:
- •25.3. Карбоновые кислоты
- •I. Кислотные свойства.
- •II. Реакции с разрывом связи со (замещение он-группы).
- •III. Реакции с разрывом сн связи у -углеродного атома.
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.4. Сложные эфиры. Жиры
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 26. Химия углеводов
- •26.1. Моносахариды
- •Глюкоза
- •Другие моносахариды
- •26.2. Дисахариды Мальтоза
- •Сахароза
- •26.3. Полисахариды Крахмал
- •Целлюлоза (клетчатка)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 27. Азотсодержащие органические соединения
- •27.1. Амины
- •27.2. Аминокислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
- •28.1. Гетероциклические соединения
- •Пиридин
- •28.3. Нуклеиновые кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •1. Таблица растворимости
25.3. Карбоновые кислоты
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу.

Для простейших представителей класса, а также высших жирных кислот (см. тему “Жиры”), приняты тривиальные названия (уксусная, стеариновая).
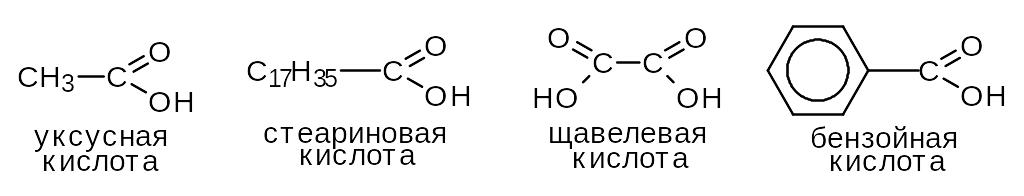
По числу карбоксильных групп делятся на монокарбоновые (одноос-новные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета - на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода - жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Медико-биологическое значение
Муравьиная кислота - обладает раздражающим действием на кожу, может вызвать ожоги. Ацетату калия (соль уксусной кислоты) присуще диуретическое действие. Изовалериановая кислота (СH3)2CHCH2COOH оказывает успокаивающее действие, входит в состав валидола, настойки валерианы. Бензойная кислота применяется в качестве противомикробного средства. Ее соль бензоат натрия отхаркивающее средство. Салициловая (орто-гидроксибензойная) кислота применяется как антисептическое, раздражающее средство. Салицилат натрия - анальгезирующее, жаропонижающее, противовоспалительное средство. Исходный продукт для получения аспирина.
Общие способы получения
1) Окисление первичных спиртов и альдегидов KMnO4 или K2Cr2O7:

2) Гидролиз галогенпроизводных:
![]()

3) Из солей карбоновых кислот:

4) Гидролиз сложных эфиров:

Получение уксусной, муравьиной и бензойной кислот
![]()
![]()


Химические свойства
I. Кислотные свойства.
Обусловлены подвижностью атома водорода карбоксильной группы. Слабые кислоты, с увеличением углеводородного радикала степень диссоциации уменьшается.
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот:
![]()
II. Реакции с разрывом связи со (замещение он-группы).
1) Взаимодействие со спиртами (реакция этерификации, см. тему “Спирты”).
2) Взаимодействие с аммиаком с образованием амидов:
![]()
3) Образование галогенангидридов:
![]()
4) Образование ангидридов (действием водоотнимающих средств):
![]()
III. Реакции с разрывом сн связи у -углеродного атома.
Связаны со смещением электронной плотности от -углеродного атома в сторону карбоксильной группы.
![]()
Особенности муравьиной кислоты
1) Реакция “серебряного зеркала” (по альдегидной группе):
![]()
2) Разложение под действием водоотнимающих средств:
![]()
Обучающая задача
Определить строение одноосновной предельной органической кислоты, если для нейтрализации 7.4 г ее израсходовано 40 г раствора гидроксида натрия с массовой долей 10 %.
Решение:
Запишем уравнение реакции нейтрализации:
RCOOH + NaOH RCOONa + H2O
Найдем массу вещества гидроксида натрия в растворе:
m(NaOH) = m(раствора NaOH) . (NaOH) = 40 . 0.1 = 4 г
Вычислим количество вещества NaOH:
(NaOH) = m(NaOH) / M(MaOH) = 4 : 40 = 0.1 моль
Из уравнения реакции видно, что (RCOOH) = (NaOH) = 0.1 моль. Зная массу кислоты, найдем ее молярную массу:
M(RCOOH) = m(RCOOH) / (RCOOH) = 7.4 : 0.1 = 74 г/моль
Так как формулу предельной карбоновой кислоты можно записать как СnH2n+1COOH, составим математическое уравнение с одним неизвестным:
12n + 2n + 1 + 12 + 16 . 2 + 1 = 74
Отсюда: n=2, т.е. формула исходной кислоты С2H5COOH (пропионовая кислота).
