
- •Пособие по химии
- •Поступающих в Военно-медицинскую академию
- •Предисловие
- •Раздел I. Общая химия
- •Глава 1. Основные понятия и законы химии
- •Обучающие задачи Моль. Молярная масса
- •Расчеты по химическим формулам. Массовая доля. Вывод формул соединений
- •Законы идеальных газов
- •Расчеты по химическим уравнениям
- •1) Из 80 г оксида меди образуется 64 г меди,
- •2) C 80 г оксида меди реагирует 1 моль водорода,
- •56 Г Fe (1 моль) выделяют 2 г h2
- •24 Г Mg (1 моль) выделяют 2 г h2
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 2. Строение атома. Периодический закон и периодическая система д.И. Менделеева
- •2.1. Строение атома
- •2) В случае равных сумм сначала заполняются орбитали с меньшим значением n.
- •2.2. Периодический закон и периодическая система элементов
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Глава 3. Химическая связь
- •3.1. Ковалентная связь
- •Обучающие задачи
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4.Водородная связь
- •Задания для самостоятельной работы
- •Глава 4. Валентность и степень окисления
- •4.1. Понятие валентности
- •4.2. Степень окисления
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 5. Классификация химических реакций
- •Задания для самостоятельной работы
- •Глава 6. Окислительно-восстановительные реакции
- •6.1. Основные понятия и определения
- •6.2. Методы составления уравнений окислительно-восстановительных реакций
- •6.3. Реакции электролиза
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 7. Растворы. Теория электролитической диссоциации
- •7.1. Основные понятия
- •7.2. Ионные уравнения реакций
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 8. Химическая кинетика
- •8.1. Понятие скорости химической реакции
- •8.2. Влияние концентрации на скорость реакции
- •8.3. Влияние температуры на скорость реакции
- •8.4. Энергия активации
- •8.5. Влияние катализатора на скорость реакции
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 9. Химическое равновесие
- •9.1. Понятие о химическом равновесии
- •9.2. Способы смещения химического равновесия
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 10. Классификация неорганических соединений
- •10.1. Оксиды
- •10.2. Гидроксиды
- •10.2.1. Основания
- •I. Получение щелочей.
- •10.2.2. Кислоты
- •10.2.3. Амфотерные гидроксиды
- •10.3. Соли
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел II. Неорганическая химия
- •Часть I. Химия металлов
- •Глава 11. Общая характеристика металлов
- •I. Взаимодействие с неметаллами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 12. Химия щелочных металлов
- •I. Взаимодействие с неметаллами.
- •II. Взаимодействие со сложными веществами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 13. Химия щелочноземельных металлов
- •13.1. Общая характеристика элементов главной подгруппы II группы
- •13.2. Кальций
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения кальция
- •Ca(oh)2 - гидроксид кальция(II), гашеная известь
- •Гидрид кальция CaH2 и карбид кальция СаС2
- •13.3. Жесткость воды и способы ее устранения
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 14. Химия алюминия Простое вещество
- •II. Взаимодействие cо сложными веществами.
- •Оксид алюминия Al2o3
- •Гидроксид алюминия Al(oh)3
- •Cоли алюминия
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 15. Химия железа Простое вещество
- •II. Взаимодействие со сложными веществами.
- •Соединения железа(II) Оксид железа(II)
- •Гидроксид железа(II)
- •Соединения железа(III) Оксид железа(III)
- •Гидроксид железа(III)
- •Cоли железа(III)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 16. Химия хрома и марганца
- •16.1. Хром
- •Простое вещество
- •Cоли хрома(III)
- •Соединения хрома(VI) Оксид хрома(VI), хромовый ангидрид
- •Кислоты и соли хрома(VI)
- •16.2. Марганец
- •Простое вещество
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 17. Химия меди и цинка
- •17.1. Медь
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения меди(I)
- •Соединения меди(II) Оксид меди(II)
- •Гидроксид меди(II)
- •Cоли меди(II)
- •17.2. Цинк
- •Простое вещество
- •Соединения цинка Оксид цинка ZnO
- •Гидроксид цинка Zn(oh)2
- •Соли цинка
- •Задания для самостоятельной работы
- •Ответы:
- •Часть II. Химия неметаллов
- •Глава 18. Химия водорода
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы:
- •Соединения водорода
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 19. Химия галогенов
- •19.1. Общая характеристика галогенов
- •Водородные соединения галогенов
- •19.2. Хлор
- •Хлороводород и соляная кислота
- •Кислородные кислоты хлора
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 20. Химия элементов подгруппы кислорода
- •20.1. Общая характеристика элементов подгруппы
- •Кислорода
- •20.2. Кислород
- •Простое вещество о2
- •I. Промышленные методы.
- •Простое вещество о3 (озон)
- •Соединения кислорода (с.О. 1) Пероксиды
- •Задания для самостоятельной работы
- •Ответы:
- •20.3. Вода
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •20.4. Сера
- •Простое вещество
- •Соединения серы Сероводород н2s
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Oксид серы(IV), cернистый газ
- •Сернистая кислота h2so3
- •I. Кислотные свойства.
- •II. Окислительно-восстановительные свойства.
- •Оксид серы(VI), cерный газ
- •Серная кислота
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 21. Химия элементов подгруппы азота
- •21.1. Общая характеристика элементов подгруппы азота
- •21.2. Азот
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы.
- •Соединения азота Аммиак
- •II. Лабораторные способы.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли аммония
- •Оксиды азота
- •Азотистая кислота и ее соли
- •Азотная кислота
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли азотной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •21.3. Фосфор
- •Простое вещество
- •Фосфорные кислоты
- •I. В промышленности.
- •II. В лаборатории.
- •Соли ортофосфорной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 22. Химия элементов подгруппы углерода
- •22.1 Общая характеристика элементов подгруппы углерода
- •22.2. Углерод
- •Простое вещество
- •Неорганические соединения углерода с отрицательными степенями окисления (карбиды металлов)
- •Оксид углерода(II)
- •Оксид углерода(IV)
- •Угольная кислота
- •Соли угольной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •22.3. Кремний
- •Простое вещество
- •I. Промышленный способ:
- •II. Лабораторные способы:
- •Соединения кремния (с.О.4) Водородные соединения (силаны)
- •Оксид кремния(IV)
- •Кремниевые кислоты
- •Cоли кремниевых кислот (силикаты)
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел III. Органическая химия
- •Глава 23. Строение и номенклатура органических соединений
- •23.1 Теория строения органических соединений
- •23.2. Номенклатура органических соединений
- •Задания для самостоятельной подготовки
- •Глава 24. Химия углеводородов
- •24.1. Алканы
- •II. Лабораторные методы.
- •24.2. Циклоалканы
- •24.3. Алкены
- •24.4. Диеновые углеводороды
- •24.5. Алкины
- •24.6. Арены
- •I. Реакции электрофильного замещения.
- •III. Реакции окисления.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 25. Кислородсодержащие органические соединения
- •25.1. Спирты и фенолы
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.2. Альдегиды. Кетоны
- •I. Реакции присоединения.
- •II. Реакции полимеризации.
- •III. Реакция поликонденсации.
- •Задания для самостоятельной работы
- •Ответы:
- •25.3. Карбоновые кислоты
- •I. Кислотные свойства.
- •II. Реакции с разрывом связи со (замещение он-группы).
- •III. Реакции с разрывом сн связи у -углеродного атома.
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.4. Сложные эфиры. Жиры
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 26. Химия углеводов
- •26.1. Моносахариды
- •Глюкоза
- •Другие моносахариды
- •26.2. Дисахариды Мальтоза
- •Сахароза
- •26.3. Полисахариды Крахмал
- •Целлюлоза (клетчатка)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 27. Азотсодержащие органические соединения
- •27.1. Амины
- •27.2. Аминокислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
- •28.1. Гетероциклические соединения
- •Пиридин
- •28.3. Нуклеиновые кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •1. Таблица растворимости
Ответы:
3. С5Н12. 4. 4 л метана и 6 л пропана; 16.4. 5. Смесь этана, пропана и бутана, 4.48 л. 6. 2,2,3,3-Тетраметил-бутан. 7. 7.84 л. 8. 252 г. 9. Пропен, циклопропан. 10. 4.16 г. 11. С3Н6 (пропен и циклопропан). 12.16.2 г, Ca(OH)Br. 13. 66.7% этилена, 33.3% пропена; 23.52 л О2. 14. Пропанол-2. 15. 2.24 л пропена, А - 2-бромпропан, Б - 2,3-диметилбутан. 16. Бутадиен-1,3; 17.92 л. 17. 21.4 г 1,4-дибромбутена-2 и 37.4 г 1,2,3,4-тетрабромбутана. 18. А - 1,4-дибромбутан, Б - бутадиен-1,3; 32 г. 19. 1,3,5-триметилбензол. 20. 4.48 л этена и 4.48 л бутина-2. 21. 4 изомера, 112 л. 22. Фенилацетилен. 23. С6Н6. 24. 34.45 % циклогексена и 65.55 % бензола. 25. 12.6 л. 26. 0.8 л. 27. Первая смесь: 1 л СН4, 1 л С2Н2, 3 л Н2; вторая смесь: 1 л СН4, 1 л С2Н6, 1 л Н2; степень превращения 66.7%. 28. 47.1 % СаС2 и 52.9 % Al4C3. 29. Поливинилхлорид; 70.4 %. 30. 0.3 моль С6Н6, 0.1 моль С6Н10, 0.1 моль С6Н12.
Глава 25. Кислородсодержащие органические соединения
25.1. Спирты и фенолы
Спирты - органические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (-ОН), соединенных с углеводородным радикалом. В номенклатуре IUPAC спиртам соответствует суффикс -ол. По месту гидроксильной группы в цепи спирты делятся на:
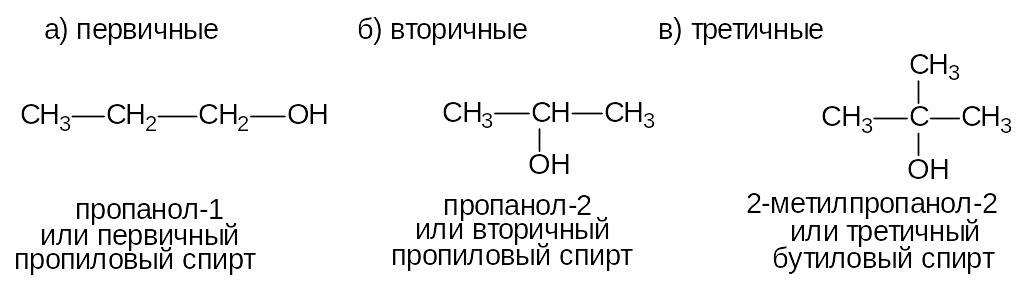
В зависимости от числа гидроксильных групп спирты делятся на:
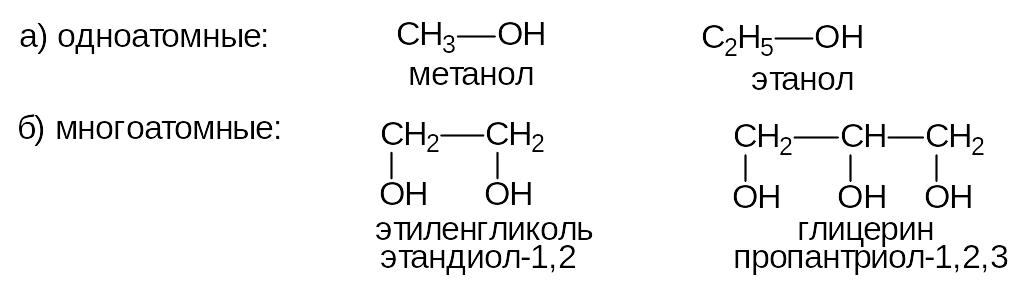
Двухатомные спирты иначе называют гликолями.
В зависимости от характера углеводородного радикала, связанного с гидроксильной группой, спирты делятся на алифатические и ароматические. Соединения, у которых гидроксильная группа непосредственно связана с ароматическим кольцом, называются фенолами.
Все одноатомные спирты бесцветны, легче воды. Спирты с числом атомов углерода меньше двенадцати - жидкости. Температуры их кипения аномально высоки благодаря межмолекулярным водородным связям. Метанол, этанол и пропанол неограниченно растворимы в воде. Все гликоли - вязкие жидкости. Большинство фенолов - кристаллические вещества с невысокой температурой плавления, малорастворимы в воде.
Медико-биологическое значение
Метанол - сильный яд. При приеме даже в малых дозах вызывает слепоту. Этанол применяется как антисептическое и раздражающее средство. Используется для изготовления экстрактов, настоек, дезинфекции, консервирования анатомических препаратов.
Фенол (карболовая кислота) обладает бактерицидным, раздражающим, прижигающим действием. Это первый антисептик, примененный в хирургии. Резорцин (мета-дигидроксибензол) применяется при кожных заболеваниях. Лизол (смесь орто-, мета- и пара-метилфенолов) для дезинфекции. Глицерин используют в мазях для смягчения кожи.
Получение одноатомных спиртов
1) Гидратация алкенов.
а) в присутствии фосфорной кислоты:
CH2=CH2
+ H2O
![]() CH3CH2OH
CH3CH2OH
б) в присутствии концентрированной серной кислоты:
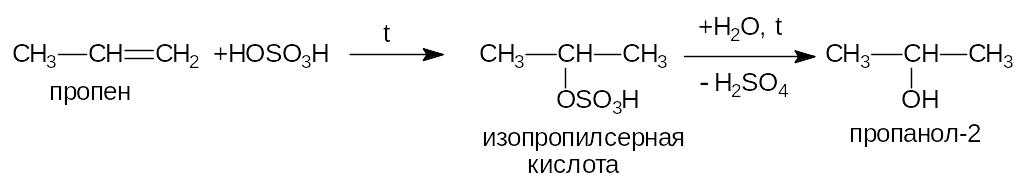
2) Гидролиз галогенпроизводных.
C2H5Cl + NaOH(водн.) С2H5OH + NaCl
3) Восстановление карбонильных соединений.
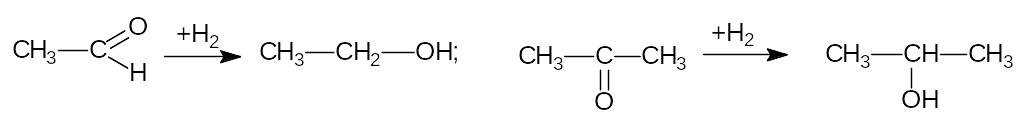
4) Каталитическое окисление алканов.
![]()
Cпецифические способы получения метанола и этанола:
![]()
C6H12O6
![]() 2С2H5OH
+ 2CO2
2С2H5OH
+ 2CO2
Получение этиленгликоля
1) Окисление этилена водным раствором перманганата калия (реак-ция Вагнера).
![]()
2) Щелочной гидролиз дигалогенпроизводных.
![]()
Получение глицерина
Щелочной гидролиз жиров:
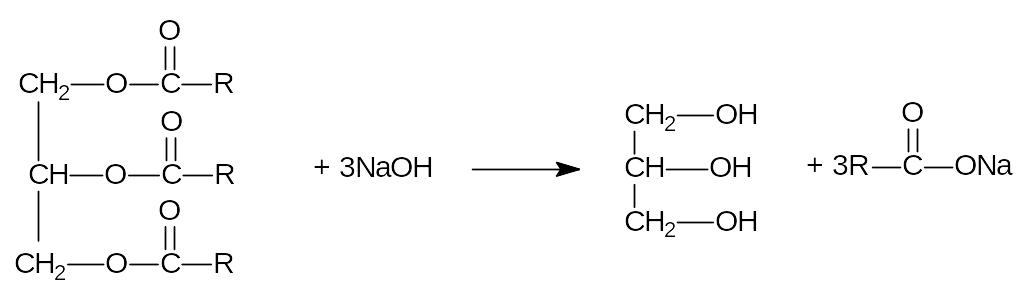
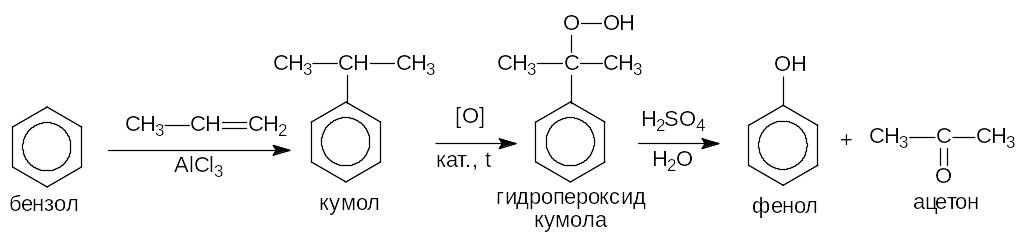
Получение фенолов
1) Кумольный метод (метод П.Г.Сергеева). В качестве исходного сырья используют бензол и пропен.
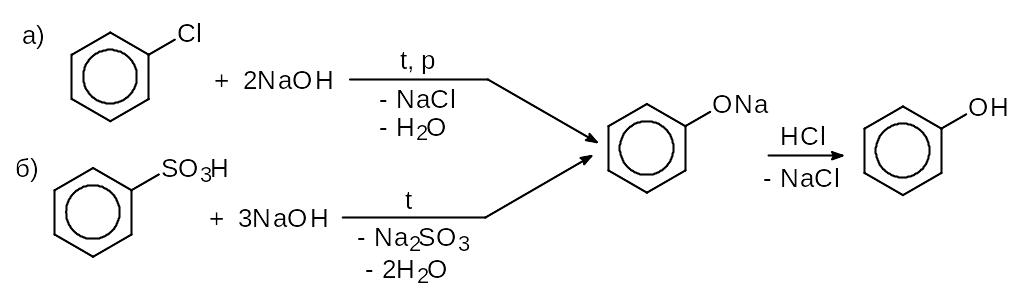
2) Щелочной гидролиз галогенпроизводных ароматических углеводородов (а) и сплавление ароматических сульфокислот со щелочами (б):
Химические свойства одноатомных спиртов
1) Проявляют слабые кислотные свойства, образуя алкоголяты:
2ROH + 2Na 2RONa + H2
Равновесие в реакции со щелочами почти нацело смещено влево (продукты выделяют лишь при удалении воды в ходе реакции):
![]()
2) Замещение гидроксильной группы под действием галогеноводородов может быть проведено при тех же условиях смещения равновесия:
![]()
Галогенпроизводные получают действием специальных реагентов:
ROH + PCl5 RCl + POCl3 + HCl; 3ROH + PBr3 3RBr + H3PO3
ROH + SOCl2 RCl + SO2 + HCl
3) Pеакции дегидратации.
а) межмолекулярная дегидратация:
C2H5OH +
HOC2H5
![]() C2H5OC2H5
+ H2O
C2H5OC2H5
+ H2O
диэтиловый эфир
б) внутримолекулярная дегидратация протекает в более жестких условиях; для вторичных и третичных спиртов - по правилу Зайцева:
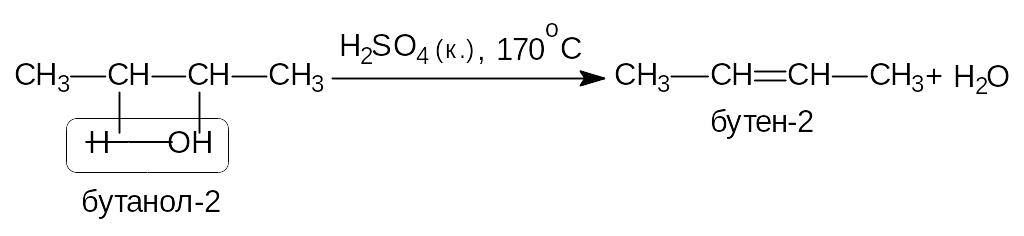
4) Реакция этерификации.
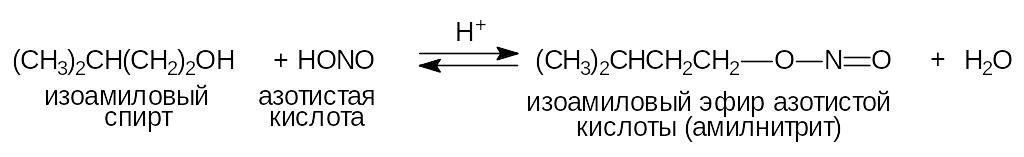
Амилнитрит сосудорасширяющее средство.
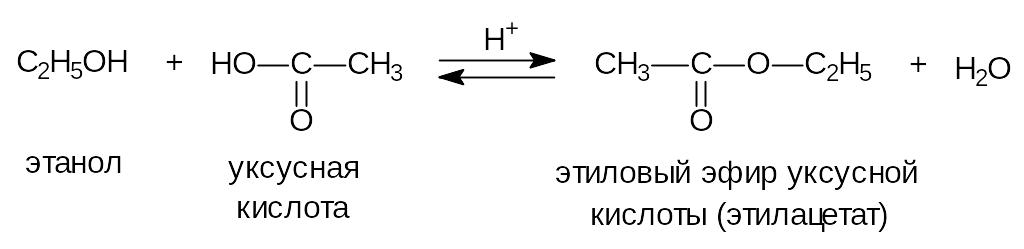
Особенностью реакции является выделение молекулы воды, которое происходит следующим образом: от молекулы спирта отщепляется атом водорода, а от молекулы кислоты гидроксильная группа. Такой механизм взаимодействия может быть доказан способом “меченых атомов” введением в реакцию спирта, содержащего изотоп кислорода 18O.
5) Реакции окисления.
а) первичных спиртов:
![]()
б) вторичных спиртов:
![]()
В качестве окислителей применяют перманганат калия, бихромат калия, кислород воздуха в присутствии катализаторов (CuO).
Третичные спирты в обычных условиях не окисляются.
Химические свойства многоатомных спиртов
1) Кислотные свойства.
а) взаимодействие со щелочными металлами:
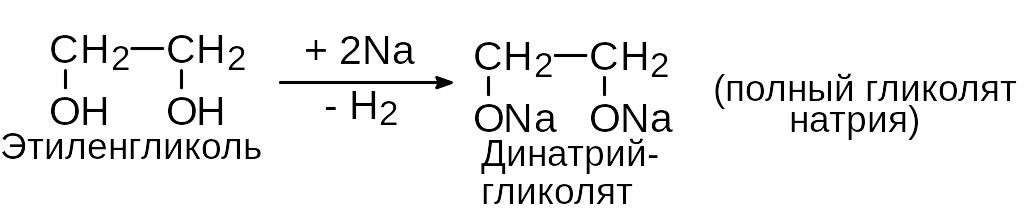
б) благодаря большей кислотности гликоли, в отличие от одноатомных спиртов, взаимодействуют со щелочами:
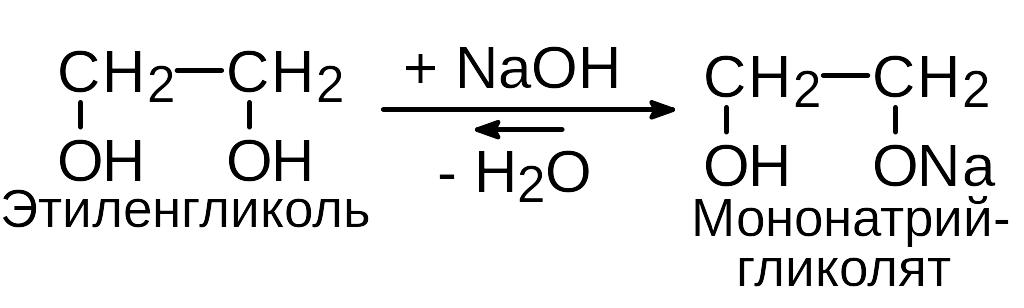
в) гликоли взаимодействуют с гидроксидами тяжелых металлов, образуя комплексы качественная реакция на многоатомные спирты:
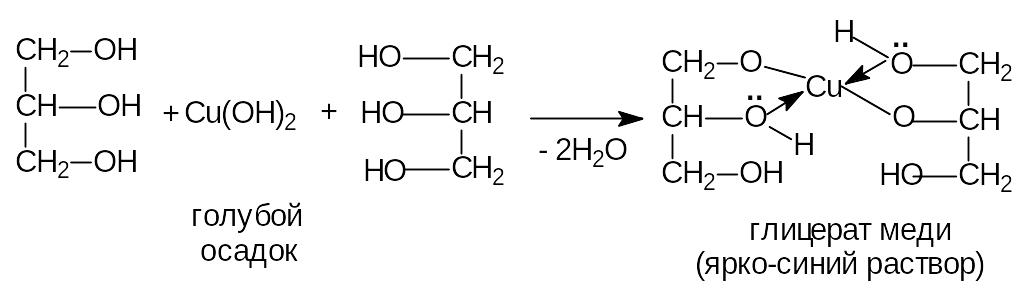
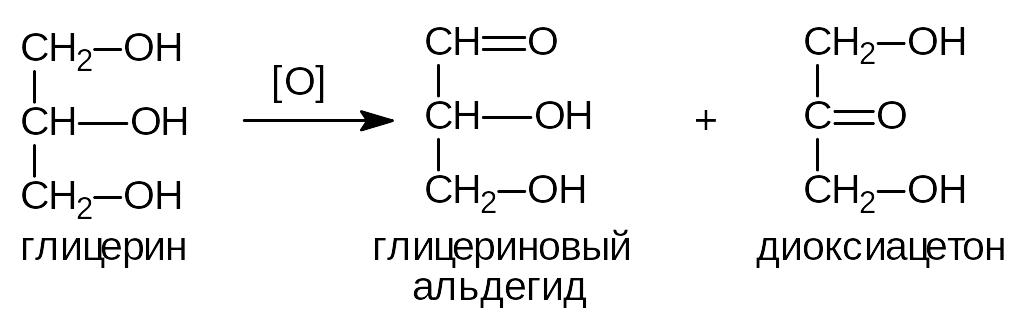
2) Окисление.
3) Этерификация.
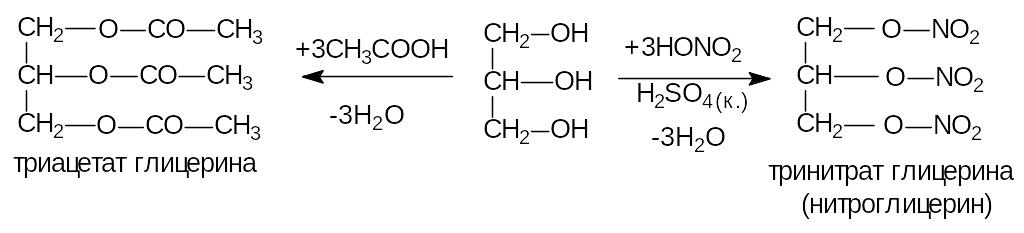
Тринитроглицерин взрывчатое вещество, а также лекарственный препарат, применяется для лечения сердечно-сосудистых заболеваний.
Химические свойства фенолов
![]()
Определяются взаимным влиянием гидроксильной группы и бензольного кольца, в результате которого последнее получает избыточную электронную плотность, что облегчает электрофильное замещение по атомам водорода кольца и одновременно усиливает подвижность гидроксильного протона. Вследствие тех же причин реакции замещения ОН-группы для фенолов не характерны.
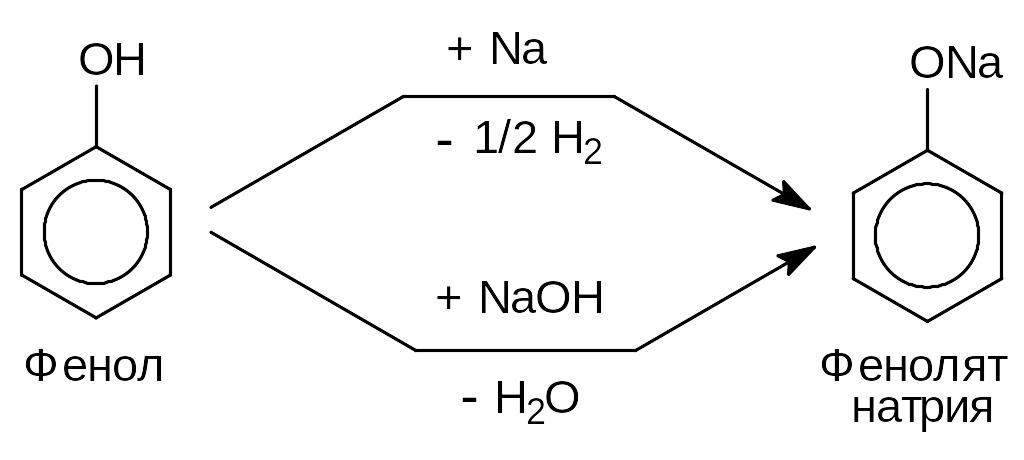
1) Кислотные свойства.
Выражены значительно ярче, чем у алифатических спиртов.
2) Реакции электрофильного замещения в ароматическом цикле.
Благодаря донорному эффекту гидроксильной группы реакции электрофильного замещения у фенола проходят легче, чем у бензола, и в более мягких условиях.
Замещение происходит в орто- и пара-положениях по отношению к гидроксильной группе.
а) Взаимодействие с бромной водой:
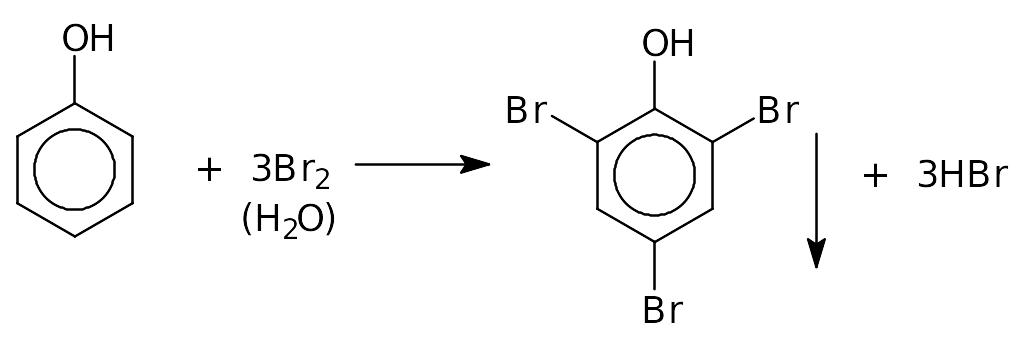
б) Нитрование, в результате которого образуется взрывчатое вещество 2,4,6- тринитрофенол (пикриновая кислота):
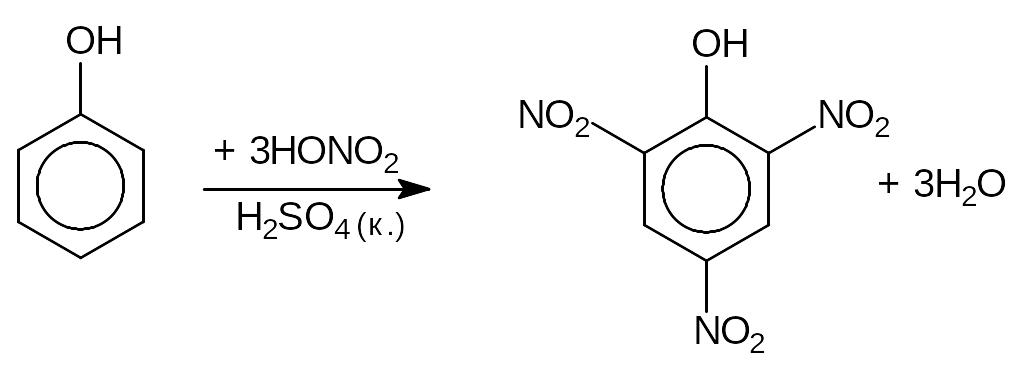
3) Реакция поликонденсации (см. тему “Альдегиды”).
4) Качественная реакция на фенолы - взаимодействие с хлоридом железа(III) с образованием ярко окрашенных комплексных соединений:
6C6H5OH + FeCl3 H3[Fe(OC6H5)6] + 3HCl
а также вышеупомянутая реакция с бромной водой (выпадение белого осадка 2,4,6-трибромфенола).
