
- •Пособие по химии
- •Поступающих в Военно-медицинскую академию
- •Предисловие
- •Раздел I. Общая химия
- •Глава 1. Основные понятия и законы химии
- •Обучающие задачи Моль. Молярная масса
- •Расчеты по химическим формулам. Массовая доля. Вывод формул соединений
- •Законы идеальных газов
- •Расчеты по химическим уравнениям
- •1) Из 80 г оксида меди образуется 64 г меди,
- •2) C 80 г оксида меди реагирует 1 моль водорода,
- •56 Г Fe (1 моль) выделяют 2 г h2
- •24 Г Mg (1 моль) выделяют 2 г h2
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 2. Строение атома. Периодический закон и периодическая система д.И. Менделеева
- •2.1. Строение атома
- •2) В случае равных сумм сначала заполняются орбитали с меньшим значением n.
- •2.2. Периодический закон и периодическая система элементов
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Глава 3. Химическая связь
- •3.1. Ковалентная связь
- •Обучающие задачи
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4.Водородная связь
- •Задания для самостоятельной работы
- •Глава 4. Валентность и степень окисления
- •4.1. Понятие валентности
- •4.2. Степень окисления
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 5. Классификация химических реакций
- •Задания для самостоятельной работы
- •Глава 6. Окислительно-восстановительные реакции
- •6.1. Основные понятия и определения
- •6.2. Методы составления уравнений окислительно-восстановительных реакций
- •6.3. Реакции электролиза
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 7. Растворы. Теория электролитической диссоциации
- •7.1. Основные понятия
- •7.2. Ионные уравнения реакций
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 8. Химическая кинетика
- •8.1. Понятие скорости химической реакции
- •8.2. Влияние концентрации на скорость реакции
- •8.3. Влияние температуры на скорость реакции
- •8.4. Энергия активации
- •8.5. Влияние катализатора на скорость реакции
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 9. Химическое равновесие
- •9.1. Понятие о химическом равновесии
- •9.2. Способы смещения химического равновесия
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 10. Классификация неорганических соединений
- •10.1. Оксиды
- •10.2. Гидроксиды
- •10.2.1. Основания
- •I. Получение щелочей.
- •10.2.2. Кислоты
- •10.2.3. Амфотерные гидроксиды
- •10.3. Соли
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел II. Неорганическая химия
- •Часть I. Химия металлов
- •Глава 11. Общая характеристика металлов
- •I. Взаимодействие с неметаллами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 12. Химия щелочных металлов
- •I. Взаимодействие с неметаллами.
- •II. Взаимодействие со сложными веществами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 13. Химия щелочноземельных металлов
- •13.1. Общая характеристика элементов главной подгруппы II группы
- •13.2. Кальций
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения кальция
- •Ca(oh)2 - гидроксид кальция(II), гашеная известь
- •Гидрид кальция CaH2 и карбид кальция СаС2
- •13.3. Жесткость воды и способы ее устранения
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 14. Химия алюминия Простое вещество
- •II. Взаимодействие cо сложными веществами.
- •Оксид алюминия Al2o3
- •Гидроксид алюминия Al(oh)3
- •Cоли алюминия
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 15. Химия железа Простое вещество
- •II. Взаимодействие со сложными веществами.
- •Соединения железа(II) Оксид железа(II)
- •Гидроксид железа(II)
- •Соединения железа(III) Оксид железа(III)
- •Гидроксид железа(III)
- •Cоли железа(III)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 16. Химия хрома и марганца
- •16.1. Хром
- •Простое вещество
- •Cоли хрома(III)
- •Соединения хрома(VI) Оксид хрома(VI), хромовый ангидрид
- •Кислоты и соли хрома(VI)
- •16.2. Марганец
- •Простое вещество
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 17. Химия меди и цинка
- •17.1. Медь
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения меди(I)
- •Соединения меди(II) Оксид меди(II)
- •Гидроксид меди(II)
- •Cоли меди(II)
- •17.2. Цинк
- •Простое вещество
- •Соединения цинка Оксид цинка ZnO
- •Гидроксид цинка Zn(oh)2
- •Соли цинка
- •Задания для самостоятельной работы
- •Ответы:
- •Часть II. Химия неметаллов
- •Глава 18. Химия водорода
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы:
- •Соединения водорода
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 19. Химия галогенов
- •19.1. Общая характеристика галогенов
- •Водородные соединения галогенов
- •19.2. Хлор
- •Хлороводород и соляная кислота
- •Кислородные кислоты хлора
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 20. Химия элементов подгруппы кислорода
- •20.1. Общая характеристика элементов подгруппы
- •Кислорода
- •20.2. Кислород
- •Простое вещество о2
- •I. Промышленные методы.
- •Простое вещество о3 (озон)
- •Соединения кислорода (с.О. 1) Пероксиды
- •Задания для самостоятельной работы
- •Ответы:
- •20.3. Вода
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •20.4. Сера
- •Простое вещество
- •Соединения серы Сероводород н2s
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Oксид серы(IV), cернистый газ
- •Сернистая кислота h2so3
- •I. Кислотные свойства.
- •II. Окислительно-восстановительные свойства.
- •Оксид серы(VI), cерный газ
- •Серная кислота
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 21. Химия элементов подгруппы азота
- •21.1. Общая характеристика элементов подгруппы азота
- •21.2. Азот
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы.
- •Соединения азота Аммиак
- •II. Лабораторные способы.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли аммония
- •Оксиды азота
- •Азотистая кислота и ее соли
- •Азотная кислота
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли азотной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •21.3. Фосфор
- •Простое вещество
- •Фосфорные кислоты
- •I. В промышленности.
- •II. В лаборатории.
- •Соли ортофосфорной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 22. Химия элементов подгруппы углерода
- •22.1 Общая характеристика элементов подгруппы углерода
- •22.2. Углерод
- •Простое вещество
- •Неорганические соединения углерода с отрицательными степенями окисления (карбиды металлов)
- •Оксид углерода(II)
- •Оксид углерода(IV)
- •Угольная кислота
- •Соли угольной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •22.3. Кремний
- •Простое вещество
- •I. Промышленный способ:
- •II. Лабораторные способы:
- •Соединения кремния (с.О.4) Водородные соединения (силаны)
- •Оксид кремния(IV)
- •Кремниевые кислоты
- •Cоли кремниевых кислот (силикаты)
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел III. Органическая химия
- •Глава 23. Строение и номенклатура органических соединений
- •23.1 Теория строения органических соединений
- •23.2. Номенклатура органических соединений
- •Задания для самостоятельной подготовки
- •Глава 24. Химия углеводородов
- •24.1. Алканы
- •II. Лабораторные методы.
- •24.2. Циклоалканы
- •24.3. Алкены
- •24.4. Диеновые углеводороды
- •24.5. Алкины
- •24.6. Арены
- •I. Реакции электрофильного замещения.
- •III. Реакции окисления.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 25. Кислородсодержащие органические соединения
- •25.1. Спирты и фенолы
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.2. Альдегиды. Кетоны
- •I. Реакции присоединения.
- •II. Реакции полимеризации.
- •III. Реакция поликонденсации.
- •Задания для самостоятельной работы
- •Ответы:
- •25.3. Карбоновые кислоты
- •I. Кислотные свойства.
- •II. Реакции с разрывом связи со (замещение он-группы).
- •III. Реакции с разрывом сн связи у -углеродного атома.
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.4. Сложные эфиры. Жиры
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 26. Химия углеводов
- •26.1. Моносахариды
- •Глюкоза
- •Другие моносахариды
- •26.2. Дисахариды Мальтоза
- •Сахароза
- •26.3. Полисахариды Крахмал
- •Целлюлоза (клетчатка)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 27. Азотсодержащие органические соединения
- •27.1. Амины
- •27.2. Аминокислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
- •28.1. Гетероциклические соединения
- •Пиридин
- •28.3. Нуклеиновые кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •1. Таблица растворимости
Оксид кремния(IV)
Оксид кремния(IV) или кремнезем твердое, очень тугоплавкое вещество, имеет полимерную структуру:
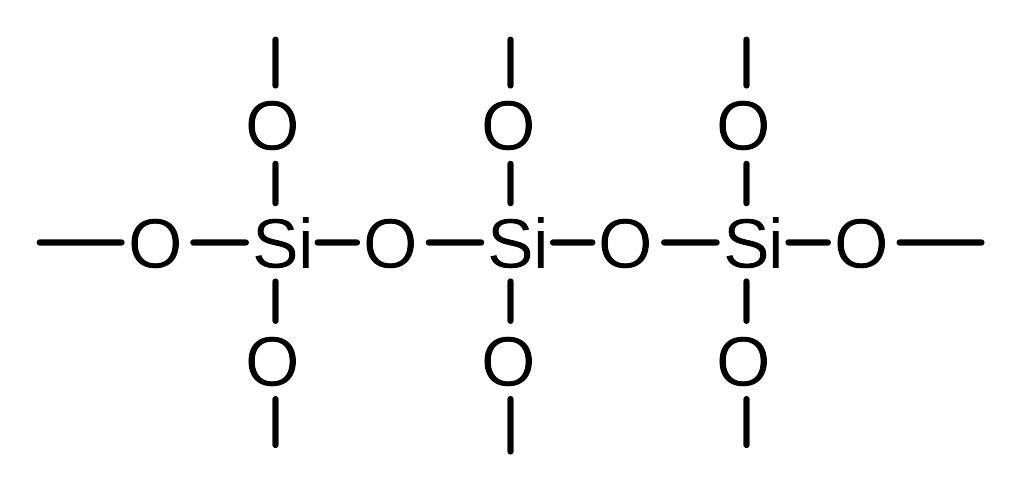
Химические свойства
1) Взаимодействие с плавиковой кислотой (“травление стекла”):
SiO2 + 4HF SiF4 + 2H2O
2) Кислотный оксид ангидрид кремниевой кислоты:
SiO2 + CaO CaSiO3; SiO2 + 2NaOH Na2SiO3 + H2O
SiO2 + Na2CO3 Na2SiO3 + CO2
Na2CO3
+ CaCO3
+ 6SiO2
![]() Na2O
.
CaO
. 6SiO2
+ 2CO2
Na2O
.
CaO
. 6SiO2
+ 2CO2
(сплавление до полного удаления газов) стекло
В отличие от других кислотных оксидов не взаимодействует с водой.
Кремниевые кислоты
Общая формула поликремниевых кислот (SiO2)x(H2O)y, где х и y целые числа. Наиболее часто встречаются H2SiO3 метакремниевая кислота и H4SiO4 ортокремниевая кислота.
Получение метакремниевой кислоты
Na2SiO3 + 2HCl H2SiO3 + 2NaCl
Na2SiO3 + 2H2O + 2CO2 H2SiO3 + 2NaHCO3
Химические свойства
Слабая двухосновная кислота (слабее угольной), плохо растворима в воде. При нагревании легко разлагается:
H2SiO3 SiO2 + H2O
Проявляет все свойства кислот.
Cоли кремниевых кислот (силикаты)
Na2SiO3 и K2SiO3 растворимые в воде силикаты (“жидкие стекла”).
Подвергаются гидролизу по аниону:
![]() +
H2O
D
SiO2
+ 2OH
(щелочная
cреда)
+
H2O
D
SiO2
+ 2OH
(щелочная
cреда)
Задания для самостоятельной работы
1. Осуществить следующие превращения:
а) Si K2SiO3 H2SiO3 SiO2 SiF4
б) SiO2 Si Mg2Si SiH4 SiO2 K2SiO3
в) SiCl4 Si Na2SiO3 Na2CO3 Na2SO4
2. Вывести формулу изумруда в виде оксидов, если известно, что массовые доли бериллия, алюминия, кремния и кислорода в нем соответственно равны: 5.07 %, 10.05 %, 31.48 % и 53.40 %.
3. При сгорании смеси силана и метана выделяется газ, а масса твердого продукта реакции составляет 6 г. После пропускания газообразного продукта через избыток раствора гидроксида натрия образовалось соединение массой 31.8 г. Определить объемный состав исходной смеси и объем кислорода (н.у.), израсходованный при горении газов.
4. При горении смеси кремния и углерода образовалось 3 г твердого вещества (образованием карборунда пренебречь). Выделившийся газ полностью прореагировал до средней соли с 2 л раствора гидроксида натрия с концентрацией 0.2 моль/л. Определить массу исходной смеси.
5. При обработке смеси железа и кремния раствором гидроксида калия выделяется 8.96 л (н.у.) газа. При обработке того же количества смеси соляной кислотой выделяется 2.8 л (н.у.) газа. Найти массу и процентный состав исходной смеси.
6. Имеется смесь кремния, углерода и карбоната кальция. Определить массу каждого компонента в смеси, если известно, что при обработке раствором гидроксида натрия 34 г этой смеси выделяется 22.4 л (н.у.) газа, а при обработке того же количества смеси соляной кислотой выделяется 0.1 моль газа.
7. Вычислить процентный состав смеси, полученной при сплавлении 5.4 г алюминия с 12 г оксида кремния(IV).
8. При обработке 40 г плавикового шпата (СaF2) концентрированной серной кислотой образуется такое количество фтороводорода, при взаимодействии которого с оксидом кремния(IV) выделяется 280 мл (н.у.) газообразного тетрафторида кремния. Вычислить, сколько процентов плавикового шпата прореагировало?
9. Какую массу растворимого стекла Na2SiO3.9H2O необходимо взять для его реакции с 20 мл соляной кислоты с концентрацией 2.5 моль/л?
10. Для варки стекла были взяты оксид кремния, карбонат натрия и карбонат кальция в молярном соотношении 6:1:1. В результате реакции выделилось 16.8 м3 газа (н.у.). Установить состав (выразив его в виде формулы через оксиды) и массу образовавшегося стекла.
11. После сгорания смеси силана и оксида углерода(II) получен газ и 12 г твердого продукта. При пропускании этого газа через избыток раствора гидроксида натрия получили 5.3 г соли. Найти объем газовой смеси (н.у.).
12. Смесь кремния и угля массой 20 г обработали избытком концентрированного раствора щелочи. В результате реакции выделился газ объемом 13.44 л (н.у.). Определить массовую долю (в %) кремния в смеси.
13. При обработке смеси кремния, алюминия и карбоната кальция раствором щелочи выделилось 17.92 л газа (н.у.); при обработке такого же количества смеси соляной кислотой выделилось тоже 17.92 л газа (н.у.), при пропускании которого через раствор гидроксида кальция образовалось 16.2 г кислой кальциевой соли. Установите массовый состав смеси.
14. Сколько литров раствора плавиковой кислоты с концентрацией 10.6 моль/л требуется для растворения 1 кг стекла состава CaO.Na2O. 6SiO2, если стекло не содержит примесей?
15. Прокалили смесь, состоящую из 48 г оксида кремния(IV) и 57.6 г магния. При обработке полученной массы раствором соляной кислоты выделяется 13.44 л (н.у.) водорода. Рассчитать массу образовавшегося кремния.
16. При сплавлении 142 г смеси оксида кремния(IV) и соды масса ее уменьшилась до 115.6 г. Определить состав (по массе) взятой и полученной смесей, если при действии на полученную смесь соляной кислотой выделяется углекислый газ.
