
- •Пособие по химии
- •Поступающих в Военно-медицинскую академию
- •Предисловие
- •Раздел I. Общая химия
- •Глава 1. Основные понятия и законы химии
- •Обучающие задачи Моль. Молярная масса
- •Расчеты по химическим формулам. Массовая доля. Вывод формул соединений
- •Законы идеальных газов
- •Расчеты по химическим уравнениям
- •1) Из 80 г оксида меди образуется 64 г меди,
- •2) C 80 г оксида меди реагирует 1 моль водорода,
- •56 Г Fe (1 моль) выделяют 2 г h2
- •24 Г Mg (1 моль) выделяют 2 г h2
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 2. Строение атома. Периодический закон и периодическая система д.И. Менделеева
- •2.1. Строение атома
- •2) В случае равных сумм сначала заполняются орбитали с меньшим значением n.
- •2.2. Периодический закон и периодическая система элементов
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Глава 3. Химическая связь
- •3.1. Ковалентная связь
- •Обучающие задачи
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4.Водородная связь
- •Задания для самостоятельной работы
- •Глава 4. Валентность и степень окисления
- •4.1. Понятие валентности
- •4.2. Степень окисления
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 5. Классификация химических реакций
- •Задания для самостоятельной работы
- •Глава 6. Окислительно-восстановительные реакции
- •6.1. Основные понятия и определения
- •6.2. Методы составления уравнений окислительно-восстановительных реакций
- •6.3. Реакции электролиза
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 7. Растворы. Теория электролитической диссоциации
- •7.1. Основные понятия
- •7.2. Ионные уравнения реакций
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 8. Химическая кинетика
- •8.1. Понятие скорости химической реакции
- •8.2. Влияние концентрации на скорость реакции
- •8.3. Влияние температуры на скорость реакции
- •8.4. Энергия активации
- •8.5. Влияние катализатора на скорость реакции
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 9. Химическое равновесие
- •9.1. Понятие о химическом равновесии
- •9.2. Способы смещения химического равновесия
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 10. Классификация неорганических соединений
- •10.1. Оксиды
- •10.2. Гидроксиды
- •10.2.1. Основания
- •I. Получение щелочей.
- •10.2.2. Кислоты
- •10.2.3. Амфотерные гидроксиды
- •10.3. Соли
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел II. Неорганическая химия
- •Часть I. Химия металлов
- •Глава 11. Общая характеристика металлов
- •I. Взаимодействие с неметаллами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 12. Химия щелочных металлов
- •I. Взаимодействие с неметаллами.
- •II. Взаимодействие со сложными веществами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 13. Химия щелочноземельных металлов
- •13.1. Общая характеристика элементов главной подгруппы II группы
- •13.2. Кальций
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения кальция
- •Ca(oh)2 - гидроксид кальция(II), гашеная известь
- •Гидрид кальция CaH2 и карбид кальция СаС2
- •13.3. Жесткость воды и способы ее устранения
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 14. Химия алюминия Простое вещество
- •II. Взаимодействие cо сложными веществами.
- •Оксид алюминия Al2o3
- •Гидроксид алюминия Al(oh)3
- •Cоли алюминия
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 15. Химия железа Простое вещество
- •II. Взаимодействие со сложными веществами.
- •Соединения железа(II) Оксид железа(II)
- •Гидроксид железа(II)
- •Соединения железа(III) Оксид железа(III)
- •Гидроксид железа(III)
- •Cоли железа(III)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 16. Химия хрома и марганца
- •16.1. Хром
- •Простое вещество
- •Cоли хрома(III)
- •Соединения хрома(VI) Оксид хрома(VI), хромовый ангидрид
- •Кислоты и соли хрома(VI)
- •16.2. Марганец
- •Простое вещество
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 17. Химия меди и цинка
- •17.1. Медь
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения меди(I)
- •Соединения меди(II) Оксид меди(II)
- •Гидроксид меди(II)
- •Cоли меди(II)
- •17.2. Цинк
- •Простое вещество
- •Соединения цинка Оксид цинка ZnO
- •Гидроксид цинка Zn(oh)2
- •Соли цинка
- •Задания для самостоятельной работы
- •Ответы:
- •Часть II. Химия неметаллов
- •Глава 18. Химия водорода
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы:
- •Соединения водорода
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 19. Химия галогенов
- •19.1. Общая характеристика галогенов
- •Водородные соединения галогенов
- •19.2. Хлор
- •Хлороводород и соляная кислота
- •Кислородные кислоты хлора
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 20. Химия элементов подгруппы кислорода
- •20.1. Общая характеристика элементов подгруппы
- •Кислорода
- •20.2. Кислород
- •Простое вещество о2
- •I. Промышленные методы.
- •Простое вещество о3 (озон)
- •Соединения кислорода (с.О. 1) Пероксиды
- •Задания для самостоятельной работы
- •Ответы:
- •20.3. Вода
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •20.4. Сера
- •Простое вещество
- •Соединения серы Сероводород н2s
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Oксид серы(IV), cернистый газ
- •Сернистая кислота h2so3
- •I. Кислотные свойства.
- •II. Окислительно-восстановительные свойства.
- •Оксид серы(VI), cерный газ
- •Серная кислота
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 21. Химия элементов подгруппы азота
- •21.1. Общая характеристика элементов подгруппы азота
- •21.2. Азот
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы.
- •Соединения азота Аммиак
- •II. Лабораторные способы.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли аммония
- •Оксиды азота
- •Азотистая кислота и ее соли
- •Азотная кислота
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли азотной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •21.3. Фосфор
- •Простое вещество
- •Фосфорные кислоты
- •I. В промышленности.
- •II. В лаборатории.
- •Соли ортофосфорной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 22. Химия элементов подгруппы углерода
- •22.1 Общая характеристика элементов подгруппы углерода
- •22.2. Углерод
- •Простое вещество
- •Неорганические соединения углерода с отрицательными степенями окисления (карбиды металлов)
- •Оксид углерода(II)
- •Оксид углерода(IV)
- •Угольная кислота
- •Соли угольной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •22.3. Кремний
- •Простое вещество
- •I. Промышленный способ:
- •II. Лабораторные способы:
- •Соединения кремния (с.О.4) Водородные соединения (силаны)
- •Оксид кремния(IV)
- •Кремниевые кислоты
- •Cоли кремниевых кислот (силикаты)
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел III. Органическая химия
- •Глава 23. Строение и номенклатура органических соединений
- •23.1 Теория строения органических соединений
- •23.2. Номенклатура органических соединений
- •Задания для самостоятельной подготовки
- •Глава 24. Химия углеводородов
- •24.1. Алканы
- •II. Лабораторные методы.
- •24.2. Циклоалканы
- •24.3. Алкены
- •24.4. Диеновые углеводороды
- •24.5. Алкины
- •24.6. Арены
- •I. Реакции электрофильного замещения.
- •III. Реакции окисления.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 25. Кислородсодержащие органические соединения
- •25.1. Спирты и фенолы
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.2. Альдегиды. Кетоны
- •I. Реакции присоединения.
- •II. Реакции полимеризации.
- •III. Реакция поликонденсации.
- •Задания для самостоятельной работы
- •Ответы:
- •25.3. Карбоновые кислоты
- •I. Кислотные свойства.
- •II. Реакции с разрывом связи со (замещение он-группы).
- •III. Реакции с разрывом сн связи у -углеродного атома.
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.4. Сложные эфиры. Жиры
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 26. Химия углеводов
- •26.1. Моносахариды
- •Глюкоза
- •Другие моносахариды
- •26.2. Дисахариды Мальтоза
- •Сахароза
- •26.3. Полисахариды Крахмал
- •Целлюлоза (клетчатка)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 27. Азотсодержащие органические соединения
- •27.1. Амины
- •27.2. Аминокислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
- •28.1. Гетероциклические соединения
- •Пиридин
- •28.3. Нуклеиновые кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •1. Таблица растворимости
Ответы:
2. 100 мл О2, 300 мл H2S. 3. CS2. 4. 6.02.1020. 5. 187.2 мл. 6. 390 л N2, 55.78 л O2, 35.84 л SO2. 7. 20.4 %. 8. 3.2 г. 9. 1.12 л. 10. 44.56%. 11. Na2SO3. 12. ZnS, 57 мл. 13. 22.4 г Fe, 6.4 г S. 14. 0.88 г FeS, 14.56 мл. 15. 0.112 л. 16. 3.2 г. 17. 64.16 %. 18. 13.1 г Zn, 18.95 г Cu. 19. 1:2. 20. 10 г CaCO3, 19.4 г ZnS, 10.6 г NaCl. 21. 0.2 моля, 0.05 моля. 22. 96 г Cu. 23. 104 г BaCl2. 24. 23.3 г BaSO4.
Глава 21. Химия элементов подгруппы азота
21.1. Общая характеристика элементов подгруппы азота
В главную подгруппу пятой группы входят азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi.
Общее название этих элементов - пниктогены.
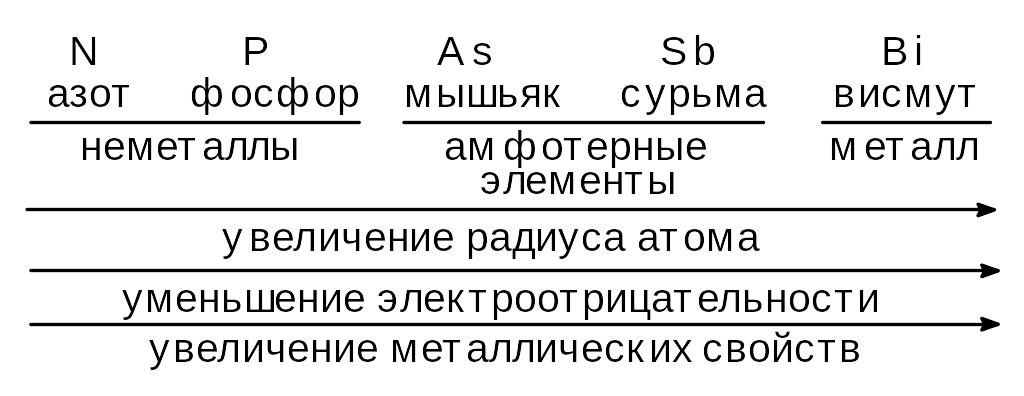
Электронное строение внешнего уровня: ns2 np3 (n номер периода).
Характерная валентность III, возможная IV (азот), V (фосфор, мышьяк, сурьма и висмут).
Проявляют степени окисления от 3 до +5, хотя для сурьмы и висмута отрицательные степени окисления мало характерны.
Важнейшие формы кислотных оксидов Э2О3 и Э2О5, им соответствуют гидроксиды типа НЭО2 или Н3ЭО3 [Э(ОН)3] и НЭО3 [Н3ЭО4].
Кислотные свойства гидроксидов от азота к висмуту уменьшаются, основные увеличиваются. При степени окисления атома +3 гидроксиды азота и фосфора кислоты, мышьяка и сурьмы амфотерные соединения, гидроксид висмута основание. При степени окисления +5 все гидроксиды этих элементов кислоты, сила которых уменьшается при переходе от азота к висмуту.
Устойчивость кислородных соединений со степенью окисления +3 в том же направлении увеличивается, со степенью окисления +5 ослабевает, поэтому P3 хороший восстановитель a Bi5 сильный окислитель:
P2O3 + O2 P2O5 ; PCl3 + Cl2 PCl5
5NaBiO3 +2Mn(NO3)2 +16HNO3 2HMnO4+ 5Bi(NO3)3 +7H2O + 5NaNO3
Элементы подгруппы азота образуют газообразные водородные соединения ЭН3, устойчивость которых резко падает от азота к висмуту.
21.2. Азот
Основные изотопы: 14N, 15N.
Электронное строение атома: 1s22s22p3.
Валентность: III, IV (по донорно-акцепторному механизму).
Степени окисления: 3, 2, 1, 0, +1, +2, +3, +4, +5.
Входит в состав белков и ферментов (строительный материал клеток и участие в обмене веществ); нуклеиновых кислот (передача наследственной информации); играет важную роль в энергетике клетки (входит в состав АТФ).
Простое вещество
Бесцветный газ без вкуса и запаха, очень плохо растворим в воде. Главная составная часть воздуха (78.09 % по объему и 75.51 % по массе). Встречается также в виде селитр (NaNO3, KNO3). В природе связывание (фиксация) азота происходит с помощью азотфиксирующих микроорганизмов, которые живут в клубеньках корней бобовых растений.
В медицине применяется как хладоагент в криотерапии.
Получение
I. Промышленные способы.
1) Ректификация жидкого воздуха (см. получение кислорода).
2) Удаление кислорода из воздуха:
2С(кокс) + O2 2CO
II. Лабораторные способы.
1) Разложение нитрита аммония при нагревании:
NH4NO2 N2 +2H2O
2) Сжигание аммиака:
![]()
3) Взаимодействие с оксидом меди(II):
2NH3 + 3CuO 3Cu + N2 + 3H2O
Химические свойства
Молекула азота очень прочна (Есвязи = 945 кДж/моль), в связи с чем крайне инертна.
1) Взаимодействие с металлами (при комнатной температуре только с литием).
6Li + N2
2Li3N;
3Mg + N2![]() Mg3N2
Mg3N2
2) Взаимодействие с водородом (см. ниже).
3) Взаимодействие с кислородом (только при грозовых разрядах).
N2 + O2 2NO
