
- •Лабораторна робота № 1 техніка безпеки при зварюванні
- •1.1 Обладнання і прилади
- •1.2 Основні джерела небезпеки та види травматизму
- •1.3 Заходи захисту
- •1.4 Запитання для самоперевірки
- •1.5 Порядок виконання роботи
- •1.6 Оформлення звіту з лабораторної роботи
- •Лабораторна робота № 2 дослідження процесу кристалізації
- •2.1 Обладнання і прилади
- •2.2 Короткі теоретичні відомості
- •2.3 Порядок виконання роботи
- •2.4 Оформлення звіту до лабораторної роботи
- •2.5 Питання для самоперевірки
- •Лабораторна робота № 3 визначення твердості металів та вплив на неї різних видів термообробки
- •3.1 Обладнання, інструменти, матеріали
- •3.3 Визначення твеpдості способом Роквелла
- •3.4 Визначення твердості за методом Віккерса
- •3.5 Порядок виконання роботи
- •3.6 Офоpмлення звіту до лабоpатоpної pоботи
- •3.7 Запитання для самоперевірки
- •Лабораторна робота № 4 вивчення мікроСтруктурИ сталі та чавуну
- •4.1Устаткування, інструменти, матеріали
- •4.2Основні відомості про структуру сталей у зрівноваженому стані
- •4.3 Основні відомості про структуру чавунів
- •4.4 Порядок виконання роботи
- •4.5 Запитання для самоперевірки
- •Лабораторна робота № 5 ручне електродугове зварювання металів
- •5.1 Обладнання, прилади і матеріали
- •5.2 Основні теоретичні положення
- •5.3 Запитання для самоперевірки
- •5.4 Порядок виконання роботи
- •5.5 Оформлення звіту
- •Лабораторна робота 6 основні джерела зварювального струму та їх вольтамперні характеристики
- •6.1 Прилади й обладнання
- •6.2 Основні теоретичні положення
- •6.3 Запитання для самоперевірки
- •6.4 Порядок виконання роботи
- •6.5 Оформлення звіту
- •Лабораторна робота № 7 визначення зварювальних коефіцієнтів
- •7.1 Обладнання, інструмент, матеріали
- •7.2 Основні теоретичні положення
- •7.3 Запитання для самоперевірки
- •7.4 Порядок виконання роботи
- •7.5 Оформлення звіту
- •Лабораторна робота №8 дефекти зварних з'єднань і контроль якості зварювання
- •8.1 Обладнання, прилади і матеріали
- •8.2 Дефекти зварних з'єднань
- •8.3 Контроль якості зварних з'єднань
- •8.4 Порядок виконання роботи
- •8.5 Запитання для самоперевірки
- •8.6 Оформлення звіту про роботу
- •Лабораторна робота № 9 газове зварювання і вогневе різання металів
- •9.1 Обладнання, прилади, інструменти
- •9.2 Основні теоретичні положення
- •9.3 Запитання для самоперевірки
- •9.4 Порядок виконання роботи
- •Лабораторна робота № 10 вивчення структури і твердості зварних з'єднань
- •10.1 Обладнання, прилади і матеріали
- •10.2 Основні теоретичні положення
- •10.3 Порядок виконання роботи
- •10.4 Запитання для самоперевірки
- •10.5 Оформлення звіту про роботу
- •Література
1.4 Запитання для самоперевірки
1. Назвіть основні джерела небезпеки під час зварювання.
2. Які травми можуть бути викликані електричним струмом?
3. Перерахуйте заходи електробезпеки в процесі зварювання.
4. Назвіть заходи захисту від світлової радіації.
5. Заходи захисту від шкідливих виділень.
6. Назвіть заходи безпеки при газовому зварюванні.
7. Назвіть причини виникнення вибухів під час зварювання.
8. Перерахуйте заходи протипожежної безпеки.
9. Правила транспортування і зберігання балонів з киснем і горючими газами.
10. Заходи безпеки під час зварювання на висоті.
1.5 Порядок виконання роботи
Користуючись методичними вказівками, самостійно опрацювати матеріал з основних джерел безпеки і заходів із попередження травматизму під час зварювання.
За допомогою викладача ознайомитися з обладнанням дугового й газового зварювання.
1.6 Оформлення звіту з лабораторної роботи
При оформленні звіту необхідно:
- указати мету роботи;
- перерахувати і коротко пояснити основні джерела небезпеки під час зварювання і заходи безпеки при веденні зварювальних робіт;
- зробити висновки про небезпеку ведення зварювальних робіт.
Лабораторна робота № 2 дослідження процесу кристалізації
Мета роботи – вивчити процес кристалізації солей із перенасичених розчинів. На підставі спостережень процесу кристалізації солей одержати уявлення про кристалізацію металів і вивчити чинники, що впливають на характер кристалізації.
2.1 Обладнання і прилади
Біологічний мікроскоп; перенасичені водні розчини солей Pb(NO3)2, CuSO4, NaCl, NH4Cl, K2Cr2O7; предметні скельця; водяна лазня для підігріву розчинів.
2.2 Короткі теоретичні відомості
Механізм процесу кристалізації. Більше 100 років тому було висловлене припущення, що процес кристалізації полягає в утворенні центрів (зародків) кристалізації й у їх рості. Перед тим , як роздивитися, як це відбувається, необхідно розібратися, у чому принципове розходження в будові рідкої і кристалічної фаз. Установлено, що це розходження полягає у ступені порядку в розташуванні часток. Розміщення атомів у кристалі й у рідині щодо якогось конкретного атома наведене на рис. 2.1.

Рисунок 2.1 – Схема кристалізації: а) впорядкована кристалічна укладка атомів; б) не впорядкована кристалічна укладка атомів
У випадку кристалічної укладки атомів (рис. 2.1, а) існує порядок у їх розташуванні як поблизу атома А, так і на відстані від нього. Тому говорять про наявність у кристалі як ближнього, так і далекого порядку упаковування. Для рідкої фази (мал. 2.1, б) поблизу атома А також спостерігається порядок (шість атомів своїми центрами розташовуються близько від кола, проведеного з центра атома А). З віддаленням від атома А порядок усе більше порушується. Тому можна говорити про наявність у рідини близького і відсутності далекого порядку.
Щоб зрозуміти механізм процесу кристалізації як і інших перетворень, пов'язаних із переміщенням атомів, необхідно в думках проекспериментувати з використанням категоріального апарата діалектичної логіки. Варто нагадати, що категорії діалектичної логіки не є тільки прийомами мислення, а відбивають при мисленні найбільш загальні закони природи.
Як відзначалося, процес кристалізації складається з утворення центрів кристалізації і росту цих центрів. Кількість цих центрів залежить від параметрів і ступеня переохолодження системи.
На рис. 2.2 показана залежність числа центрів (Ч.Ц.) і швидкості росту кристалів (Ш.Р.) від ступеня переохолодження Т. Із рисунку 2.2 видно, що центри кристалізації утворюються тільки при температурі нижче від Тs. При Т<Тs кристалічні утворення стають стійкими і будуть рости, оскільки їх ріст буде супроводжуватися зменшенням термодинамічного потенціалу.
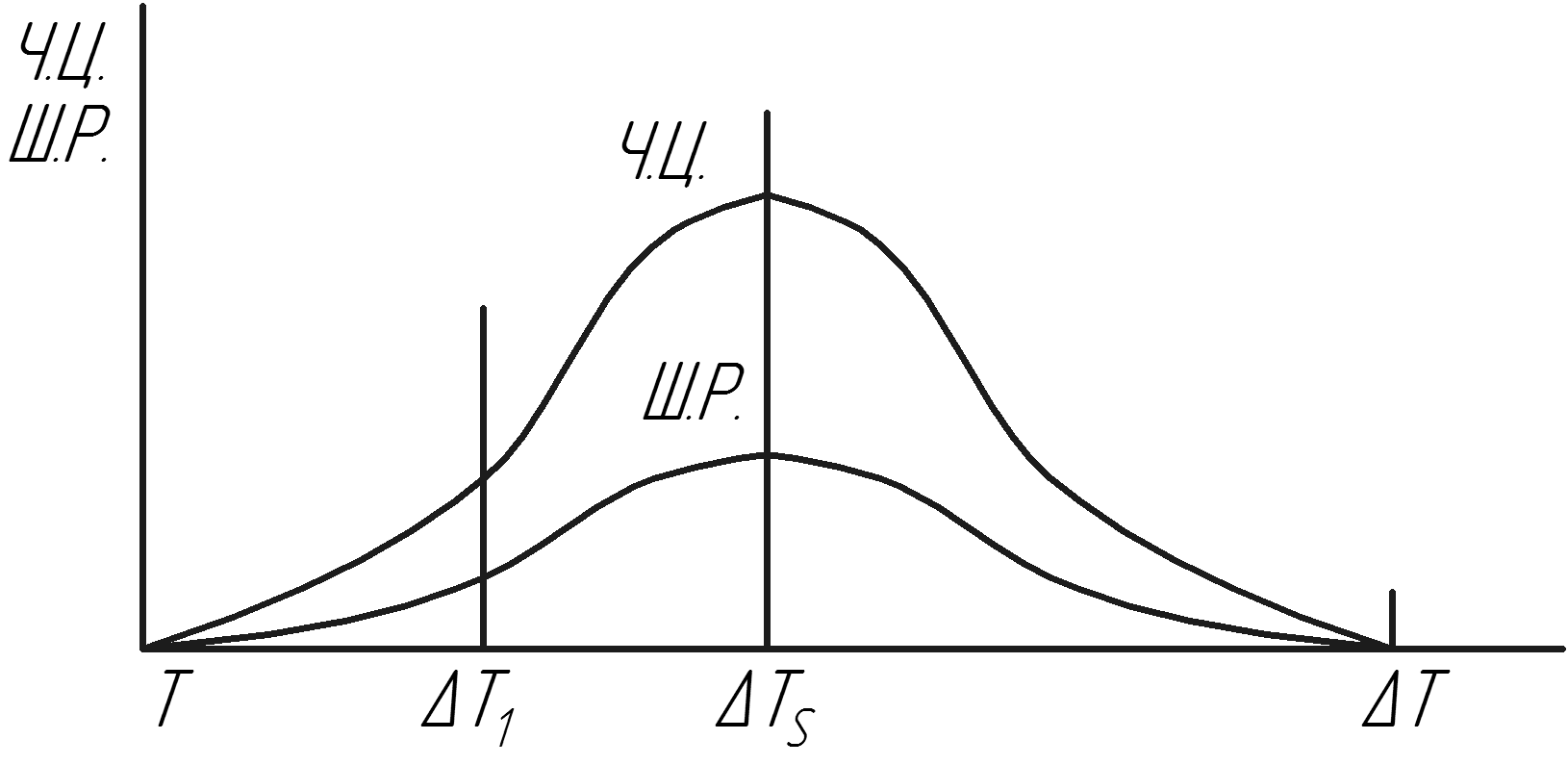
Рисунок 2.2 – залежність числа центрів і швидкості
росту кристалів від ступеня переохолодження Т
Використовуючи метод уявного моделювання фізичних процесів для вивчення механізму кристалізації речовини, проаналізуємо процес структуроутворення при різноманітних ступенях переохолодження.
Припустимо, що кристалізація йде при малому ступені переохолодження (див. рис. 2.3). Уявимо собі, що за цих умов число центрів (Ч.Ц.) складає чотири кристали в секунду. Рисунок 2.3, 2 с, відбиває систему в перший момент спостереження. Через секунду ці кристали виросли згідно зі значенням швидкості росту (Ш.Р.), утворилися нові чотири центри і т.д. Власне, до кінця спостереження (7 с) кристалізація закінчилася (рідкої фази більше немає). Із русунка видно, що спочатку, коли кристали малі, вони мають багатогранну форму. У міру збільшення числа кристалів (4–6 с) у процесі росту вони зіштовхуються один з одним і втрачають правильну форму. Такі кристали називаються кристалітами або зернами. Оскільки ці кристали випадково зорієнтовані один до одного, то, очевидно, що в місцях стику зерен (меж зерен) утворилась сильно перекручена кристалічна ґратки.

Рисунок 2.3 – Інтенсивність росту кристалів
При вивченні матеріалу, пов'язаного з кристалізацією, вдалося з'ясувати, звідки беруться центри кристалізації і що рідкий стан не можна абсолютизувати: у рідині є утворення, подібні до кристалічних. Після кристалізації також виникає не тільки впорядкований стан – розташування часток біля меж зерен, але і невпорядкований, тобто подібний рідкому. Процеси, що відбуваються при охолодженні речовини з рідкого стану, підтверджують дієвість таких категорій, як кількість і якість та перехід кількості в нову якість. Справді, при зниженні температури до температур стійкого стану рідкої фази ‑ рідина. При подальшому зниженні температури стійким стає кристалічний стан. Кристалізація є наслідком зменшення термодинамічного потенціалу речовини за рахунок зниження температури.
