
- •42.. Ионное произведение воды. Водородный показатель (pH раствора)
- •43,Гидролиз солей. Гидролиз по катиону, гидролиз по аниону (примеры). Константа и степень гидролиза.
- •44Буферные р-ры, их классификация и состав
- •8. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •9. Химическая связь: понятие, параметры (энергия связи, длина связи, валентный угол), потенциал ионизации, сродство к электрону, электроотрицательность.
- •11. Метод валентных связей (- и -связи), метод молекулярных орбиталей, гибридизация атомных орбиталей.
- •10.Типы химической связи: ионная, ковалентная ( типы ковалентной связи, полярность), координационная, металлическая, водородная.
- •12. Термодинамические системы: открытые, закрытые, изолированные; гомогенные и гетерогенные. Параметры системы.
- •13. Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
- •14.Первое (закон сохранения энергии) и второе начало термодинамики.
- •15. Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества.
- •16.Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа.
- •18. Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
- •19. Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •20.Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •21. Осмотическое давление. Законы Вант-Гоффа и Рауля.
- •23.Степень диссоциации. Сильные (активность, коэффициент активности, ионная сила) и слабые (константа диссоциации, закон разведения Оствальда) электролиты.
- •22. Растворы электролитов. Изотопический коэффициент. Теория электролитической диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу.
- •24. Малорастворимые электролиты, произведение растворимости.
- •25. Константа воды. Водородный показатель (pH).
- •26. Буферные растворы.
- •27.Гидролиз солей: типы, константа и степень гидролиза.
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •30. Электродные процессы: двойной электрический слой, (стандартный) электродный потенциал.
- •29. Методы составления уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •31. Химические источники тока: гальванические элементы (эдс), топливные элементы, аккумуляторы.
- •32. Электролиз: понятие, отличие от гальванического элемента; электролиз расплавов солей и растворов электролитов. Закон Фарадея.
- •33. Коррозия металлов: понятие, виды (химическая, электрохимическая), защита металлов от коррозии.
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •35. Гетерогенные дисперсные системы (типы систем, поверхностные явления).
- •36. Химические свойства s-элементов, их оксидов и гидроксидов.
- •37. Жесткость воды (временная, постоянная), способы ее устранения.
40 Сила кислот и оснований. Силовой показатель (рКк) и основания (рКо). Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Для кислот характерны следующие свойства: способность взаимодействовать с основаниями с образованием солей; способность взаимодействовать с некоторыми металлами с выделением водорода; способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса. Кислый вкус; При диссоциации любой кислоты образуются ионы водорода. С устранением ионов водорода, например при нейтрализации, исчезают кислотные свойства. Усильных кислот, диссоциирующих нацело, свойства кислот проявляться в большей степени, у слабых – в меньшей. Основания. Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами. Водородные растворы оснований обладают следующими свойствами. Способность взаимодействовать с кислотами с образованием солей; Способность изменять цвет индикаторов иначе, чем кислоты (например, они вызывают сильную окраску лакмуса);Своеобразным «мыльным» вкусом; Сила оснований, как кислот зависит от величины константы протолиза. Чем больше константа основности данного основания, чем оно сильнее.
42, Кислотно-основные индикаторы и механизм их действия.
Индикаторы (позднелат. indicator - указатель), химические вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации какого-либо компонента в растворе. В лабораторной практике широко используются некоторые органические
вещества, обладающие способностью менять свою окраску при изменении
характера среды. Такие вещества называются кислотно-основными
индикаторами. Среди них встречаются универсальные (такие, как лакмус,
метилоранж), меняющие окраску в каждой из трех сред (кислой, нейтральной,
щелочной). Например, лакмус фиолетовый в нейтральной среде, краснеет в
кислой и приобретает синий цвет в щелочной среде. Известны индикаторы
“узкой специализации” – избирательного действия. Так, фенолфталеин в
нейтральной и кислой средах остается бесцветным, тогда как в щелочной среде
резко изменяет окраску на малиновую.
Принцип действия таких кислотно-основных индикаторов базируется на
том, что они, являясь слабыми органическими кислотами или основаниями,
характеризуются разной окраской диссоциированной и недиссоциированной
форм.
.
Кислотно-основные индикаторы позволяют не только на качественном уровне
определять кислотность и основность водных сред, но и помогают
количественно оценивать показатели этих свойств.
42.. Ионное произведение воды. Водородный показатель (pH раствора)
Вода — слабый электролит, который незначительно диссоциирует на ионы Н+ и ОН-: Н2OН++ОН- Константа диссоциации воды: KD= [H+][OH-]/[H2O] (3) была вычислена при помощи измерений по электрической проводимости: KD=1,810-16. Такое значение KD указывает на крайне незначительную диссоциацию воды. Следовательно, концентрацию воды [Н2О] в знаменателе выражения (3) можно считать величиной постоянной и равной [Н2O]=(1000 г/л)/(18г/моль) =5,56 моль/л и [Н2О]•KD=55,56•1,8•10-16=l0-14 Величина KW=KD•[Н2О]=10-14 называется ионным произведением воды и является константой как для чистой воды, так и для разбавленных растворов. Ионное произведение воды увеличивается при повышении температуры. Можно также записать: KW=[Н+][ОН-] (4) Из этого выражения для ионного произведения воды видно, что в чистой воде концентрация гидроксид-ионов и ионов водорода равна: 10-14 =10-7 моль/лKW =[Н+]=[ОН-]= Если разбавленный раствор содержит больше ионов водорода, чем 10-7 моль/л, то соответственно концентрация гидроксид-ионов уменьшится во столько раз, во сколько увеличилась концентрация ионов Н+. Это следует из уравнения (4). Концентрация ионов водорода и гидроксид-ионов важна в химии растворов, поэтому была введена специальная величина — водородный показатель, или pH. По определению, водородный показатель есть обратный логарифм концентрации ионов H+: pH=-lg[H+]. pH чистой воды равен -lg10-7=7. Если в растворе концентрация ионов Н+ больше, чем 10-7 моль/л, то pH такого раствора будет меньше 7, что является показателем кислой среды раствора, Если же [Н+]<10-7 моль/л, то pH>7, и раствор имеет щелочную реакцию.
Для определения среды растворов используются приборы, называемые pH-метрами. Быстрый анализ можно провести, если в исследуемый раствор добавить одну-две капли кислотно-основного индикатора, т.е. такого вещества, которое под действием ионов Н+ и ОН- может резко изменять свою окраску. Изменения окрасок наиболее распространенных индикаторов приведены ниже.
43,Гидролиз солей. Гидролиз по катиону, гидролиз по аниону (примеры). Константа и степень гидролиза.
Реакция взаимодействия между растворителем и растворенным веществом носит название сольволиза, а для водных растворов – гидролиза.
Гидролизу могут подвергаться химические соединения различных классов: соли, углеводы, белки, жиры и т.д. В неорганической химии чаще всего приходится иметь дело с гидролизом солей, рассматриваемым как обменное взаимодействие ионов, образующихся при диссоциации соли, с молекулами воды. Катионы и анионы соли характеризуются небольшими зарядами и значительными размерами, их поляризующее влияние на молекулы воды невелико. В этом случае взаимодействия практически не происходит. Среди множества ионов указанными свойствами обладают, прежде всего, катионы щелочных и щелочно-земельных металлов и анионы сильных кислот. По этой причине соли, образованные сильными основаниями и сильными кислотами не гидролизуются. В этом случае равновесие диссоциации воды практически не нарушается. Если катионы обладают указанными выше свойствами, а анионы, напротив, вступают в интенсивное взаимодействие с молекулами воды, то происходит гидролиз по аниону. Если же катионы обладают значительным поляризующим действием, а анионы его проявляют крайне слабо, идет гидролиз по катиону. Такая ситуация возникает в том случае, если соль образована слабым основанием и сильной кислотой. Примером такого гидролиза могу служить процессы


Для
количественной характеристики
гидролиза применяют степень гидролиза
и константу гидролиза, аналогичные
соответствующим характеристикам
процесса диссоциации. Так, степень
гидролиза определяется долей
гидролизовавшихся частиц в растворе.
Выражение для константы гидролиза
составляется по общим правилам,
например:
 =
=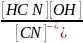 Константа
гидролиза
Константа
гидролиза
44Буферные р-ры, их классификация и состав
.растворы с определенной концентрацией водородных ионов, содержащие сопряженную кислотно-основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительных изменениях концентрации либо при добавлении небольшого количества кислоты или щелочи.
Буферный раствор состоит из слабой кислоты и соли, содержащей тот же, что и в кислоте, анион, либо из слабого основания и соли с тем же, что в основании, катионом. Примером буферной системы может служить HCN + NaCN. Тканевая жидкость, кровь, моча и другие биологические жидкости являются буферными растворами. Благодаря действию их буферных систем поддерживается относительное постоянство водородного показателя внутренней среды, обеспечивающее полноценность метаболических процессов (см. Гомеостаз). Наиболее важной буферной системой является бикарбонатная система крови (Кровь). Концентрация в крови бикарбонатов служит одним из основных показателей кислотно-щелочного состояния организма. Этот показатель позволяет установить характер нарушения кислотно-щелочного равновесия (Кислотно-щелочное равновесие) при ряде патологических
46
Окислительно-восстановительные реакции
и их типы.
Окислительно-восстановительные
называют реакции, протекающие с
изменением степени окисления атомов.
Под степенью окисления понимают условный
заряд атома в молекуле, вычисленный
исходя из предположения, что молекула
состоит только из ионов. Окислением
называется процесс отдачи электронов.
Степень окисления при этом повышается.
Например: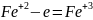 ’
’ -e=
-e= .Восстановлением
называеться процесс присоеденения
электронов. Степень окисления при этом
понижаеться. Например:
-
2e=
Окислительно-восстановительные
реакции можно разделить на четыре
класса: межмолекулярные, внутримолекулярные,
реакции диспропорционирования и
реакции сопропорционирования.
Межмолекулярные реакции характеризуются
следующим признаком: атом-окислитель
и атом-восстановитель входят в состав
разных веществ. В случае внутримолекулярных
реакций атом-окислитель и
атом-восстановитель, являясь атомами
разных элементов, входят в состав
одного и того же вещества. Например: 2
K
.Восстановлением
называеться процесс присоеденения
электронов. Степень окисления при этом
понижаеться. Например:
-
2e=
Окислительно-восстановительные
реакции можно разделить на четыре
класса: межмолекулярные, внутримолекулярные,
реакции диспропорционирования и
реакции сопропорционирования.
Межмолекулярные реакции характеризуются
следующим признаком: атом-окислитель
и атом-восстановитель входят в состав
разных веществ. В случае внутримолекулярных
реакций атом-окислитель и
атом-восстановитель, являясь атомами
разных элементов, входят в состав
одного и того же вещества. Например: 2
K = 2 KCl
+3
= 2 KCl
+3 Окислительно-восстановительные
реакции, в которых в процессе окисления
и в процессе восстановления образуются
одни и те же продукты, называют
реакциями сопропорционирования.
Реакции диспропорционирования
происходят в результате окисления
и восстановления одного и того же
атома, находящегося в промежуточной
степени окисления,
напрмер:3
HN
Окислительно-восстановительные
реакции, в которых в процессе окисления
и в процессе восстановления образуются
одни и те же продукты, называют
реакциями сопропорционирования.
Реакции диспропорционирования
происходят в результате окисления
и восстановления одного и того же
атома, находящегося в промежуточной
степени окисления,
напрмер:3
HN = HN
= HN + 2 NO
+
+ 2 NO
+
 O
O
