
- •1) Основные законы химии: сохранения массы и энергии, постоянство состава, эквивалентов и Авогадро.
- •2) Закон постоянства состава с современной точки зрения. Соединения постоянного и переменного состава.
- •3) Закон эквивалентов. Эквивалент элементов и соединений.
- •4) Классы неорганических соединений.
- •5) Модель строения атома Резерфорда
- •6) Теория строения атома Бора. Недостатки теории строения.
- •7) Принципы квантов механики: дискретность энергии, корпускулярно-волновой дуализм, принципы неопределенности Гейзенберга.
- •8) Уравнение Шредингера. Смысл волновой функции.
- •9) Квантовые числа. Их значение и сущность.
- •10) Электронного уравнения, подуровня, орбитали.
- •11) Правила и принципы, определяющие последовательность формирования электронных уровня и подуровня.
- •13) Периодический закон д.И.Менделеева. Периодичность в изменении различных свойств элементов(потенциал ионизации, сродство к электрону, атомные радиусы)/
- •14) Сходство и различие химических свойств элементов главных и побочных подгрупп в связи с электронным строением атома/
- •15) Химическая связь. Виды химической связи. Энергетические и геометрические характеристики связи.
- •16) Природа химической связи. Энергетические эффекты в процессе образования химической связи.
- •17) Основные положения метода Валентных связей. Обменный и донорно-акцепторный механизма образования ковалентной связи.
- •18) Валентные возможности атомов в основном и в возбужденном состоянии.
- •20) Насыщаемость ковалентной связи. Понятие валентности.
- •21) Полярность ковалентной связи. Теория гибридизации. Виды гибридизации. Примеры.
- •22) Полярность ковалентной связи. Дипольный момент.
- •23) Достоинства и недостатки метода в.С.
- •24) Метод молекулярных орбиталей. Основные понятия.
- •25) Описать методы мо связи в биполярных и много центровых молекулах(b2 o2 BeH2 BeF2).
- •26) Ионная связь предельный случай ковалентно-полярной связи. Свойства ионной связи. Основные виды кристаллических решеток для соединения с ионной связью.
- •27) Металлическая связь. Особенности. Элементы зонной теории для объяснения особенностей металлической связи.
- •28) Межмолекулярное взаимодействие. Ориентационный, индукционный и дисперсионный эффекты.
- •Дисперсионные силы
- •29) Водородная связь.
- •30) Основные типы кристаллических решеток.
- •Простейшие кристаллические решетки. Плотнейшая кубическая упаковка. Плотнейшая гексагональная упаковка
- •31) Законы термохимии. Следствие из законов Гесса.
- •32) Понятие о внутренней энергии системы, энтальпии и энтропии.
- •33) Энергия Гиббса, её взаимодействие с энтальпией и энтропией. Изменение энергии Гиббса в самопроизвольно протекающих процессах.
- •34) Скорость химической реакции. Закон действия масс для гомогенных и гетерогенных реакций. Сущность константы скорости. Порядок и молекулярность реакции.
- •35) Факторы, влияющие на скорость химических реакций.
- •36) Влияние температуры на скорость химический реакций. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •37) Особенности протекания гетерогенных реакций. Влияние диффузии и степень дискретности вещества.
- •38) Влияние катализатора на скорость химических реакций. Причины влияния катализатора.
- •39) Обратимые процессы. Химическое равновесие. Константа равновесия.
- •40) Влияние различных факторов на смещение равновесия. Принцип Ле Шателье.
- •41) Определение раствора. Физико-химические процессы при образование растворов. Изменения энтальпии и энтропии при растворение.
- •42) Способы выражения концентрации растворов.
- •43) Закон Рауля.
- •44) Осмос. Осматическое давление. Закон Вант-Гоффа.
- •45) Растворы электролитов. Сильные и слабые электролиты. Степень электролитической диссоциации. Изотонический коэффициент.
- •46) Теория элекролитической диссоциации. Физическая теория Аррениуса, химическая Менделеева и современный взгляд на диссоциацию.
- •47) Реакции в растворах электролитов, их направленность. Смещение ионных равновесий.
- •48) Ионное произведение воды. Водородный показатель как химическая характеристика.
- •49) Гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •50)Гидролиз солей.
- •51) Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •52) Зависимость электродного потенциала от природы веществ, температуры и концентрации раствора. Формула Нэриста.
- •53. 1)Гальванические элементы. 2)Процессы на электродах. 3)эдс гальванического элемента.
- •54. 1)Обратимые источники электрической энергии. 2)Кислотные и щелочные аккумуляторы.
- •55.Топливные элементы.
- •56.1)Электролиз растворов и расплавов. 2)Последовательность электродных процессов. 3)Перенапряжение и поляризация.
- •57.Взаимодействие металлов с кислотами и щелочами.
- •58. Коррозия металлов в растворах солей.
- •59. Применение электролиза в промышленности.
- •60. 1)Электрохимическая коррозия металлов. 2)Основные виды электрохимической коррозии. 3)Процессы на электродах.
- •61. Методы борьбы с коррозией.
- •Выбор одного из методов защиты основывается не только на технических соображениях, но и на экономических расчетах. Наиболее дешевым и распространенным методом являются лакокрасочные покрытия.
ЕБАНЫЕ 61 ВОПРОС ПО ХИМИИ
1) Основные законы химии: сохранения массы и энергии, постоянство состава, эквивалентов и Авогадро.
Сохранение массы-Михаил Васильевич Ломоносов (в 1748г): Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.Антуан Лоран Лавуазье(в 1789): показал, что при хим. реакции сохраняется не только общая масса веществ но и каждого в отдельности.В 1905 году А.Эйнштейн:E=mc2. Закон постоянства состава: соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения. Дальтон(открыл закон парциальных газов): Закон кратных отношений: Если 2 элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого относятся между собой как небольшие целые числа. Гей-Люссак Закон простых объемных отношений: Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа. Авогадро в 1811 В равных объемах при одной и той же температуре и при одинаковом давлении, содержится одно и тоже число молекул.
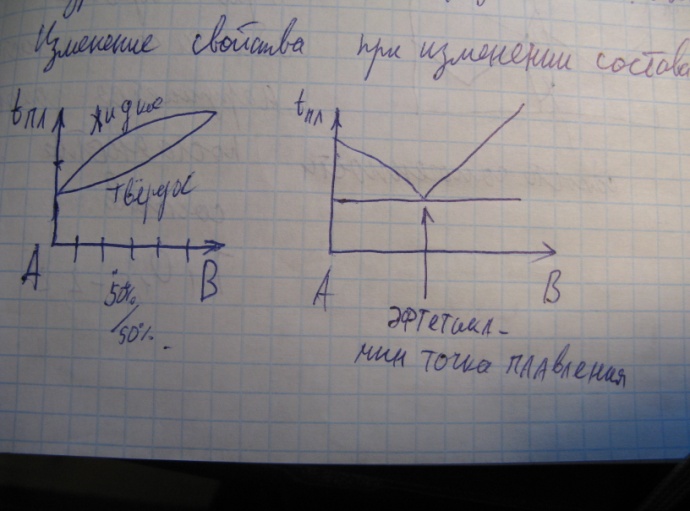
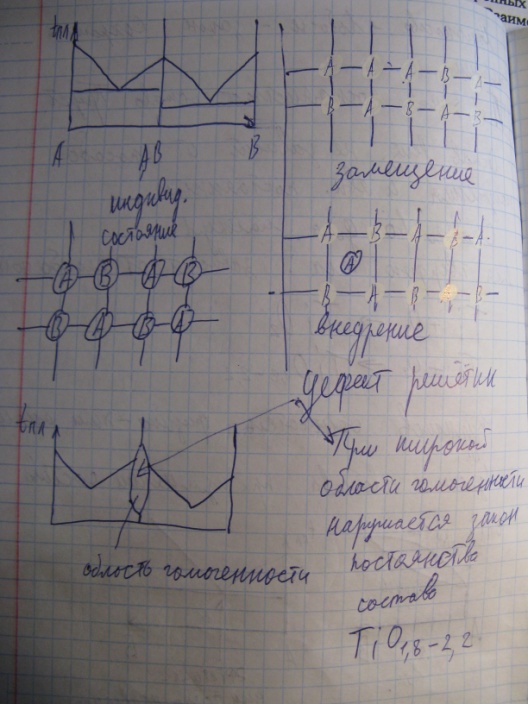
2) Закон постоянства состава с современной точки зрения. Соединения постоянного и переменного состава.
Состав вещества не зависит от способа получения и является постоянным. Справедливо для молекул. Для твердого тела зависит от способа получения. В начале ХХ века Н.С.Курнаков (основатель физико-химического анализа) открыл соединения переменного состава. Ti + O2 = TiO1.8-2.2.
3) Закон эквивалентов. Эквивалент элементов и соединений.
Вещества взаимодействуют друг с другом в эквивалентном количестве (количестве пропорциональном их эквивалентам). Массы реагирующих веществ пропорциональны их эквивалентным массам.

4) Классы неорганических соединений.
Вещества делятся на простые и сложные. Простые делятся на металлы и неметаллы.
Металлы: металлический блеск, ковкость, тягучесть, хорошая теплопроводность, электрическая проводимость, твердые. Неметаллы хрупки, плохо проводят тепло и электричество. Сложные вещества делятся на органические и неорганические.
Неорганические делятся по составу: Бинарные соединения: оксиды (O), галогениды (галогены), нитриды(N), карбиды(C), гидриды(H) или по функциональным признакам:
Оксиды: несолеобразующие(N2O, NO) и солеобразующие(основные, кислотные, амфотерные)
Основные + кислота (кислотные оксиды)=соль основные + воды =основание
Кислотные + основания (основные оксиды)=соль кислотные + вода =кислота
Амфотерные: и с кислотами и с основаниями.
Гидроксиды: OH (так же основные(NaOH Ba(OH)2) кислотные(HNO3 H3PO4) и амфотерные (Zn(OH)2 Al(OH)3))
Основания: вещ. диссоциирующие на гидроксид-ион. Основные гидроксиды.
Кислоты: вещ. диссоциирующие на ионы водорода. Кислотные гидроксиды.
Соли: вещ. диссоциирующие на полож. ионы не водород и отр ионы не гидроксогрупп.
5) Модель строения атома Резерфорда
В 1911 году Резерфорд: ядерная модель атома: Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Резерфорд проверил капельную теорию строения атома(в атоме равномерно расположены положительно и отрицательно заряженные электроны). Некоторые Альфа частицы проходящие через металлическую фольгу отклонялись под разными углами, что указывало на существования сильного препятствия со стороны фольги(атомы) электроны же не способствовали сильному отклонению от направления движения альфа частицы. Также альфа частицы чаще сталкивались с электронами чем с атомами (большая часть альфа частиц проходила насквозь фольги не меняя направления).
