
- •Самостоятельная работа студентов по химии
- •Тема 1: Классы неорганических соединений. Основные законы химии.
- •Тема 2: Электролитическая диссоциация.
- •Тема 3: Окислительно-восстановительные реакции.
- •Тема 4: Гальванический элемент. Коррозия металлов.
- •Тема 5: Электролиз растворов солей. Химические свойства металлов.
Тема 5: Электролиз растворов солей. Химические свойства металлов.
89 Какие процессы протекают на катоде и аноде при электролизе водных растворов солей: NaNO3, KCI, FeSO4, если электроды угольные?
90 Какие процессы протекают на электродах при электролизе водного раствора CuSO4, если: а) анод и катод из угля; б) катод из угля, анод из меди?
91 Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 40 мин, если сила тока равна 1,2 А ?
92 Сколько минут следует пропускать ток силой 0,5 А через раствор AgNO3 для выделения 0,27 г серебра ?
93 Записать катодные и анодные процессы электролиза водных растворов:
а) NaI на угольном аноде;
б) Cu(NO3)2 на платиновом аноде;
94 Записать катодные и анодные процессы электролиза водных растворов:
а) ZnSO4 на цинковом аноде;
б) CaF2 на угольном аноде;
95 Написать уравнения реакций окисления следующих металлов элементарными окислителями и указать условия их протекания:
Fe + O2 ; Al + N2 ;
Mg + S ; Mn + C ;
Дать названия полученным веществам.
96 Написать уравнения реакций окисления следующих металлов элементарными окислителями и указать условия их протекания:
Fe + Cl2 ; Cr + O2 ;
Na + O2 ; Na + H2 .
Дать названия полученным веществам.
97 Написать уравнения реакций взаимодействия следующих металлов с водой: Са, Fe, Al. При каких условиях возможны реакции?
98 Какие из перечисленных металлов могут вытеснить водород из иодистоводородной и разбавленной серной кислот: Мg, Мn, Ni , Сu, Аg ? Написать уравнения реакций. Указать окислитель и восстановитель.
99 Написать уравнения реакций взаимодействия разбавленной азотной кислоты с металлами: медью, цинком, кальцием. Расставить коэффициенты методом электронного баланса.
100 Написать уравнения реакций взаимодействия концентрированной серной кислоты с металлами: медью, алюминием, железом. Указать условия протекания реакций. Расставить коэффициенты методом электронного баланса.
101 С какими из веществ может реагировать алюминий: NaOH, H2O, HCl, Ca(NO3)2, CuSO4, I2, S ? Составить уравнения возможных реакций.
102 Написать уравнения реакций окисления следующих щелочных металлов: Li, Na, K – в атмосфере воздуха при обычной и высокой температурах.
103 Составить и уравнять с помощью электронного баланса окислительно-восстановительные реакции.
Cu
+
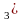
Cu +
104 Составить и уравнять с помощью электронного баланса окислительно-восстановительные реакции.
V +
Sn +
105 Составить и уравнять с помощью электронного баланса окислительно-восстановительные реакции.
Sn + HNO3(конц.)
Hg + HNO3(разб.)
106 Составить и уравнять с помощью электронного баланса окислительно-восстановительные реакции.
Pb + HNO3(разб.)
Hg + HNO3(конц.)
