
- •36. Фосфор, его характеристика, соединения фосфора
- •Взаимодействие с водой
- •Взаимодействие со щелочами
- •Восстановительные свойства
- •38. Углерод. Его характеристика. Соединения углерода.
- •39. Кремний, его характеристика, соединения кремния.
- •42. Алюминий, его характеристика. Соединения
- •Свойства металлов
- •Конструкционные материалы
- •Электротехнические материалы
- •Инструментальные материалы
- •44. Д элементы. Положение в периодической системе. Важнейшие состояния окисления в соединениях. Кислотно-основные свойства оксидов и гидроксидов в зависимости от степени окисления
- •Некоторые свойства элементов 7 группы
38. Углерод. Его характеристика. Соединения углерода.
Углеро́д (химический символ — C) — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса — 12,01115[
Характеристика: Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода:
тетраэдрическая, образуется при смешении одного s- и трех p-электронов (sp3-гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра .
тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp2-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами.
дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи.
Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2); сродство к электрону 1,27 эВ
Неорганические соединения:
Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия — метан, тетрафторметанПродукты горения углерода в кислороде являются CO и CO2Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты.Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
![]()
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов, алюминием и кальцием углерод образует карбиды, например:
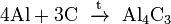 (карбид
алюминия);
(карбид
алюминия);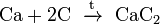 (карбид
кальция).
(карбид
кальция).
Важна в промышленности реакция углерода с водяным паром:
![]() (см.
газификация
твердых топлив).
(см.
газификация
твердых топлив).
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Органические соединения:Способность углерода образовывать полимерные цепочки, порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
