
- •36. Фосфор, его характеристика, соединения фосфора
- •Взаимодействие с водой
- •Взаимодействие со щелочами
- •Восстановительные свойства
- •38. Углерод. Его характеристика. Соединения углерода.
- •39. Кремний, его характеристика, соединения кремния.
- •42. Алюминий, его характеристика. Соединения
- •Свойства металлов
- •Конструкционные материалы
- •Электротехнические материалы
- •Инструментальные материалы
- •44. Д элементы. Положение в периодической системе. Важнейшие состояния окисления в соединениях. Кислотно-основные свойства оксидов и гидроксидов в зависимости от степени окисления
- •Некоторые свойства элементов 7 группы
1. Классы неорганических соединений (оксиды, гидроксиды (кислотные, основные и амфотерные), соли: средние, кислые и основные) Все вещества делятся на простые и сложные. Простые вещества состоят из одного элемента, в состав сложных входит 2 и более элементов. Элемент - природная совокупность атомов, которая характеризуется определенным зарядом ядра. Степень окисления – условный заряд иона, вычисленный исходя из электроотрицательности молекулы. Неорганические вещества разделяют на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотосодержащие и т.д), либо по функциям, свойствам (кислотно-основным, окислительно - воостаовительным), которые эти вещества осуществляют в химических реакциях. К важнейшим бинарным соединениям относятся соединения элементов с кислородом (оксиды), с галогенами (галогениды или галиды), азотом (нитриды), углеродом (карбиды), а также соединения металлических элементов с водородом (гидриды). Оксид - сложное вещество, состоящее из атомов двух элементов, один из которых является кислородом, который наиболее электроотрицателен. Основными называют оксиды, взаимодействующие с кислотами сообразованием солей. Присоединяя воду, основные оксиды образуют основания. Кислотными называют оксиды, взаимодействующие с основаниями с образованием солей. Присоединяя воду, кислотные оксиды образуют кислоты. Амфотерными называют оксиды, образующие соли при взаимодействии, как с кислотами, так и с основаниями. Гидроксиды – вещества, содержащие гидроксогруппы ОН. Кислоты - сложные вещества, состоящие из иона водорода и кислотного остатка. Способны реагировать с основаниями, а также с основными и амфотерными оксидами с образованием солей. По силе кислоты делятся на сильные и слабые. Н3РО2-фосфорноватистая кислота, Н3РО3-фосфористая, Н3РО4-фосфорная, НРО3-метафосфорная, Н3РО4-ортофосфорная, Н4Р2О7-пиро (ди -)фосфорная, четырехосновная кислота. Основания - сложные вещества, состоящие из металла и гидроксогруппы. Способны взаимодействовать с кислотами, а также с кислотными и амфотерными оксидами с образованием солей. NaOH - однокислотное основание, Ca(OH)2-двухкислотное, Al(OH)3-трехкислотное. Соли - сложные вещества, состоящие из иона металла и кислотного остатка. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов или как продукты замещения гидроксогруппы в основном гидроксиде кислотными остатками. При полном замещении получаются средние соли (СаSO4, Na3PO4). При неполном замещении водорода кислоты получаются кислые соли(KOH+H2SO4=KHSO4+H2O или H3PO4+2NaOH=Na2HPO4+H2O, H3PO4+NaOH=NaH2PO4+H2O). При неполном замещении гидроксогрупп основания получаются основные соли(Fe(OH)3+2HCl=FeOHCl2+2H2O, Fe(OH)3+HCl=Fe(OH)2Cl+H2O или Mg(OH)2+HCl=Mg(OH)Cl+H2O)
2. Периодический закон и периодическая система Д.И. Менделеева. Структура периодической системы. Периодический закон был открыт в 1869 году Д.И. Менделеевым. Менделеев пришел к заключению, что в основу систематики элементов должна быть положена их относительная атомная масса. Расположив все элементы в порядке возрастания, Менделеев обнаружил, что сходные в химическом отношении элементы встречаются через правильные интервалы и что, таким образом, в ряду элементов многие их свойства периодически повторяются. Эта закономерность получила свое выражение в периодическом законе: Свойства элементов находятся в периодической зависимости от атомного веса химических элементов(1-ый этап). 2-ой этап связан с определяющей ролью заряда ядра: Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома. Периодическая система элементов. Ряды элементов, в пределах которых свойства изменяются последовательно, Менделеев назвал периодами. Периодическая система состоит из 10 горизонтальных рядов и 8 вертикальных столбцов, или групп. Периоды с 1 по 3 называются малыми периодами. 2 и 3 периоды начинаются с щелочного металла и заканчиваются благородным газом. Периоды с 4 по 7 называются большими периодами и состоят из двух рядов. В восьмом ряду после лантана идут четырнадцать элементов, называемых лантаноидами, которые чрезвычайно сходны с лантаном и между собой. В больших периодах не все свойства элементов изменяются так последовательно, как во 2 и 3. Так высшая валентность по кислороду вначале равномерно растет при переходе от одного элемента к другому, но затем, достигнув максимума в середине периода, падает до двух, после чего опять возрастает до семи к концу периода. В десятом ряду, следующие за актинием четырнадцать элементов сходны по строению их атомов с актинием, поэтому их называют актиноиды. В пределах периода металлические свойства ослабевают в направлении слева направо. Таким образом, начиная с четвертого периода, каждую группу можно разбить на две подгруппы: главную и побочную. 3-ий этап связан с квантово механической моделью атома: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних электронных слоев атома.
Формы существования химич эл-ов |
Изменения свойств |
|||
В главных подгруппах |
В периодах |
|||
Атомы |
Заряд ядра |
В |
Возрастает |
|
Число электронных уровней |
Возрастает |
Не изменяется и равно номеру периода |
||
Число электронов на внешнем уровне |
Не изменяется и равно номеру группы |
Возрастает |
||
Радиус атома |
Возрастает |
Убывает |
||
Восстановительные свойства |
Возрастают |
Убывают |
||
Окислительные свойства |
Убывают |
Возрастают |
||
Высшая положительная степень окисления |
Постоянна и равна номеру группы (n) |
Увеличивается от +1 до +8 |
||
Низшая степень окисления |
Не изменяется и равна (8-n) |
Увеличивается от -4 до -1 |
||
Простые вещества |
Металлические свойства |
Усиливаются |
Ослабевают |
|
Неметаллические свойства |
Ослабевают |
Усиливаются |
||
Соединения элементов |
Характер химических свойств |
Высшего оксида |
Основный Амфотерный Кислотный Усиление кислотных и ослабление основных свойств в периодах |
|
Высшего гидроксида |
Щелочь Основание Амфотерный гидроксид Кислота Ослабление основных и усиление кислотных свойств в периодах |
|||
3 .
Понятие атомной орбитали. Форма
орбиталей.
Состояние
электрона в атоме, характеризующееся
определенными значениями квантовых
чисел n,
l
и m,
т. е определенными размерами, формой и
ориентацией в пространстве электронного
облака, получило название атомной
электронной орбитали.
Поскольку s-состоянию(l=0)
соответствует единственное значение
магнитного квантового числа (m=0),
то любые возможные расположения
s-электронного
облака в пространстве идентичны (сфера).
Электронные облака, отвечающие p-орбиталям
(l=1),
могут характеризоваться тремя различными
значениями m;
в соответствии с эти они могут располагаться
в пространстве тремя способами. При
этом три p-электронных
облака ориентированы во взаимно
перпендикулярных направлениях, которые
обычно принимают за направления
координатных осей; соответствующие
состояния электронов принято обозначать
px,
py,
pz.
Для d-орбиталей
(l=2)
возможно уже пять значений магнитного
квантового числа и соответственно пять
различных ориентаций d-электронных
облаков в пространстве.
.
Понятие атомной орбитали. Форма
орбиталей.
Состояние
электрона в атоме, характеризующееся
определенными значениями квантовых
чисел n,
l
и m,
т. е определенными размерами, формой и
ориентацией в пространстве электронного
облака, получило название атомной
электронной орбитали.
Поскольку s-состоянию(l=0)
соответствует единственное значение
магнитного квантового числа (m=0),
то любые возможные расположения
s-электронного
облака в пространстве идентичны (сфера).
Электронные облака, отвечающие p-орбиталям
(l=1),
могут характеризоваться тремя различными
значениями m;
в соответствии с эти они могут располагаться
в пространстве тремя способами. При
этом три p-электронных
облака ориентированы во взаимно
перпендикулярных направлениях, которые
обычно принимают за направления
координатных осей; соответствующие
состояния электронов принято обозначать
px,
py,
pz.
Для d-орбиталей
(l=2)
возможно уже пять значений магнитного
квантового числа и соответственно пять
различных ориентаций d-электронных
облаков в пространстве.
S
 -орбиталь
p-орбиталь
d-орбиталь
(розетка)
-орбиталь
p-орбиталь
d-орбиталь
(розетка)
4. Квантовые числа. Физический смысл квантовых чисел. Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа n. Введено еще Бором. Характеризует число энергетических уровней. Число n определяется по номеру периода - количество энергетических уровней. 2n2- максимальное число электронов на данном уровне. Главное квантовое число определяет и размеры электронного облака. Орбитальное (побочное) квантовое число l. Характеризует количество подуровней и форму орбиталей l=0, (n-1). Так при n=1, l=0 s-орбиталь, n=2, l=0;1 s-орбиталь, p-орбиталь, n=3, l=0;1;2 s,p,d-орбитали, n=4, l=0;1;2;3 s,p,d,f-орбитали. Магнитное квантовое число m. Характеризует число орбиталей в данном подуровне, m=-l;0;+l. Так при l=0 m=0 - s, l=1 m=+1;0;-1 - px, py, pz. Спиновое квантовое число ms от слова «spin»-волчок, ms=+1/2;-1/2. Определяет собственное состояние электрона.
5. Электронная формула. Принципы составления электронных формул (принцип запрета Паули, правило Хунда, правила Ключевского). Электронная формула - схематичное распределение электронов по уровням, подуровням и орбиталям. Принцип запрета Паули: в атоме не может быть двух электронов, которые характеризуются одинаковыми значениями четырех квантовых чисел. Например, He (n=1, m=0, l=0, ms=+1/2;-1/2) 1s2. Максимальное число электронов на каждом энергетическом уровне 2n2. Правило Хунда: в пределах подуровня электроны заполняют орбитали таким образом, чтобы суммарный спин был максимальным. В пределах подуровня электроны заполняют орбитали сначала по одному, а затем по второму электрону. Правило Хунда не запрещает другого распределения электронов в пределах подуровня. Оно лишь утверждает, что максимальное значение суммарного спина атома соответствует устойчивому, т. е невозбужденному состоянию, в котором атом обладает наименьшей возможной энергией. Правила Ключевского: первое правило - при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы (пример N). Второе правило – при одинаковых значениях (n+l) заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа (пример Sc).
6. Три типа химической связи (ковалентная, ионная, металлическая). Определения Химическая связь-взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Ковалентная связь-это связь между атомами неметаллов за счет образования электронных пар. Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов: атомной (очень прочной) - алмаз, графит, кварц; молекулярной - в обычных условиях это газы, легколетучие жидкости и твердые легкоплавкие или возгоняющиеся вещества (Cl2, H2O, I2, CO2) Ионная связь-это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Ионная связь в отличие от ковалентной является ненаправленной (Пример NaCl, NH4Cl). Металлическая связь - это связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов металлической кристаллической решетке. Такая связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей. Вещества с металлической связью имеют металлическую кристаллическую решетку.
7 .Ковалентная
связь. Метод валентных связей (метод
ВС). Исходные представления метода. Два
механизма образования ковалентной
связи: обменный, донорно-акцепторный.
Ковалентная
связь - это
связь между атомами неметаллов за счет
образования электронных пар. Представления
о механизме образования химической
связи, развитые Гейтлером и Лондоном
на примере молекулы водорода, были
распространенны и на более сложные
молекулы. Разработанная на этой основе
теория химической связи получила
название
метода валентных связей (метод ВС).
Метод ВС дал теоретическое объяснение
важнейших свойств ковалентной связи,
позволил понять строение большого числа
молекул. В основе метода лежат положения:
1)Ковалентная
химическая связь образуется двумя
электронами с противоположно направленными
спинами, причем эта электронная пара
принадлежит двум атомам. Комбинации
таких двухэлектронных, двуцентровых
связей, отражающие электронную структуру
молекулы, получили название валентных
схем. 2)Ковалентная
связь тем прочнее, чем в большей степени
перекрываются взаимодействующие
электронные облака. Механизмы
образования ковалентной связи: обменный
действует,
когда атомы образуют общие электронные
пары за счет объединения неспаренных
электронов. Например: 1) H2.
Связь возникает благодаря образованию
общей электронной пары s-электронами
атомов водорода (перекрыванию s-орбиталей).
2)HCl.
Связь возникает за счет образования
общей электронной пары из s-и
p-электронов
(перекрывание s
- p
орбиталей). Донорно-акцепторный
механизм.
Донор имеет электронную пару, акцептор
– свободную орбиталь, которую эта пара
может занять. В ионе аммония все четыре
связи с атомами водорода ковалентные:
три образовались благодаря созданию
общих электронных пар атомом азота и
атомами водорода по обменному механизму,
одна образовалась по донорно-акцепторному
механизму.
H
H
+
.Ковалентная
связь. Метод валентных связей (метод
ВС). Исходные представления метода. Два
механизма образования ковалентной
связи: обменный, донорно-акцепторный.
Ковалентная
связь - это
связь между атомами неметаллов за счет
образования электронных пар. Представления
о механизме образования химической
связи, развитые Гейтлером и Лондоном
на примере молекулы водорода, были
распространенны и на более сложные
молекулы. Разработанная на этой основе
теория химической связи получила
название
метода валентных связей (метод ВС).
Метод ВС дал теоретическое объяснение
важнейших свойств ковалентной связи,
позволил понять строение большого числа
молекул. В основе метода лежат положения:
1)Ковалентная
химическая связь образуется двумя
электронами с противоположно направленными
спинами, причем эта электронная пара
принадлежит двум атомам. Комбинации
таких двухэлектронных, двуцентровых
связей, отражающие электронную структуру
молекулы, получили название валентных
схем. 2)Ковалентная
связь тем прочнее, чем в большей степени
перекрываются взаимодействующие
электронные облака. Механизмы
образования ковалентной связи: обменный
действует,
когда атомы образуют общие электронные
пары за счет объединения неспаренных
электронов. Например: 1) H2.
Связь возникает благодаря образованию
общей электронной пары s-электронами
атомов водорода (перекрыванию s-орбиталей).
2)HCl.
Связь возникает за счет образования
общей электронной пары из s-и
p-электронов
(перекрывание s
- p
орбиталей). Донорно-акцепторный
механизм.
Донор имеет электронную пару, акцептор
– свободную орбиталь, которую эта пара
может занять. В ионе аммония все четыре
связи с атомами водорода ковалентные:
три образовались благодаря созданию
общих электронных пар атомом азота и
атомами водорода по обменному механизму,
одна образовалась по донорно-акцепторному
механизму.
H
H
+
H – N – H + H+ Cl- H – N – H Cl-
Донор акцептор H
Четыре связи N – H в ионе аммония во всех отношениях равноценны. Из этого следует, что связь, образованная донорно-акцепторным способом, не отличается по своим свойствам от ковалентной связи, создаваемой за счет неспаренных электронов взаимодействующих атомов.
8. Свойства ковалентной связи: насыщаемость, направленность, полярность. Способность атомов участвовать в образовании ограниченного числа ковалентных связей получила название насыщаемости ковалентной связи. Образование ковалентной связи является результатом перекрывания валентных электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью. Так в молекуле водорода перекрывание атомных s-электронных облаков происходит вблизи прямой, соединяющей ядра взаимодействующих атомов. Образованная подобным образом ковалентная связь называется связью (сигма-связь). При взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется связью (пи-связь). Направленность ковалентной связи может обосновать конфигурацию молекул. Полярность ковалентной связи: F2-гомомолекула. F(:)F-молекула неполярна. HF H+ : F-связь полярна. Количественно полярность связи определяется дипольным моментом. l*q, где l-длина связи, q-заряд, [Д]-Дебаи. CO2 O C O. Полярность заключается в способности молекул изменять свою полярность под действием внешнего электрического поля
9





 .Гибридизация
атомных орбиталей. Типы гибридизации
(sp,
sp2,
sp3,
sp3d2,
sp3d).
Гибридизацией
электронных орбиталей
называют процесс их взаимодействия,
приводящий к выравниванию по форме и
энергии. Число гибридных орбиталей
равно числу исходных орбиталей. Гибридные
орбитали по геометрической форме, чем
s-
и p-орбитали.
Гибридизация одной s
и одной p-орбитали,
приводящий к образованию двух sp-орбиталей,
называется sp-гибридизацией.
Строение молекулы - линейное. Валентный
угол равен 1800.
Пример BeH:
H
Be
H
s
px
sp
При
гибридизации одной s-
и двух p-орбиталей
(sp2-гибридизация)
образуется три равноценные sp2-орбитали.
В этом случае гибридные электронные
облака располагаются в направлениях,
лежащих в одной плоскости и ориентированных
под углами 1200
друг к другу. Соответствует образование
плоской треугольной молекулы. Пример
BH3.
Если
в гибридизации участвуют одна s-
и три p-орбитали(sp3-гибридизация),
то в результате образуются четыре
sp3-орбитали,
вытянутые в направлениях к вершинам
тетраэдра, т.е ориентированные под
углами 109028`
друг к другу. Пример CH4.
.Гибридизация
атомных орбиталей. Типы гибридизации
(sp,
sp2,
sp3,
sp3d2,
sp3d).
Гибридизацией
электронных орбиталей
называют процесс их взаимодействия,
приводящий к выравниванию по форме и
энергии. Число гибридных орбиталей
равно числу исходных орбиталей. Гибридные
орбитали по геометрической форме, чем
s-
и p-орбитали.
Гибридизация одной s
и одной p-орбитали,
приводящий к образованию двух sp-орбиталей,
называется sp-гибридизацией.
Строение молекулы - линейное. Валентный
угол равен 1800.
Пример BeH:
H
Be
H
s
px
sp
При
гибридизации одной s-
и двух p-орбиталей
(sp2-гибридизация)
образуется три равноценные sp2-орбитали.
В этом случае гибридные электронные
облака располагаются в направлениях,
лежащих в одной плоскости и ориентированных
под углами 1200
друг к другу. Соответствует образование
плоской треугольной молекулы. Пример
BH3.
Если
в гибридизации участвуют одна s-
и три p-орбитали(sp3-гибридизация),
то в результате образуются четыре
sp3-орбитали,
вытянутые в направлениях к вершинам
тетраэдра, т.е ориентированные под
углами 109028`
друг к другу. Пример CH4.
sp3d2-гибридизация.
Имеет форму
октаэдра.
sp3d
–гибридизация. Имеет форму тригональной
бипирамиды.
11.Скорость
химических реакций. Факторы, влияющие
на скорость химических реакций.
Кинетика-раздел
химии, который изучает скорости протекания
химических реакций и их механизмы
Скорость
химических реакций - 1)число
элементарных актов взаимодействия в
единицу времени. 2) изменение концентрации
реагирующих веществ в единицу времени.
А+В=С
v=(CА1
– СА0)/()=
-CA/
, моль/л*с
-начальный
момент времени, с
СА0-исходная
концентрация А, моль/л
-конечное
время, с
CА1-конечная
концентрация А, моль/л
C
 А
CА
А
CА

vср=tgα
vистин=tgα,
α-угол касательной к кривой в данный
момент времени
При
рассмотрении вопроса о скорости реакции
необходимо различать реакции, протекающие
в гомогенной системе (гомогенные
реакции), и
реакции, протекающие в гетерогенной
системе (гетерогенные
реакции).
Гомогенной
называется
система, состоящая из одной фазы,
гетерогенной
- система, состоящая из нескольких фаз.
Фазой называется
часть системы, отделенная от других ее
частей поверхностью раздела, при переходе
через которую свойства изменяются
скачками. Примером
гомогенной
системы может служить любая газовая
смесь. Примером
гетерогенных
систем может служить: вода со льдом,
насыщенный раствор с осадком, уголь и
сера в атмосфере воздуха.
Скоростью
гомогенной реакции называется
количество вещества, вступающего в
реакцию или образующегося при реакции
за единицу времени в единице объема
системы.
Скоростью
гетерогенной реакции называется
количество вещества, вступающего в
реакцию или образующегося при реакции
за единицу времени на единице площади
поверхности фазы. vгомог=n/(V*t);
vгомог=C/t;
vгетерог=n/(S*t).
Факторы,
влияющие на скорость химической
реакции:
1.
Концентрация реагирующих веществ. С
увеличением концентрации скорость
реакции растет.
2. Природа реагирующих
веществ.
3.Поверхность раздела фаз
для гетерогенных реакций.
4.Влияние
температуры. Определяется эмпирическим
правилом
Вант-Гоффа
vt=vt0*
(t-t0)/10
. При повышении t
на каждые 100
скорость химической реакции увеличивается
в 2-4 раза. -температурный
коэффициент.
Уравнение
Аррениуса: K=
A*e-Ea/R*T
. K-константа
скорости, Ea-энергия
активации, энергия, которая необходима
для того, чтобы столкнувшиеся молекулы
прореагировали, R-газовая
постоянная, T-температура
Кельвина (T=273+t0)
Катализатор-вещество,
которое влияет на (ускорение) скорость
химической реакции, но сам при этом не
расходуется.
Ингибитор-вещество,
которое замедляет реакцию.
Скорость
некоторых гетерогенных реакций зависит
также от интенсивности движения жидкости
или газа около поверхности, на которой
происходит реакция.
12.
Закон действующих масс. Молекулярность
и порядок реакции.
Необходимым
условием того, чтобы между частицами
исходных веществ произошло химическое
взаимодействие, является их столкновение
друг с другом (соударение). Скорость
реакции пропорциональна числу соударений,
которые претерпевают молекулы реагирующих
веществ. Число соударений тем больше,
чем выше концентрация каждого из исходных
веществ или чем больше произведение
концентраций реагирующих веществ,
v=k*[A]*[B],
где k-коэффициент
пропорциональности, называемый константой
скорости
данной реакции. Полученное соотношение
выражает закон
действующих масс
для химической реакции, протекающей
при столкновении двух частиц: при
постоянной температуре скорость реакции
прямо пропорциональна произведению
концентраций реагирующих веществ. Этот
закон открыт опытным путем Гульдбергом
и Вааге в 1867 году. аА+bВ=сС
v=k*CaA
* CbB.
СА
и СВ
– концентрации,
k-константа
скорости. Константа
скорости (k)-скорость
реакции при концентрациях реагирующих
веществ равных 1 молю на л. Молекулярность
- число
молекул, участвующих в реакции.
А=С-мономолекулярная. А+В=С-бимолекулярная.
Порядок
реакции - сумма
показателей степени при концентрации
реагирующих веществ, входящих в
кинетическое уравнение. аА+bВ=сС
,v=k*CaA
* CbB.
Порядок
реакции=а+b
vср=tgα
vистин=tgα,
α-угол касательной к кривой в данный
момент времени
При
рассмотрении вопроса о скорости реакции
необходимо различать реакции, протекающие
в гомогенной системе (гомогенные
реакции), и
реакции, протекающие в гетерогенной
системе (гетерогенные
реакции).
Гомогенной
называется
система, состоящая из одной фазы,
гетерогенной
- система, состоящая из нескольких фаз.
Фазой называется
часть системы, отделенная от других ее
частей поверхностью раздела, при переходе
через которую свойства изменяются
скачками. Примером
гомогенной
системы может служить любая газовая
смесь. Примером
гетерогенных
систем может служить: вода со льдом,
насыщенный раствор с осадком, уголь и
сера в атмосфере воздуха.
Скоростью
гомогенной реакции называется
количество вещества, вступающего в
реакцию или образующегося при реакции
за единицу времени в единице объема
системы.
Скоростью
гетерогенной реакции называется
количество вещества, вступающего в
реакцию или образующегося при реакции
за единицу времени на единице площади
поверхности фазы. vгомог=n/(V*t);
vгомог=C/t;
vгетерог=n/(S*t).
Факторы,
влияющие на скорость химической
реакции:
1.
Концентрация реагирующих веществ. С
увеличением концентрации скорость
реакции растет.
2. Природа реагирующих
веществ.
3.Поверхность раздела фаз
для гетерогенных реакций.
4.Влияние
температуры. Определяется эмпирическим
правилом
Вант-Гоффа
vt=vt0*
(t-t0)/10
. При повышении t
на каждые 100
скорость химической реакции увеличивается
в 2-4 раза. -температурный
коэффициент.
Уравнение
Аррениуса: K=
A*e-Ea/R*T
. K-константа
скорости, Ea-энергия
активации, энергия, которая необходима
для того, чтобы столкнувшиеся молекулы
прореагировали, R-газовая
постоянная, T-температура
Кельвина (T=273+t0)
Катализатор-вещество,
которое влияет на (ускорение) скорость
химической реакции, но сам при этом не
расходуется.
Ингибитор-вещество,
которое замедляет реакцию.
Скорость
некоторых гетерогенных реакций зависит
также от интенсивности движения жидкости
или газа около поверхности, на которой
происходит реакция.
12.
Закон действующих масс. Молекулярность
и порядок реакции.
Необходимым
условием того, чтобы между частицами
исходных веществ произошло химическое
взаимодействие, является их столкновение
друг с другом (соударение). Скорость
реакции пропорциональна числу соударений,
которые претерпевают молекулы реагирующих
веществ. Число соударений тем больше,
чем выше концентрация каждого из исходных
веществ или чем больше произведение
концентраций реагирующих веществ,
v=k*[A]*[B],
где k-коэффициент
пропорциональности, называемый константой
скорости
данной реакции. Полученное соотношение
выражает закон
действующих масс
для химической реакции, протекающей
при столкновении двух частиц: при
постоянной температуре скорость реакции
прямо пропорциональна произведению
концентраций реагирующих веществ. Этот
закон открыт опытным путем Гульдбергом
и Вааге в 1867 году. аА+bВ=сС
v=k*CaA
* CbB.
СА
и СВ
– концентрации,
k-константа
скорости. Константа
скорости (k)-скорость
реакции при концентрациях реагирующих
веществ равных 1 молю на л. Молекулярность
- число
молекул, участвующих в реакции.
А=С-мономолекулярная. А+В=С-бимолекулярная.
Порядок
реакции - сумма
показателей степени при концентрации
реагирующих веществ, входящих в
кинетическое уравнение. аА+bВ=сС
,v=k*CaA
* CbB.
Порядок
реакции=а+b
13.
Химическое равновесии. Обратимые и
необратимые химические реакции. Смещение
химического равновесия (Принцип Ле
Шателье)
Все
химические реакции можно разбить на
две группы: необратимые
и
обратимые реакции.
Необратимые реакции протекают до
конца-до полного израсходования одного
из реагирующих веществ. Обратимые
реакции протекают не до конца: при
обратимой реакции ни одно из реагирующих
веществ не расходуется полностью.
H2+I2=2HI-
реакция обратима. В начальный момент
времени концентрация HI=0,
концентрации H
и I-
максимальны-начальные концентрации.
 =
=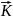 *CH2*CJ2;
*CH2*CJ2;
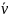 =
=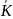 *CHJ2;
*
CH2*
CJ2=
*
CHJ2;
=
-
установление равновесия
Когда
скорость прямой и обратной реакции
становятся одинаковыми, наступает
химическое
равновесие. Химическое
равновесие называют динамическим
равновесием.
Этим подчеркивается, что при равновесии
протекают и прямая, и обратная реакции,
но их скорости одинаковы, вследствие
чего изменений в системе не заметно.
Количественной характеристикой
химического равновесия служит величина,
называемая
константой химического равновесия.
/
=
CHJ2/
CH2*CJ2;
/
=Kравновесия
Kравновесия[HJ]2/
[H2]*[J2]
Смещение
равновесия: 1)t0;
2)р; 3)С. Принцип
Ле Шателье: изменение
одного из условий t0,
р, С, при котором система находится в
состоянии химического равновесия,
вызывает смещение равновесия в направлении
той реакции, которая противодействует
произведенному изменению.
1.
Изменение t0:
При
повышении температуры равновесие
смещается в направлении эндотермической,
а при понижении - в направлении
экзотермической реакции. N2O4=2NO2-Q
– эндотермическая реакция; t0
увелич
;
t0
увелич
2.Концентрация:
При
увеличении концентрации какого-либо
из веществ, участвующих в равновесии,
равновесие смещается в сторону образования
этого вещества. FeCl3+3KSCN=Fe(ScN)3+3KCl.
C
FeCl3
или KSCN
;
C
KCl
.
3.
Давление:
При
увеличении давления путем сжатия системы
равновесие сдвигается в сторону
уменьшения числа молекул газов, т.е в
сторону понижения давления; при уменьшении
давления равновесие сдвигается в сторону
возрастания числа молекул газов, т.е в
сторону увеличения давления. N2+3H2
(4 моль)=2NH3
(2 моль); р
;
р
.
Смещение
равновесия при изменении условий таких
процессов, как кипение, кристаллизация,
растворение, происходит в соответствии
с принципом Ле Шателье.
14.Растворы.
Определение раствора. Способы выражения
концентрации растворов.
Растворами
называются
гомогенные системы, состоящие из двух
и более компонентов. Всякий раствор
состоит из растворенных веществ и
растворителя,
т.е среды, в
которой эти вещества равномерно
распределены в виде молекул или ионов.
Раствор, находящийся в равновесии с
растворяющимся веществом, называется
насыщенным
раствором.
Важной характеристикой растворов
является концентрация. Концентрацией
раствора называется
количество растворенного вещества,
содержащееся в определенном количестве
раствора или растворителя. Различают
два типа обозначений концентрации
веществ – аналитические и технические.
В химической практике наиболее
употребительны следующие величины,
выражающие содержание растворенного
вещества в растворе: 1.Массовая
доля-отношение
массы растворенного вещества к массе
раствора (%). 2.Молярная
доля-отношение
количества растворенного вещества (или
растворителя) к сумме количеств всех
веществ, составляющих раствор. 3.Молярная
концентрация (молярность)-отношение
количества растворенного вещества к
объему раствора (См
или М). 4.Моляльная
концентрация (моляльность)-отношение
количества растворенного вещества к
массе растворителя (m).
5.Эквивалентная
(нормальная) концентрация-отношение
числа эквивалентов растворенного
вещества к объему раствора (Сн
или н).
15.Растворы.
Процессы, протекающие в процессе
растворения.
Растворами
называются
гомогенные системы, состоящие из двух
и более компонентов. При растворении
многих веществ их молекулы (или ионы)
связываются с молекулами растворителя,
образуя соединения, называемые сольватами;
этот процесс называется сольватацией.
В частном
случае, когда растворителем является
вода, эти соединения называются гидратами,
а сам процесс их образования – гидратацией.
Гидраты, как правило, нестойкие соединения,
во многих случаях разлагающиеся уже
при выпаривании растворов. Но иногда
гидраты настолько прочны, что при
выделении растворенного вещества из
раствора вода входит в состав его
кристаллов. Вещества, в кристаллы которых
входят молекулы воды, называются
кристаллогидратами,
а содержащаяся в них вода - кристаллизационной.
Процесс
образования гидратов протекает с
выделением теплоты. Диффузия
- самопроизвольный
процесс перемещения вещества, приводящий
к выравниванию его концентрации.
*CHJ2;
*
CH2*
CJ2=
*
CHJ2;
=
-
установление равновесия
Когда
скорость прямой и обратной реакции
становятся одинаковыми, наступает
химическое
равновесие. Химическое
равновесие называют динамическим
равновесием.
Этим подчеркивается, что при равновесии
протекают и прямая, и обратная реакции,
но их скорости одинаковы, вследствие
чего изменений в системе не заметно.
Количественной характеристикой
химического равновесия служит величина,
называемая
константой химического равновесия.
/
=
CHJ2/
CH2*CJ2;
/
=Kравновесия
Kравновесия[HJ]2/
[H2]*[J2]
Смещение
равновесия: 1)t0;
2)р; 3)С. Принцип
Ле Шателье: изменение
одного из условий t0,
р, С, при котором система находится в
состоянии химического равновесия,
вызывает смещение равновесия в направлении
той реакции, которая противодействует
произведенному изменению.
1.
Изменение t0:
При
повышении температуры равновесие
смещается в направлении эндотермической,
а при понижении - в направлении
экзотермической реакции. N2O4=2NO2-Q
– эндотермическая реакция; t0
увелич
;
t0
увелич
2.Концентрация:
При
увеличении концентрации какого-либо
из веществ, участвующих в равновесии,
равновесие смещается в сторону образования
этого вещества. FeCl3+3KSCN=Fe(ScN)3+3KCl.
C
FeCl3
или KSCN
;
C
KCl
.
3.
Давление:
При
увеличении давления путем сжатия системы
равновесие сдвигается в сторону
уменьшения числа молекул газов, т.е в
сторону понижения давления; при уменьшении
давления равновесие сдвигается в сторону
возрастания числа молекул газов, т.е в
сторону увеличения давления. N2+3H2
(4 моль)=2NH3
(2 моль); р
;
р
.
Смещение
равновесия при изменении условий таких
процессов, как кипение, кристаллизация,
растворение, происходит в соответствии
с принципом Ле Шателье.
14.Растворы.
Определение раствора. Способы выражения
концентрации растворов.
Растворами
называются
гомогенные системы, состоящие из двух
и более компонентов. Всякий раствор
состоит из растворенных веществ и
растворителя,
т.е среды, в
которой эти вещества равномерно
распределены в виде молекул или ионов.
Раствор, находящийся в равновесии с
растворяющимся веществом, называется
насыщенным
раствором.
Важной характеристикой растворов
является концентрация. Концентрацией
раствора называется
количество растворенного вещества,
содержащееся в определенном количестве
раствора или растворителя. Различают
два типа обозначений концентрации
веществ – аналитические и технические.
В химической практике наиболее
употребительны следующие величины,
выражающие содержание растворенного
вещества в растворе: 1.Массовая
доля-отношение
массы растворенного вещества к массе
раствора (%). 2.Молярная
доля-отношение
количества растворенного вещества (или
растворителя) к сумме количеств всех
веществ, составляющих раствор. 3.Молярная
концентрация (молярность)-отношение
количества растворенного вещества к
объему раствора (См
или М). 4.Моляльная
концентрация (моляльность)-отношение
количества растворенного вещества к
массе растворителя (m).
5.Эквивалентная
(нормальная) концентрация-отношение
числа эквивалентов растворенного
вещества к объему раствора (Сн
или н).
15.Растворы.
Процессы, протекающие в процессе
растворения.
Растворами
называются
гомогенные системы, состоящие из двух
и более компонентов. При растворении
многих веществ их молекулы (или ионы)
связываются с молекулами растворителя,
образуя соединения, называемые сольватами;
этот процесс называется сольватацией.
В частном
случае, когда растворителем является
вода, эти соединения называются гидратами,
а сам процесс их образования – гидратацией.
Гидраты, как правило, нестойкие соединения,
во многих случаях разлагающиеся уже
при выпаривании растворов. Но иногда
гидраты настолько прочны, что при
выделении растворенного вещества из
раствора вода входит в состав его
кристаллов. Вещества, в кристаллы которых
входят молекулы воды, называются
кристаллогидратами,
а содержащаяся в них вода - кристаллизационной.
Процесс
образования гидратов протекает с
выделением теплоты. Диффузия
- самопроизвольный
процесс перемещения вещества, приводящий
к выравниванию его концентрации.
16.
Понятие электролита и неэлектролита.
Теория электролитической диссоциации
Аррениуса.
Электролиты-вещества,
проводящие электрический ток своими
ионами в
растворе или расплаве. Неэлектролит
наоборот.
Аррениус
обратил внимание на тесную связь между
способностью растворов солей, кислот
и оснований проводить электрический
ток. Причиной чрезмерно высокого
осмотического давления растворов
электролитов является, согласно
Аррениусу, диссоциация электролитов
на ионы. Вследствие этого, с одной
стороны, увеличивается общее число
частиц в растворе, а следовательно,
возрастают осмотическое давление,
понижение давления пара и изменения
температур кипения и замерзания, с
другой – ионы обусловливают способность
раствора проводить электрический ток.
Эти предположения в дальнейшем были
развиты в теорию
электролитической диссоциации. Согласно
этой теории, при растворении в воде
электролиты распадаются на положительно
и отрицательно заряженные ионы.
Положительно заряженные ионы называются
катионами
(ионы водорода и металлов). Отрицательно
заряженные ионы называются анионами
(ионы кислотных
остатков и гидроксид-ионы). Положения
теории электролитической диссоциации:
1.электролиты в растворе распадаются
на ионы. 2. Диссоциация является неполной.
Молекулы и ионы находятся в термодинамическом
равновесии и к ним применим закон
действующих масс. 3. Наличие ионов в
растворе предопределяет его
электропроводность.
17.Степень
диссоциации. Сильные и слабые электролиты.
Константа диссоциации.
Количественно
процесс диссоциации определяется
степенью
диссоциации (с.д),
α -
степень диссоциации - доля молекул
распавшихся на ионы; α=(N1/N)*100%,
где N-исходное
количество молекул, N1-количество
молекул, распавшихся на ионы. По значению
с.д электролиты делятся на: 1)сильные
(α>=30%), 2)слабые (α<=3%), 3.средней силы
(3%<α<30%). Сильные электролиты в водных
растворах диссоциированны практически
нацело. Слабые электролиты в водных
растворах диссоциируют только частично,
и в растворе устанавливается динамическое
равновесие между недиссоциированными
молекулами и ионами. К сильным электролитам
принадлежат почти все соли; из важнейших
кислот и оснований к ним относятся:
HNO3,
H2SO4,
HClO4,
HCl,
HBr,
HJ,
KOH,
NaOH,
Ba(OH)2,
Ca(OH)2.
К слабым электролитам относится
большинство органических кислот, а из
неорганических соединений к ним
принадлежат: H2CO3,
H2S,
HCN,
H2SiO3,
NH4OH.
Константа
диссоциации (К) - константа
равновесия диссоциации слабого
электролита. Величина К зависит от
природы электролита и растворителя, а
также от температуры, но не зависит от
концентрации раствора. Она характеризует
способность данной кислоты или данного
основания распадаться на ионы: чем выше
К, тем легче электролит диссоциирует.
Кдисс;
КА=К++А
- -реакция
обратима. К=[K+]*[A-]/[KA],
обозначим: С - исходная концентрация
КА, α - степень диссоциации. [K+]=[A-]=C*α.
[KA]=(1-α)*C.
K=C*α2/(1-α)=Kдисс;
слабый электролит α<1 =>Kдисс=С*α2;
α=
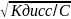 -закон разбавления Оствальда. Он дает
возможность вычислять степень диссоциации
при различных концентрациях электролита,
если известна его константа
диссоциации.
Слабые
электролиты диссоциируют по первой
стадии.
18.
Ионное произведение воды. Водородный
показатель.
Для
воды и разбавленных водных растворов
при неизменной температуре произведение
концентраций ионов, водорода и гидроксид
- ионов есть величина постоянная. Эта
постоянная величина называется ионным
произведением воды.
КН2О=
[H+]*[OH-].
Растворы, в
которых концентрации ионов водорода и
гидроксид – ионов одинаковы, называются
нейтральными растворами. Кислотность
или щелочность раствора можно выразить,
вместо концентрации ионов водорода,
ее десятичным логарифмом, взятым с
обратным знаком. Последняя величина
называется водородным
показателем и
обозначается рН. рН=-lg[H+],
pOH=-lg[OH-];
pH=7-
среда нейтральная, pH<7-среда
кислая, pH>7-среда
щелочная. Для измерения рН существуют
различные методы. Приближено реакцию
раствора можно определить с помощью
индикаторов, окраска которых меняется
в зависимости от концентрации ионов
водорода. Наиболее распространенные
индикаторы – метиловый оранжевый,
метиловый красный, фенолфталеин.
-закон разбавления Оствальда. Он дает
возможность вычислять степень диссоциации
при различных концентрациях электролита,
если известна его константа
диссоциации.
Слабые
электролиты диссоциируют по первой
стадии.
18.
Ионное произведение воды. Водородный
показатель.
Для
воды и разбавленных водных растворов
при неизменной температуре произведение
концентраций ионов, водорода и гидроксид
- ионов есть величина постоянная. Эта
постоянная величина называется ионным
произведением воды.
КН2О=
[H+]*[OH-].
Растворы, в
которых концентрации ионов водорода и
гидроксид – ионов одинаковы, называются
нейтральными растворами. Кислотность
или щелочность раствора можно выразить,
вместо концентрации ионов водорода,
ее десятичным логарифмом, взятым с
обратным знаком. Последняя величина
называется водородным
показателем и
обозначается рН. рН=-lg[H+],
pOH=-lg[OH-];
pH=7-
среда нейтральная, pH<7-среда
кислая, pH>7-среда
щелочная. Для измерения рН существуют
различные методы. Приближено реакцию
раствора можно определить с помощью
индикаторов, окраска которых меняется
в зависимости от концентрации ионов
водорода. Наиболее распространенные
индикаторы – метиловый оранжевый,
метиловый красный, фенолфталеин.
Название индикатора |
Цвет индикатора в различных средах |
||
кислой |
нейтральной |
щелочной |
|
метиловый оранжевый |
красный |
оранжевый |
желтый |
метиловый красный |
красный |
оранжевый |
желтый |
фенолфталеин |
бесцветный |
Бледно - малиновый |
малиновый |
лакмус |
красный |
фиолетовый |
синий |
19.
Произведение растворимости. Условия
выпадения и растворения осадков.
Произведение
растворимости характеризует
растворимость труднорастворимых
веществ. В насыщенном растворе электролита
произведение концентрации его ионов
есть величина постоянная при данной
температуре. Эта величина количественно
характеризует способность электролита
растворяться; ее называют произведением
растворимости электролита
и обозначают буквами ПР. Знание
произведения растворимости позволяет
решать вопросы, связанные с образованием
или растворением осадков при химических
реакциях, что особенно важно для
аналитической химии. Надо, однако, иметь
в виду, что произведение растворимости,
вычисленное без учета коэффициентов
активности, является постоянной величиной
только для малорастворимых электролитов
и при условии, что концентрации других
находящихся в растворе ионов невелики.
Растворимость
- предельно
возможная концентрация растворенного
вещества на 100 г растворителя.
20.Гидролиз
солей. Изменение реакции среды при
гидролизе солей.
Гидролизом
называется взаимодействие вещества с
водой, при котором составные части
вещества соединяются с составными
частями воды. Гидролизу подвержены
соединения различных классов. Гидролиз
солей: 1) соль образована сильным
основанием и
сильной кислотой:
NaCl(NaOH+HCl);
NaCl+H2O
 .
2.сильным
основанием, слабой кислотой: Na2CO3
(NaOH+H2CO3)
гидролиз идет
по аниону.
Na2CO3+H2O=NaHCO3+NaOH;
CO3-2+H2O=HCO-+OH-
- накапливается, среда щелочная.
3.
Слабое основание, сильная кислота: FeCl
(Fe(OH)2;
HCl)-гидролиз
идет по катиону (Fe)
FeCl2+H2O=FeOHCl+HCl;
Fe+2+H2O=(FeOH)++H+-накапливается,
среда кислая.
4.слабое
основание, слабая кислота:
NH4CN(
NH4OH+HCN)-
гидролиз идет по катиону и
аниону.
NH4CN+H2O=NH4OH+HCN;
NH4++CN-+H2O=NH4OH+HCN-среда
нейтральная. Факторы
влияющие на гидролиз: 1)природа
соли; 2)t0(с
температурой степень гидролиза растет);
3)разбавление раствора;4)Количественно
процесс гидролиза описывается степенью
гидролиза. Степень
гидролиза - отношение
числа молекул, подвергшихся гидролизу
к исходному количеству молекул.
Кг=[HA]*[MOH]/[MA],
где НА-кислота, МОН - основание, МА -
образованная ими соль;
Кг
называется константой
гидролиза соли.
ЕЕ значение характеризует способность
данной соли подвергаться гидролизу:
чем больше Кг,
тем в большей степени (при одинаковой
температуре и концентрации соли)
протекает гидролиз.
21.Комплексные
(координационные)соединения. Строение
комплексных соединений,
номенклатура.
Комплексные
соединения-соединения
высшего порядка, содержащие в
кристаллическом состоянии комплексный
ион, устойчивый в водных растворах.
Наиболее удачно свойства и строение
комплексных соединений объясняет
координационная
теория, предложенная
в 1893 году Вернером. Основные
положения теории Вернера:
1) Большинство элементов проявляют два
типа валентности: главную и побочную
(по современной терминологии степень
окисления и координационное число). 2)
Каждый элемент стремится насытить, как
главную, так и побочную валентность. 3)
Побочная валентность направлена к
строго фиксированным положениям в
пространстве. Строение
комплексных соединений: Согласно
координационной теории, в молекуле
любого комплексного соединения один
из ионов, обычно положительно заряженный,
занимает центральное место и называется
комплексообразователем
или центральным
ионом. Вокруг
него в непосредственной близости
расположено или, как говорят, координировано
некоторое число противоположно заряженных
ионов или электронейтральных молекул,
называемых лигандами
(или аддендами) и образующих внутреннюю
координационную сферу. Число
лигандов, окружающих центральный ион,
называется координационным
числом.
Внутренняя сфера комплекса в значительной
степени сохраняет стабильность при
растворении. ЕЕ границы показаны
квадратными скобками. Ионы, находящиеся
во внешней сфере, в растворах легко
отщепляются. Поэтому говорят, что
внутренней сфере ионы связаны неионогенно,
а во внешней – ионогенно.
Дентатность лиганда
– число координационных мест, занимаемых
лигандом. Заряд
комплексного иона – сумма
зарядов ионов, входящих в данный
комплексный ион. Номенклатура
комплексных соединений: в
соответствии и ИЮПАК. 1) анионный
комплекс (К3+[Fe(CN)6]-3-гексоцианоферат
(III)
калия)- начинаем называть с внутренней
сферы. 2)катионный
комплекс ([Co(NH3)5CO3]+Cl—хлорид
пентааминкарбонатокобальта (III))-начинаем
называть с внешней сферы. Порядок
названия лигандов (L):
1)CH3COO—ацетато;
2)ОН - гидроксо; 3)CN—циано;
4)NH3-амин;
5) H2O0-аква;
6) NO-нитрозил;
7)CO3—карбонато;
8)SO4-сульфато;
9)NO3—нитрато,
9) F-,
Cl-,
Br-,
J—фторо,
хлоро, бромо и т.д. В качестве лигандов
выступают нейтральные молекулы и
отрицательно заряженные ионы, имеющие
неподеленные электронные пары. В качестве
иона комплексообразователя выступают
ионы d-металлов,
а также ион Al+3.
22.
Устойчивость комплексных соединений
и их классификация.
Внутренняя
и внешняя сфера комплексного соединения
сильно различаются по устойчивости;
частицы, находящиеся во внешней сфере,
связаны с комплексным ионом преимущественно
электростатическими силами и легко
отщепляются в водном растворе. Эта
диссоциация называется первичной,
она протекает почти нацело, по типу
диссоциации сильных электролитов.
Лиганды, находящиеся во внутренней
сфере, связаны с центральным атомом
значительно прочнее и отщепляются лишь
в небольшой степени. Обратимый распад
внутренней сферы комплексного соединения
носит название вторичной
диссоциации.
I)
[Ag(NH3)2]Cl=[Ag(NH3)2]++Cl—диссоциация
полная.II)
[Ag(NH3)2]+=[AgNH3]++NH3;
[Ag(NH3)]+=Ag++NH3
. [Ag(NH3)2]+=Ag++2NH3.
Kравнов=[Ag+]*[NH3]2/[Ag(NH3)2]+=Kнестойкости
комплексного
иона.
Из приведенной
формулы видно, что чем меньше
концентрация продуктов распада, т.е чем
устойчивее
комплекс,
тем меньше
его константа нестойкости. В последнее
время для характеристики устойчивости
комплексных соединений предпочитают
пользоваться величиной, обратной
константе нестойкости, называемой
константой
устойчивости Куст=1/Кнест.
Классификация
комплексных соединений: 1)
по природе лиганда: L:H2O-аква
комплексы. L:NH3-аммиакаты.
L:NO3-,
SO4-2,
CO3-2-ацидо
комплексы. L:OH—гидроксокомплексы.
2) по принадлежности к кислотам, основаниям
и солям: 1) комплексные кислоты: H2[SiF6].
2) комплексные основания: [Ag(NH3)2]OH.
3) Комплексная
соль K2[HgJ4]
.
2.сильным
основанием, слабой кислотой: Na2CO3
(NaOH+H2CO3)
гидролиз идет
по аниону.
Na2CO3+H2O=NaHCO3+NaOH;
CO3-2+H2O=HCO-+OH-
- накапливается, среда щелочная.
3.
Слабое основание, сильная кислота: FeCl
(Fe(OH)2;
HCl)-гидролиз
идет по катиону (Fe)
FeCl2+H2O=FeOHCl+HCl;
Fe+2+H2O=(FeOH)++H+-накапливается,
среда кислая.
4.слабое
основание, слабая кислота:
NH4CN(
NH4OH+HCN)-
гидролиз идет по катиону и
аниону.
NH4CN+H2O=NH4OH+HCN;
NH4++CN-+H2O=NH4OH+HCN-среда
нейтральная. Факторы
влияющие на гидролиз: 1)природа
соли; 2)t0(с
температурой степень гидролиза растет);
3)разбавление раствора;4)Количественно
процесс гидролиза описывается степенью
гидролиза. Степень
гидролиза - отношение
числа молекул, подвергшихся гидролизу
к исходному количеству молекул.
Кг=[HA]*[MOH]/[MA],
где НА-кислота, МОН - основание, МА -
образованная ими соль;
Кг
называется константой
гидролиза соли.
ЕЕ значение характеризует способность
данной соли подвергаться гидролизу:
чем больше Кг,
тем в большей степени (при одинаковой
температуре и концентрации соли)
протекает гидролиз.
21.Комплексные
(координационные)соединения. Строение
комплексных соединений,
номенклатура.
Комплексные
соединения-соединения
высшего порядка, содержащие в
кристаллическом состоянии комплексный
ион, устойчивый в водных растворах.
Наиболее удачно свойства и строение
комплексных соединений объясняет
координационная
теория, предложенная
в 1893 году Вернером. Основные
положения теории Вернера:
1) Большинство элементов проявляют два
типа валентности: главную и побочную
(по современной терминологии степень
окисления и координационное число). 2)
Каждый элемент стремится насытить, как
главную, так и побочную валентность. 3)
Побочная валентность направлена к
строго фиксированным положениям в
пространстве. Строение
комплексных соединений: Согласно
координационной теории, в молекуле
любого комплексного соединения один
из ионов, обычно положительно заряженный,
занимает центральное место и называется
комплексообразователем
или центральным
ионом. Вокруг
него в непосредственной близости
расположено или, как говорят, координировано
некоторое число противоположно заряженных
ионов или электронейтральных молекул,
называемых лигандами
(или аддендами) и образующих внутреннюю
координационную сферу. Число
лигандов, окружающих центральный ион,
называется координационным
числом.
Внутренняя сфера комплекса в значительной
степени сохраняет стабильность при
растворении. ЕЕ границы показаны
квадратными скобками. Ионы, находящиеся
во внешней сфере, в растворах легко
отщепляются. Поэтому говорят, что
внутренней сфере ионы связаны неионогенно,
а во внешней – ионогенно.
Дентатность лиганда
– число координационных мест, занимаемых
лигандом. Заряд
комплексного иона – сумма
зарядов ионов, входящих в данный
комплексный ион. Номенклатура
комплексных соединений: в
соответствии и ИЮПАК. 1) анионный
комплекс (К3+[Fe(CN)6]-3-гексоцианоферат
(III)
калия)- начинаем называть с внутренней
сферы. 2)катионный
комплекс ([Co(NH3)5CO3]+Cl—хлорид
пентааминкарбонатокобальта (III))-начинаем
называть с внешней сферы. Порядок
названия лигандов (L):
1)CH3COO—ацетато;
2)ОН - гидроксо; 3)CN—циано;
4)NH3-амин;
5) H2O0-аква;
6) NO-нитрозил;
7)CO3—карбонато;
8)SO4-сульфато;
9)NO3—нитрато,
9) F-,
Cl-,
Br-,
J—фторо,
хлоро, бромо и т.д. В качестве лигандов
выступают нейтральные молекулы и
отрицательно заряженные ионы, имеющие
неподеленные электронные пары. В качестве
иона комплексообразователя выступают
ионы d-металлов,
а также ион Al+3.
22.
Устойчивость комплексных соединений
и их классификация.
Внутренняя
и внешняя сфера комплексного соединения
сильно различаются по устойчивости;
частицы, находящиеся во внешней сфере,
связаны с комплексным ионом преимущественно
электростатическими силами и легко
отщепляются в водном растворе. Эта
диссоциация называется первичной,
она протекает почти нацело, по типу
диссоциации сильных электролитов.
Лиганды, находящиеся во внутренней
сфере, связаны с центральным атомом
значительно прочнее и отщепляются лишь
в небольшой степени. Обратимый распад
внутренней сферы комплексного соединения
носит название вторичной
диссоциации.
I)
[Ag(NH3)2]Cl=[Ag(NH3)2]++Cl—диссоциация
полная.II)
[Ag(NH3)2]+=[AgNH3]++NH3;
[Ag(NH3)]+=Ag++NH3
. [Ag(NH3)2]+=Ag++2NH3.
Kравнов=[Ag+]*[NH3]2/[Ag(NH3)2]+=Kнестойкости
комплексного
иона.
Из приведенной
формулы видно, что чем меньше
концентрация продуктов распада, т.е чем
устойчивее
комплекс,
тем меньше
его константа нестойкости. В последнее
время для характеристики устойчивости
комплексных соединений предпочитают
пользоваться величиной, обратной
константе нестойкости, называемой
константой
устойчивости Куст=1/Кнест.
Классификация
комплексных соединений: 1)
по природе лиганда: L:H2O-аква
комплексы. L:NH3-аммиакаты.
L:NO3-,
SO4-2,
CO3-2-ацидо
комплексы. L:OH—гидроксокомплексы.
2) по принадлежности к кислотам, основаниям
и солям: 1) комплексные кислоты: H2[SiF6].
2) комплексные основания: [Ag(NH3)2]OH.
3) Комплексная
соль K2[HgJ4]
23. Р – элементы VII группы. Общая характеристика Р – элементы – элементы, у которых происходит заполнение электронами п-подуровня внешнего уровня. Эти элементы являются галогенами. К подгруппе галогенов относятся фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе, последний получен искусственно и поэтому изучен значительно меньше остальных галогенов. Слово галоген означает солеобразующий. Это название элементы подгруппы получили благодаря легкости, с которой они реагируют со многими металлами, образуя соли. Все галогены имеют структуру внешней электронной оболочки s2p5. Радиус атома в подгруппе: F < Cl < Br < I < At. Галогены — очень активные элементы. Они могут отнимать, электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор - бром из бромидов, а бром — иод из иодидов. Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше одного неспаренного электрона и проявляет валентность только -1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода.
Простое вещество |
Температура плавления, °C |
Температура кипения, °C |
F2 |
−223 |
−187 |
Cl2 |
−100,98 |
−34,15 |
Br2 |
−7,2 |
58,75 |
I2 |
311,5 |
184,5 |
At2 |
411 |
299 |
Физические св-ва галогенов: Химические свойства галогенов:
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например: 2Аl + 3F2 = 2АlF3 + 2989 кДж, Фтор может окислять и другие галогены. при облучении фтор реагирует даже с инертными (благородными) газами. хлор очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Cl вытесняет Br или I их их соединений с металлами при нагревании. Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлор. Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании. Галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений. Основным способом получения простых веществ является окисление галогенидов. В промышленности применяется только электролитическое окисление. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной фтороводородной кислоте. В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха. Применение: Фтор используется при синтезе полимерных материалов (фторопласты), как окислитель ракетного топлива, жидкости (фреоны) для холодильных машин. Хлор применяется для синтеза соляной кислоты, хлорной извести, винилхлорида, каучука; для отбеливания тканей и бумажной массы; для обеззараживания питьевой воды. Бром используется для приготовления лекарств, для получения различных органических веществ, в лакокрасочной промышленности. Йод применяется для приготовления лекарств, в анализе веществ.
25. Соединения галогенов с водородом. Способы получения и свойства Водородные соединения – галогеноводороды в воде являются кислотами: HF – фтороводородная(плавиковая) HCl – хлороводородная HBr –бромоводородная HI – иодоводородная. Сила этих кислот повышается от HF к HI. Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов. Получение: Фтороводород получают действием концентрированной серной кислоты на плавиковый шпат: CaF2+H2SO4=CaSO4+2HF Хлороводород получают непосредственным взаимодействием водорода с хлором: Н2+Сl2=2НСl Бромоводород и иодоводород получают гидролизом PBr3 и PI3
26. Кислородосодержашие соединения хлора. Способы получения и свойства. Хлор образует и кислородсодержащие соединения, в том числе кислоты, хлорноватистую НСlO, хлористую НСlO2, хлорноватую НСlO3 и хлорную НСlO4. Степени окисления хлора в них соответственно: +1, +3, +5, +7. Некоторые соли этих кислот используют как окислители. Так, перхлорат аммония NH4ClO4 стал важным компонентом некоторых твердых ракетных топлив. Известны также соединения, в которых степень окисления хлора +4(СlO2) и +6 (Сl2O6).
27. Р – элементы VI группы. Общая характеристика. Шестая группа периодической системы элементов состоит из двух подгрупп: главной — кислород, сера, селен, теллур и полоний — и побочной — хром, молибден и вольфрам. В главной подгруппе выделяют подгруппу селена (селен, теллур и полоний. Все элементы главной подгруппы, кроме кислорода, могут присоединять по два электрона, образуя электроотрицательные ионы. Элементы главной подгруппы имеют на внешнем электронном уровне по шесть электронов (s2р4). Атомы кислорода имеют два неспаренных электрона и не имеют d-уровня. Поэтому кислород проявляет в основном степень окисления -2 и только в соединениях со фтором +2. Сера, селен, теллур и полоний тоже имеют на внешнем уровне шесть электронов (s2p4), но у всех у них есть незаполненный d-уровень, поэтому они могут иметь до шести неспаренных электронов и в соединениях проявлять степень окисления — 2, +4 и +6. Закономерность изменения активности этих элементов такая же, как и в подгруппе галогенов: легче всего окисляются теллуриды, затем селениды и сульфиды. Из кислородных соединений серы наиболее устойчивы соединения серы (VI), а для теллура — соединения теллура (IV). Соединения селена занимают промежуточное положение. Селен и теллур, а также их соединения с некоторыми металлами (индием, таллием и др.) обладают полупроводниковыми свойствами и широко используются в радиоэлектронике. Соединения селена и теллура очень токсичны. Они применяются в стекольной промышленности для получения цветных (красных и коричневых) стекол.
28. Кислород, его характеристика, получение и св-ва. Оксиды. Вода, перекись водорода. Кислород был открыт шведским химиком К. В. Шееле в 1769-1770 гг. и английским химиком Д. Ж. Пристли в 1774 г. кислород — газ без цвета и запаха, слаборастворимый в воде. В жидком и твердом состояниях кислород окрашен в голубой цвет, он обладает магнитными свойствами. Получение: разложением перманганата калия при нагревании: 2 КМnO4 = К2МnО4 + МnО2 + O2 разложением бертолетовой соли в присутствии диоксида марганца как катализатора: 2 КСlO3 = 2 КСl + 3 O2 разложение нитратов щелочных или щелочноземельных металлов: 2 КNО3 = 2 КNО3 + О2 разложением окcида ртути: 2 НgО = 2 Нg + O2 электролизом воды, к которой для увеличения электропроводности добавляют щелочи или сульфаты щелочных металлов. Этот метод применяется также для промышленного получения кислорода. Оксиды сложные вещества состоящие из двух элементов, один из которых кислород. Различают солеобразующие и несолеобразующие(N2O). Солеобразующие: основные (обр. с металлами. Некоторые взаимодействуют с водой, с кислотами), кислотные (обр. с немеет. и мет. с выс.ст. окисл. Большинство взаим. С водой, с основаниями), амфотерные (взависимости от усл. Проявл. Основные и кисл. Св-ва. Взаим. с кислотами и щелочами) Вода - Около 71 % поверхности Земли покрыто водой. Перекись водорода: Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем В лабораторных условиях для получения пероксида водорода используют реакцию: BaO2 + H2SO4 → H2O2 + BaSO4 Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
29. Сера. Применение элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. Sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многиекислоты и соли. Многие серосодержащие соли малорастворимы в воде. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания. Сера не может образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы. Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например скипидаре. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд[4].
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
30. Сероводород.
Получение и свойства
бесцветный газ с запахом тухлых
яиц и сладковатым вкусом. Химическая
формула — H2S.
Плохо растворим в воде, хорошо — в
этаноле. Ядовит. При больших концентрациях
разъедает многие металлы. Концентрационные
пределы воспламенения с воздухом
составляют 4,5 — 45 % сероводорода.
В природе встречается очень редко в
виде смешанных веществ нефти и газа.
Входит в состав вулканических газов.
Образуется при гниении белков. Сероводород
используют в лечебных целях, например,
в сероводородных ваннах В воде сероводород
мало растворим, Реагирует с основаниями,
сероводород — сильный восстановитель.
На воздухе горит синим пламенем.
Сероводород реагирует также со многими
другими окислителями. Получение:
Взаимодействие
разбавленных кислот на
сульфиды:
![]() Взаимодействие сульфида
алюминия с водой ):
Взаимодействие сульфида
алюминия с водой ):
![]() Сплавлением
парафина с серой.
Сплавлением
парафина с серой.
31 Соединения серы в ст.окисл. +4 +6
32. Р-элементы V группы. Общая характеристика
Азот, фосфор и мышьяк являются неметаллами, сурьма и висмут – металлы. химические свойства Р, As, Sb и Bi определяются только строением внешнего электронного слоя
33.
Азот, его характеристика. Аммиак, соли
аммония.
Азо́т —
элемент
15-й группы второго периода периодической
системы химических элементов
Д. И. Менделеева,
с атомным
номером 7. Обозначается символом N.
азот — достаточно инертный при
нормальных условиях двухатомный газ
без цвета, вкуса и запаха, из которого
на три четверти состоит земная
атмосфера. В лабораториях его можно
получать по реакции разложения нитрита
аммония: NH4NO2 → N2↑ + 2H2O При нормальных
условиях азот это бесцветный газ, не
имеет запаха, мало растворим в воде. В
жидком состоянии — бесцветная,
подвижная, как вода, жидкость. При
контакте с воздухом поглощает из него
кислород. При −209,86 °C азот переходит
в твердое состояние в виде снегоподобной
массы или больших белоснежных
кристаллов.
Аммиа́к —
NH3, нитрид
водорода, при нормальных
условиях — бесцветный газ с резким
характерным запахом (запах нашатырного
спирта), почти вдвое легче воздуха,
IV класс опасности (малоопасные вещества).
Растворимость NH3 в воде чрезвычайно
велика. Так, он присоединяет протон,
образуя ион
аммония:
![]()
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
Взаимодействуя с кислотами даёт соответствующие соли аммония:
![]()
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
![]()
Со́ли аммо́ния — соли, содержащие положительно заряженный ион аммония NH4+; по строению, цвету и другим свойствам они похожи на соответствующие соли калия. Все соли аммония растворимы в воде, полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются. Получают их при взаимодействии NH3 или NH4OH с кислотами. Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов; Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение; Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине; Хлорид аммония (нашатырь) NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии. Сильные электролиты (диссоциируют в водных растворах): NH4Cl ↔ NH4+ + Cl− Разложение при нагревании: а) если кислота летучая NH4Cl → NH3↑ + HCl NH4HCO3 → NH3↑ + Н2O + CO2 б) если анион проявляет окислительные свойства NH4NO3 → N2O↑ + 2Н2O (NH4)2Cr2O7 → N2↑ + Cr2O3+ 4Н2O С кислотами (реакция обмена): (NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑ 2NH4+ + CO32− + 2H+ + 2Cl− → 2NH4+ + 2Cl− + Н2O + CO2 ↑ CO32− + 2H+ → Н2O + CO2 ↑ C солями (реакция обмена): (NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3 2NH4+ + SO42− + Ba2+ + 2NO3− → BaSO4 ↓ + 2NH4+ + 2NO3− Ba2+ + SO42− → BaSO4 ↓
Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) — среда кислая: NH4Cl + Н2O ↔ NH4OH + HCl NH4+ + Н2O ↔ NH4OH + H+ При нагревании со щелочами выделяют аммиак (качественная реакция на ион аммония) NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
34. Соединения азота в степенях окисления +1+2+3. Получения и свойства степени окисления +1 оксид азота(I) N2O (закись азота, веселящий газ)При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. Получение: Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом: NH4NO3 → N2O↑ + 2H2O. Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой: NH2SO2OH + HNO3 (73 %) → N2O↑ + H2SO4 + H2O. Относится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя: N2O + H2 → N2 + H2O; N2O + C → N2 + CO. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O. При нагревании N2O разлагается: 2N2O → 2N2 + O2.
Оксид азота (II) (мон(о)оксид азота, окись азота, нитрозил-радикал) NO — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет. Получение: Оксид азота (II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах: N2 + O2 → 2NO — 180,9 кДж и тотчас же реагирует с кислородом: 2NO + O2 → 2NO2. При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты. В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью: 3Cu + 8HNO3 (30 %) → 3Cu(NO3)2 + 2NO↑ + 4H2O. Свойства: При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха: 2NO + O2 → 2NO2 Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя: 2NO + Cl2 → 2NOCl (нитрозилхлорид). В присутствии более сильных восстановителей NO проявляет окислительные свойства: 2SO2 + 2NO → 2SO3 + N2↑. В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Оксид азота(III) (азотистый ангидрид, сесквиоксид азота) N2O3 — бесцветный газ (при н. у.), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.
Получение: Рекомендуется капать 50%-ю азотную кислоту на твёрдый оксид мышьяка(III): 2HNO3 (50 %) + As2O3 → NO2↑ + NO↑ + HAsO3. N2O3 образуется при охлаждении получающейся смеси газов. При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета: N2 + O2 → 2NO; 2NO + O2 → 2NO2; NO + NO2 → N2O3. Также N2O3 можно получить действием 50%-ой азотной кислоты на крахмал: (С6H10O5)n + 12nHNO3 → 6nNO↑ + 6nNO2↑ + 6nCO2↑ + 11nH2O
Свойства: Кислотный оксид. N2O3 подвержен термической диссоциации: N2O3 ↔ NO2 + NO. При 25 °C содержание N2O3 в смеси газов составляет около 10,5 %. Жидкий оксид азота(III) синего цвета, он также частично диссоциирован. Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту: N2O3 + H2O ↔ 2HNO2. При взаимодействии с растворами щелочей образуются соответствующие нитриты: N2O3 + 2KOH → 2KNO2 + H2O.
35. Соединения азота в степенях окисления +4+5. Получения и свойства. Оксид азота (IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом. Получение: В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь: Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O. Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность: 2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑. Свойства: Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель: 2NO2 + 2C → 2CO2↑ + N2↑; Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты: SO2 + NO2 → SO3 + NO↑. При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования): 2NO2 + H2O ↔ HNO3 + HNO2. Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO: 3NO2 + H2O → 2HNO3 + NO↑. Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя): 4NO2 + 2H2O + O2 ↔ 4HNO3. При растворении NO2 в щелочах образуются как нитраты, так и нитриты: 2NO2 + 2KOH → KNO3 + KNO2 + H2O. Жидкий NO2 применяется для получения безводных нитратов: Zn + 2N2O4 → Zn(NO3)2 + 2NO
Оксид азота(V) (пентаоксид диазота, нитрат нитроила, азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив. Получение: Путём дегидратации азотной кислоты HNO3 посредством P2O5: 2HNO3 + P2O5 → 2HPO3 + N2O5; 12HNO3 + P4O10 → 4H3PO4 + 6N2O5; 2) Пропуская сухой хлор над сухим нитратом серебра: 4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2↑(по другим данным, тут будет образовываться хлорид серебра и хлорнитрат); 3) Путём взаимодействия оксида азота(IV) с озоном: 2NO2 + O3 → N2O5 + O2↑.
Свойства: Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин: 2N2O5 → 4NO2↑ + O2↑ - Q. Растворяется в воде с образованием азотной кислоты (обратимая реакция): N2O5 + H2O ↔ 2HNO3. Растворяется в щелочах с образованием нитратов: N2O5 + 2NaOH → 2NaNO3 + H2O.
36. Фосфор, его характеристика, соединения фосфора
Фосфор— химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы; имеет атомный номер 15. Один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[4]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Получение: Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода),
4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода).
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
2P + 3Ca → Ca3P2,
2P + 3Mg → Mg3P2.
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
2P + 3S → P2S3,
2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует(Диспропорциони́рование (дисмутация) — химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
):
8Р + 12Н2О = 5РН3 + 3Н3РО4 (фосфорная кислота).
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 → 5KCl + 3P2O5
37.Р- элементы IV группы . Общая характеристика.
Углерод, кремний, германий, олово и свинец составляют главную подгруппу IV группы. Внешние энергетические уровни р-элементов IV группы содержат по четыре электрона (конфигурация ns2np2), из которых два спаренных s-электрона и два неспаренных р-электрона. В невозбужденном состоянии элементы этой подгруппы проявляют валентность, равную двум. При переходе в возбужденное состояние, сопровождающееся переходом одного из s-электронов внешнего уровня в свободную ячейку р-подуровня того же уровня, все электроны наружного слоя становятся неспаренными, и валентность при этом возрастает до 4.

Энергия, затрачиваемая для перехода электрона, с избытком компенсируется энергией, выделяющейся при образовании четырех связей. В соединениях элементы подгруппы углерода проявляют степень окисления +4 или -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типичная степень окисления +4, для свинца — +2. Степень окисления -4 в последовательности С — Pb становится все менее характерной. Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения формулы — RH4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные — у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: CH4 — прочное вещество, а PbH4 в свободном виде не выделено. При переходе от углерода к свинцу радиусы нейтральных атомов возрастают, а энергия ионизации уменьшается, поэтому от углерода к свинцу убывают неметаллические свойства, а металлические возрастают. Неметаллами являются углерод и кремний

 озрастает
озрастает