
- •26.Работа и теплота.
- •27.Теплоемкость идеального газа.Теплоемкость при постоянном объеме и давлении. Уравнение Майера.
- •28.Теплоемкости одноатомных и многоатомных газов:
- •30. Адиабатический процесс (изоэнтропийный)
- •32.Обратимые и необратимые процессы.Энтропия
- •33.Второе начало термодинамики.
- •34.Цикл Карно.Кпд тепловой машины по циклу Карно.
- •35.Основное уравнение Кинетической теории газов.
- •Максвелловское распределение молекул по их скоростям и энергиям
- •37.Барометрическая формула.Распределение Больцмана.
30. Адиабатический процесс (изоэнтропийный)
А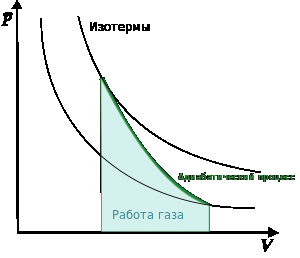 диабатический
процесс — термодинамический процесс
в макроскопической системе, при котором
система не получает и не отдаёт тепловой
энергии. Если
термодинамический процесс в общем
случае являет собой три процесса —
теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии, то адиабатический
процесс в силу отсутствия теплообмена
(ΔQ = 0)
системы со средой сводится только к
последним двум процессам. Поэтому,
первое начало термодинамики в этом
случае приобретает вид ΔU=-A,
где ΔU
– изменение внутренней энергии тела,
а A
– работа совершаемая системой.
Изменения
энтропии S системы в обратимом
адиабатическом процессе вследствие
передачи тепла через границы системы
не происходит: ds=ϬQ/T=0,
Здесь T
–температура системы, ϬQ-
температура, полученная системой.
диабатический
процесс — термодинамический процесс
в макроскопической системе, при котором
система не получает и не отдаёт тепловой
энергии. Если
термодинамический процесс в общем
случае являет собой три процесса —
теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии, то адиабатический
процесс в силу отсутствия теплообмена
(ΔQ = 0)
системы со средой сводится только к
последним двум процессам. Поэтому,
первое начало термодинамики в этом
случае приобретает вид ΔU=-A,
где ΔU
– изменение внутренней энергии тела,
а A
– работа совершаемая системой.
Изменения
энтропии S системы в обратимом
адиабатическом процессе вследствие
передачи тепла через границы системы
не происходит: ds=ϬQ/T=0,
Здесь T
–температура системы, ϬQ-
температура, полученная системой.
Поясним понятие работы применительно к адиабатическому процессу. В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем, если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок dh совершать работу: dA=Fdh, где F- сила, с которой газ действует на поршень. Перепишем уравнение: dA=psdh, где s-площадь поршня.Тогда работа будет равна : dA=pdV ,где — давление газа, dV — малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения. Данное уравнение справедливо и при расширении на произвольных объёмах. Для этого достаточно разбить поверхность расширения на элементарные участки dS на которых расширение одинаково .
31.Изотермический процесс (T = const)
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения (*) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным: pV = const.
На
плоскости (p,
V)
изотермические процессы изображаются
при различных значениях температуры T
семейством гипербол p
~ 1 / V,
которые называются изотермами. Так как
коэффициент пропорциональности в этом
соотношении увеличивается с ростом
температуры, изотермы, соответствующие
более высоким значениям температуры,
располагаются на графике выше изотерм,
соответствующих меньшим значениям
температуры.g
Уравнение изотермического процесса
было получено из эксперимента английским
физиком Р. Бойлем (1662 г.) и независимо
французским физиком Э. Мариоттом (1676
г.). Поэтому это уравнение называют
законом Бойля–Мариотта.

Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Несколько изотерм для идеального газа нa p-V диаграмме
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
В идеальном газе при изотермическом процессе произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах p,V — гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (см. рисунок).
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Термодинамика изотермического процесса: T=const.
Приведем закон, описывающий этот процесс, и его график в координатах (P,V).
Рис.
4
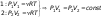 -закон
Бойля-Мариотта
-закон
Бойля-Мариотта
Так как T = const, то dU=v(i/2)RdT=0
т. е. dU = 0 - изменение внутренней энергии газа при изотермическом процессе равно нулю.
ТогдаdQ = dA - Первое начало термодинамики при изотермическом процессе
При
изотермическом процессе вся теплота,
сообщенная газу, идет на работу,
совершаемую газом: Q
= A.Выпишем
работу, совершаемую газом при изотермическом
процессе. Используя уравнение
Менделеева-Клапейрона
 представим
элементарную работу в виде:
представим
элементарную работу в виде:
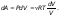 Тогда
Тогда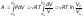

Рис.
5 работу можно вычислить также по
формуле:A=vRTln(P1/P2);На
графике (P,V)
работа, совершаемая газом, численно
равна площади под кривой, описывающий
изотермический процесс.Изотермический
процесс — термодинамический
процесс, происходящий в физической
системе при постоянной температуре.
работу можно вычислить также по
формуле:A=vRTln(P1/P2);На
графике (P,V)
работа, совершаемая газом, численно
равна площади под кривой, описывающий
изотермический процесс.Изотермический
процесс — термодинамический
процесс, происходящий в физической
системе при постоянной температуре.
Несколько изотерм для идеального газа нa p-V диаграмме. Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии),теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
