
- •4. Классы неорганических соединений.
- •Получение
- •Химические свойства
- •Химические свойства
- •5) Модель строения атома Резерфорда
- •6) Модель строения атома Бора
- •7)Принципы квантово-механической модели.
- •8) Уравнение Шредингера. Основные идеи, положения, и его основу.
- •10)Понятие электронного уровня, орбитали, подуровня.
- •Принцип исключения Паули (запрет Паули)
- •Принцип наименьшей энергии
- •Правило Клечковского
- •Правило Гунда
- •13) Периодический закон Менделеева. Периодичность в изменении различных свойств элементов.
- •14) Сходство и различие химических свойств элементов главных и побочных подгрупп.
- •15) Химическая связь. Виды химической связи. Энергетические и геометрические характеристики связи.
- •16) Природа химической связи. Энергетические эффекты в процессе образования химической связи.
- •17) Основные положения метода валентных связей. Обменный и донорно-акцепторный механизмы образования ковалентной связи.
- •18) Валентные возможности атомов элементов в основном и возбужденном состоянии.
- •21) Полярность ковалентной связи. Теория гибридизации. Виды гибридизации. Примеры.
- •22) Полярность ковалентной связи. Дипольный момент.
- •23) Достоинства и недостатки метода в.С.
- •26) Ионная связь как предельный случай ковалентной полярной связи. Свойства ионной связи. Основные виды решеток для соединений с ионной связью.
- •27) Металлическая связь. Особенности. Элементы зонной теории для объяснения особенностей металлической связи.
- •28)Межмолекулярное взаимодействие. Ориентационный, индукционный и дисперсионный эффекты.
- •29) Водородная связь.
- •30) Основные типы кристаллических решеток.
- •31) Законы термохимии. Закон Гесса.
- •32) Понятие о внутренней энергии системы, энтальпии, энтропии.
- •33) Энергия Гиббса, ее взаимосвязь с энтальпией и энтропией. Изменение энергии Гиббса в самопроизвольно протекающих процессах.
- •34) Скорость химических реакций. Закон действия масс для гомогенных и гетерогенных реакций. Сущность константы скорости. Порядок и молекулярность реакции.
- •35) Факторы, влияющие на скорость химической реакции.
- •36) Влияние температуры на скорость химических реакций. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •37) Особенности протекания гетерогенных реакций. Влияние диффузии и степень дискретности вещества.
- •38) Влияние катализатора на скорость химических реакций. Причины влияния катализатора.
- •39) Обратимые процессы. Химическое равновесие. Константа равновесия.
- •40)Влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •41) Определение раствора. Физико-химические процессы при образовании растворов. Изменение энтальпии и энтропии при растворении.
- •42) Способы выражения концентрации растворов.
- •43) Закон Рауля
- •44) Осмос. Осмотическое давление. Закон Вант-Гоффа
- •45) Растворы электролитов. Сильные и слабые электролиты. Степень электролитической диссоциации. Изотопический коэффициент.
- •46) Теория электролитической диссоциации. Физическая теория Аррениуса, химическая теория Менделеева и современный взгляд на диссоциацию.
- •47) Реакция в растворах, их направленность. Смещение ионных равновесий.
- •48) Ионное произведение воды. Водородный показатель как химический показатель раствора.
- •49)Гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •50) Гидролиз солей, его зависимость от температуры, разбавления и природы солей (три типичных случая) Константа гидролиза. Практическое значение в процессе коррозии металла.
- •51) Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •52) Зависимость электродного потенциала от природы веществ, температуры и концентрации раствора. Формула Нернста.
- •53) Гальванические элементы. Процессы на электродах. Эдс гальванического элемента.
- •54) Обратимые источники электрической энергии. Кислотные и щелочные аккумуляторы.
- •55) Топливные элементы.
- •1) Активные металлы
- •2) Менее активные металлы
- •3) Неактивные металлы
30) Основные типы кристаллических решеток.
Кубическая, объемно-центрированная кубическая, грансцентрированная кубическая, гексагональная плотноупакованная. Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела. Основу ОЦК- решетки составляет элементарная кубическая ячейка, в которой положительно заряженные ионы металла находятся в вершинах куба. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий. У ГЦК-решетки элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы. Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная. ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований.
Кристаллическая решетка - присущее веществу в кристаллическом состоянии правильное расположение атомов ( ионов, молекул), характеризующееся периодической повторяемостью в трех измерениях.
Ионная кристаллическая решетка. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия между ними являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной.Пример NaCl ( каменная соль)
Атомная кристаллическая решетка. В узлах кристаллической решетки помещаются нейтральные атомы. Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, называется гомеополярной или ковалентной. Силы взаимодействия при гомеополярной связи имеют, как и в случае с гетерополярной связью, электрический (но не кулоновский) характер. Типичными примерами атомных кристаллов могут служит алмаз и графит.
Металлическая кристаллическая решетка. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов.
Молекулярная кристаллическая решетка. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности.H2, N2, O2, CO2, HO2.
31) Законы термохимии. Закон Гесса.
Термохимия – раздел химии, посвященный количественному изучению тепловых эффектов реакций.
В конце 18 века было установлено, что если при образовании какого-либо соединения выделяется (или поглощается) некоторое количество теплоты, то при разложении этого соединения в тех же условиях такое же количество теплоты поглощается (или выделяется). Это положение вытекает из закона сохранения энергии. А из этого предположения следует, что вещества, при образовании которых выделяется большое количество теплоты, весьма прочны и трудно разлагаются, так как чем больше теплоты выделяется при образовании этого вещества, тем больше энергии надо затратить на его разложение.
1-й закон термохимии.
Тепловой эффект образования в-ва равен
тепловому эффекту разложения этого же
в-ва, но с противоположным знаком.
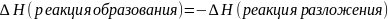
2-й закон термохимии. Тепловой эффект реакции определяется начальным и конечным состоянием системы и не зависит от пути процесса.
Закон Гесса: Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Закон Гесса дает возможность вычислять тепловые эффекты реакции в тех случаях, когда их непосредственное измерение по чему- либо не осуществимо. Например измерить тепловой эффект реакции

Теплоту образования CO можно вычислить, зная его теплоту сгорания( 283,0 кДж/моль) и теплоту образования двуоксида углерода ( 393,5 кДж/моль)
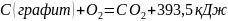
Для вычисления теплоты образования CO запишем эту реакцию в виде двух стадий
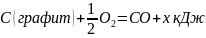

И сложим термохимические уравнения, отвечающие этим стадиям. Получим суммарное уравнение

Согласно закону Гесса получаем x+283 =393,5. Отсюда x+ 110,5 кДж.
Следствие закона Гесса: Тепловой эффект химической реакции равен сумме образования полученных веществ за вычетом суммы теплот образования исходных веществ.
