
- •4. Классы неорганических соединений.
- •Получение
- •Химические свойства
- •Химические свойства
- •5) Модель строения атома Резерфорда
- •6) Модель строения атома Бора
- •7)Принципы квантово-механической модели.
- •8) Уравнение Шредингера. Основные идеи, положения, и его основу.
- •10)Понятие электронного уровня, орбитали, подуровня.
- •Принцип исключения Паули (запрет Паули)
- •Принцип наименьшей энергии
- •Правило Клечковского
- •Правило Гунда
- •13) Периодический закон Менделеева. Периодичность в изменении различных свойств элементов.
- •14) Сходство и различие химических свойств элементов главных и побочных подгрупп.
- •15) Химическая связь. Виды химической связи. Энергетические и геометрические характеристики связи.
- •16) Природа химической связи. Энергетические эффекты в процессе образования химической связи.
- •17) Основные положения метода валентных связей. Обменный и донорно-акцепторный механизмы образования ковалентной связи.
- •18) Валентные возможности атомов элементов в основном и возбужденном состоянии.
- •21) Полярность ковалентной связи. Теория гибридизации. Виды гибридизации. Примеры.
- •22) Полярность ковалентной связи. Дипольный момент.
- •23) Достоинства и недостатки метода в.С.
- •26) Ионная связь как предельный случай ковалентной полярной связи. Свойства ионной связи. Основные виды решеток для соединений с ионной связью.
- •27) Металлическая связь. Особенности. Элементы зонной теории для объяснения особенностей металлической связи.
- •28)Межмолекулярное взаимодействие. Ориентационный, индукционный и дисперсионный эффекты.
- •29) Водородная связь.
- •30) Основные типы кристаллических решеток.
- •31) Законы термохимии. Закон Гесса.
- •32) Понятие о внутренней энергии системы, энтальпии, энтропии.
- •33) Энергия Гиббса, ее взаимосвязь с энтальпией и энтропией. Изменение энергии Гиббса в самопроизвольно протекающих процессах.
- •34) Скорость химических реакций. Закон действия масс для гомогенных и гетерогенных реакций. Сущность константы скорости. Порядок и молекулярность реакции.
- •35) Факторы, влияющие на скорость химической реакции.
- •36) Влияние температуры на скорость химических реакций. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •37) Особенности протекания гетерогенных реакций. Влияние диффузии и степень дискретности вещества.
- •38) Влияние катализатора на скорость химических реакций. Причины влияния катализатора.
- •39) Обратимые процессы. Химическое равновесие. Константа равновесия.
- •40)Влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •41) Определение раствора. Физико-химические процессы при образовании растворов. Изменение энтальпии и энтропии при растворении.
- •42) Способы выражения концентрации растворов.
- •43) Закон Рауля
- •44) Осмос. Осмотическое давление. Закон Вант-Гоффа
- •45) Растворы электролитов. Сильные и слабые электролиты. Степень электролитической диссоциации. Изотопический коэффициент.
- •46) Теория электролитической диссоциации. Физическая теория Аррениуса, химическая теория Менделеева и современный взгляд на диссоциацию.
- •47) Реакция в растворах, их направленность. Смещение ионных равновесий.
- •48) Ионное произведение воды. Водородный показатель как химический показатель раствора.
- •49)Гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •50) Гидролиз солей, его зависимость от температуры, разбавления и природы солей (три типичных случая) Константа гидролиза. Практическое значение в процессе коррозии металла.
- •51) Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •52) Зависимость электродного потенциала от природы веществ, температуры и концентрации раствора. Формула Нернста.
- •53) Гальванические элементы. Процессы на электродах. Эдс гальванического элемента.
- •54) Обратимые источники электрической энергии. Кислотные и щелочные аккумуляторы.
- •55) Топливные элементы.
- •1) Активные металлы
- •2) Менее активные металлы
- •3) Неактивные металлы
18) Валентные возможности атомов элементов в основном и возбужденном состоянии.
Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
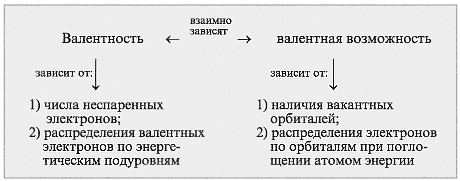
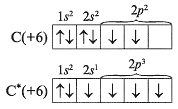
Поскольку валентность атома зависит от числа неспаренных электронов, полезно рассмотреть структуры атомов в возбужденных состояниях, учитывая валентные возможности. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод С в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии:
19) Описать метод валентных связей и сравнить их в след. молекулах и ионах. N2, F2, CO, [Zn(NH3)4]2+, BF3
20) Насыщаемость ковалентной связи. Понятие валентности.
Насыщаемость КС — это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.
Валентность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
21) Полярность ковалентной связи. Теория гибридизации. Виды гибридизации. Примеры.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
Гибридизация орбиталей — это понятия вводятся для того, чтобы отразить изменения, происходящие с электронными орбиталями атомов при образовании ими химических связей в молекуле и, одновременно, чтобы сохранить представление об атомных орбиталях в молекуле. Полагают, что атомные орбитали изменяются, перемешиваются между собой, т.е. гибридизируются, но все-таки в молекуле сохраняются как атомные орбитали.
-sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподеленными парами электронов.
-sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
-sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
-sp3d2- гибридизация, когда в образовании гибридных орбиталей участвуют одна s-, три p- и две d - орбитали. В этом случае образуются 6 равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра.
