
- •1.Антгены и иммуногены. Антигенные детерминанты, эпитопы. Гаптены.
- •3.Антиидиотипические и видоспецифические антитела
- •5. Мка получают с помощью гибридомной технологии, а пка выделяют из сыворотки.
- •6. Методы получения антител
- •7. Стадии получения мка и пка
- •9 Требования к свойствам моноклональных антител:
- •10 Вопрос. Гибридомная технология.
- •12.Рекомбинантные иммунотоксины и иммуноферменты. Иммуноадгезины. Абзимы.
- •13 .Селекция методом фагового дисплея.
- •In vitro и in vivo скрининг библиотек фагового дисплея
- •Вопрос15. Антитела и нанотехнологии.
- •Типы наночастиц
- •17)Трансгенные растения и животные – продуценты антител.
- •18. Классификация методов на основе антител
- •19. Прямые и непрямые иммунохимические методы
- •21. Амплификация сигнала и неспецифическое связывание.
- •23. Способы мечения антител и визуализации комплексов антиген-антитело
- •26)Радиоиммунологические методы.
- •27. Виды ифа. Чувствительность анализа, способы её повышения.
- •29. Ифа. Принцип. Конкурентный и «Сэндвич»-ифа.
- •31. Твердофазные виды ифа. Подбор условий методом «шахматной доски»
- •32. Western-блотинг.Dot-blot. Системы детекции и амплифкации сигнала.
- •33.Метод иммунного блоттинга
- •34.Клеточный ифа. EliSpot. Поляризационный флуороиммуноанализ (пфиа).
- •36.Цитофлюориметрия. Популяционный анализ клеток. Клеточный сортинг.
- •37. Клеточное типирование и селекция клеток. Иммуноцитохимия.
- •38.IgA, IgG, IgM: методы определения, реакция агглютинации
- •40. Флуориметрия и методы на ее основе. Флюоресцентная и конфокальная микроскопия. Локализация антигенов.
- •42. Методы, применяемые в иммунодиагностике
- •43. Фагоциты: исследование функций
- •5. Комплемент, лабораторное исследование функций
- •Иммунные комплексы циркулирующие: методы определения
- •45. Методы выявления клеточных антигенов. Маркеры клеточной активации. Дифференцировочные маркеры лейкоцитов.
- •46.Иммунопрофилактика, иммунотерапия, иммунокорекция, иммуномодуляция. Выбор средств, определение вида и способа иммунокорекции.
- •1. Основные виды иммунокорригирующей терапии
- •2. Выбор средств, определение вида и способа иммунокоррекции
- •48. Оценка фагоцитоза, в- и т-систем иммунитета, активности антителобразующих клеток.
- •49)Иммунопроилактика. Вакцины. Виды вакцин. Способы их получения. Успехи применения вакцинации.
- •50)Иммунодифициты: диагностика и иммунотерапия. Оценка иммунного статуса прииммуннодифицитах.
- •51. Стимуляция пролиферации дендритных клеток. Содействие захвату антигена и его процессингу. Стимуляция ответа эффекторных клеток при помощи прямой презентации антигена.
- •52)Направления имуннотерапии рака. Противораковые вакцины.
- •53.Применение имитаторов опухолевых антигенов. Экстрокорпоральная активация противораковых иммунокомпетентных клеток
- •54.Элиминация раковой опухоли с помощью антител. Ангиостатический подход. Использование цитокинов
- •55. Пробиотики, пищевые волокна.
- •56. Применение иммуномодуляторов при иммунодефицитах.
- •59. Критерии выбора методов для исследования, их применение в биологии, экспериментальной и практической медицине и др. Областях
- •60. Иммунологические подходы и методы, применяемые в медицине
38.IgA, IgG, IgM: методы определения, реакция агглютинации
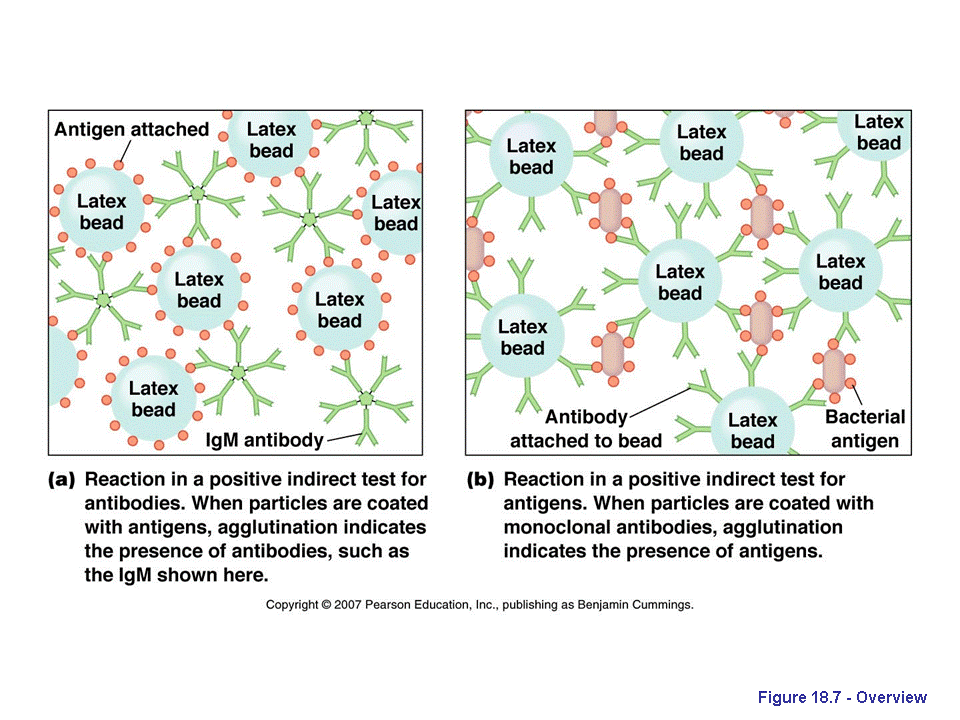
Методы, основанные на реакции агглютинации. Для реакции агглютинации обычно используют эритроциты (гемагглютинация) или частицы латекса (латекс-агглютинация), покрытые известным антигеном. В присутствии антител к этому антигену происходит агглютинация эритроцитов или частиц латекса.
Гемагглютинация применяется для выявления антител к тиреоглобулину и микросомальным антителам, латекс-агглютинация - для выявления ревматоидного фактора и некоторых других антител. Эти методы просты и позволяют количественно определить антиген, однако менее чувствительны, чем радиоимунный и твердофазный иммуноферментный анализы.
2. Агглютинационные методы
2.2 Пассивная гемагглютинация (ПГА)
2.3 Реакция торможения гемагглютинации (РТГА)
2.4 Обратная ПГА и реакция розетирования
Прямая агглютинация (определение титра антител) непрямая
Агглютинация:
Прямая, непрямая
Гемагглютинация, латекс, комплемент, др.
Реакция нейтрализации
На стекле, кольцевой тест в трубках
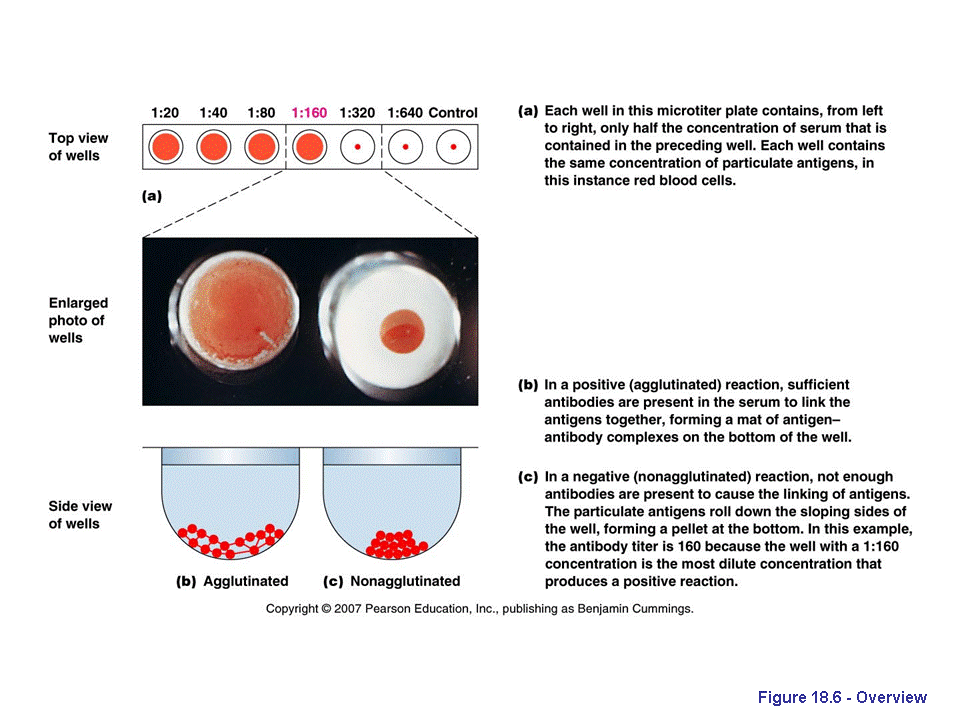
Собственно феномен гемагглютинации заключается в объединении эритроцитов в видимые невооруженным глазом агрегаты и более быстром, чем оседание свободных эритроцитов, осаждении их из раствора. Помимо открытых еще К. Ландштейнером агглютининов α и β агрегиро-вание эритроцитов могут вызывать антитела к различным эритроцитар-ным антигенам, лектины растительного происхождения, антигены и жгутики бактерий некоторых видов, некоторые вирусы, в том числе и виру-сы человека. Такую гемагглютинацию принято называть прямой или активной. Кроме этого, при закреплении на поверхности эритроцитов изначально несвойственных им антигенов, возможно агрегирование и осаждение их антителами, комплементарными таким антигенам. В этом случае агглютинацию называют непрямой или пассивной.
Осаждение эритроцитов лучше всего наблюдать в небольших объемах, вносимых в специальные углубления (лунки) на поверхности стеклянных пластинок или полистироловых планшетов для иммунологических реакций Дно таких углублений имеет форму сферы, поэтому при естественном (без агглютинации) оседании эритроцитов на дне такой лунки в центре образуется плотный осадок с ровными краями, занимающий небольшую площадь (так называемая «пуговка»). Такой результат в реакциях учитывают как отрицательный. При наличии агглютинации в зависимости от ее степени осадок появляется на большей, чем «пуговка», площади и края осадка выглядят размытыми. При самой эффективной агглютинации осадок покрывает практически все сферическое дно, формируя так называемый «зонтик» (название связано со сходством наблюдаемой картины с красным перевернутым зонтом). Одной из разновидностей реакций гемагглютинации является реакция Кумбса, применяемая для выявления неполных антител. Как уже упоминалось ранее, такие антитела закрепляются на поверхности эрит-роцитов естественным образом, поэтому если смешать суспензию эрит-роцитов с антителами, комплементарными изотипическим антигенным детерминантам иммуноглобулинов определенного класса (антииммуног-лобулинами), будет происходить их агрегирование. Такой вари-ант реакции Кумбса называется прямым и применяется для выявления уже сорбированных неполных антител. Для выявления неполных антител в плазме крови смешивают взятую от пациента сыворотку и суспензию эритроцитов другого организма, выдерживают необходимое для адсорб-ции неполных антител время и добавляют антииммуноглобулины. Такой тест называется непрямой реакцией Кумбса. Реакции выявления непол-ных антител проводят при ряде неинфекционных (гемолитическая ане-мия, желтуха)
Гемагглютинацию можно использовать для выявления определенных возбудителей болезней и антител, вырабатываемых под их воздействием
разработан метод РТПГА – реакция торможения пассивной гемагглютинации . В этом случае используют эритроциты, на поверхности которых сорбирован определенный гормон (сенсибилизированные гормоном эритроциты), и антитела, специфичные к этому гормону. Анализируемую на присутствие такого же гормона жидкость смешивают с антителами. Параллельно в качестве контроля с таким же объемом суспензии антител смешивают эквивалентное количество физиологического раствора. По истечении времени, необходимого для связывания гормона с антителами, в обе смеси добавляют суспензию сенсибилизированных гормоном эритроцитов. Если в контроле агглютинация происходит, а в опыте – нет или наблюдается снижение ее эффективности, делается вывод о присутствии гормона в анализируемой жидкости, поскольку уже связанные с гормоном антитела не могут агглютинировать эритроциты
39. Одним из наиболее распространенных вариантов таких реакций является двойная радиальная иммунодиффузия по Оухтерлони (ил. 47). Для постановки реакции в разные лунки, вносят суспензии антигенов и антител. Молекулы реагентов диффундируют в гель, и в случае соответствия антигена и антитела в геле между лунками образуется полоска преципитата. Иммунодиффузия получила название двойной в силу того, что оба компонента движутся в геле навстречу друг другу.
Метод позволяет анализировать сыворотки на содержание антител различной специфичности. В этом случае вокруг одной заполняемой сывороткой лунки располагаются лунки, в которые вносятся различные антигены. По сходной схеме возможно определить наличие в анализируемом растворе нескольких различных антигенов, но в этом случае анализируемый раствор вносят в центральную лунку, а лунки вокруг заполняют различными моноспецифическими сыворотками. При наличии двух или более полос между конкретными лунками делается вывод о наличии в анализируемых смесях нескольких антигенов, способных связываться с антителами сыворотки, но обладающих различной скоростью диффузии. По ширине образующихся полос преципитата можно предположительно оценивать разницу в концентрациях того или иного реагента в анализируемых смесях, однако этот метод не является истинно количественным.
Для определения количества реагирующих компонентов используется простая радиальная иммунодиффузия по Манчини. Для постановки этой реакции один из компонентов (например, антитела) вносят в гелеобразующий раствор до застывания и перемешиванием добиваются равномерного его распространения. После застывания геля в слое образуется одинаковая концентрация этого компонента в любой точке геля. После изготовления лунок их заполняют растворами, содержащими второй компонент (в нашем примере молекулы антигена). В данном случае диффундирующим считается только один, вносимый в лунки, компонент, поэтому такая иммунодиффузия и получила название простой, а не двойной. При соответствии антигенов и антител по специфичности в силу равномерной диффузии по всем направлениям (отсюда название «радиальная диффузия») преципитат образуется в зоне, представляющей окружность вокруг лунки.
Определенными недостатками преципитации в гелях являются длительность проведения реакций и нечеткость результатов при невысоких концентрациях антигенов. С целью преодолеть эти недостатки во второй половине ХХ века были разработаны методы, сочетающие белковый электрофорез и иммунопреципитацию, которые получили общее название иммуноэлектрофорез. Помимо выигрыша во времени и повышения разрешающей способности такие методы дают возможность более четко отличить белковые антигены, имеющие одинаковые антигенные детерминанты, но отличающиеся по молекулярной массе. Для этого достаточно так называемого обычного иммуноэлектрофореза. Для его постановки изготавливают гель, в котором помимо обычных стартовых лунок готовят также желобок для сыворотки. Желобок располагают между дорожками в направлении от электрода к электроду, т. е. вдоль фронта движения белков. Гель из желобка не удаляют, чтобы не нарушать прохождение электрического тока во время фореза. Сначала в соответствующем буферном растворе проводят электрофорез образцов, анализируемых на присутствие искомого антигена. После снятия электрического поля пластинку геля переносят во влажную камеру, из желобка удаляют гель и вместо него вносят сыворотку или суспензию монокло-нальных антител.
Описанные выше варианты иммуноэлектрофореза позволяют выявить антиген, но не определить его количество. Количественным методом (фактически модификацией иммунодиффузии по Mанчини) является так называемый ракетный иммуноэлектрофорез. Для его постановки в охлажденный до 50°С гелеобразующий раствор вносят подогретую до такой же температуры сыворотку с таким расчетом, чтобы она составляла 1-5 % геля, перемешивают и готовят пластинку геля. После внесения в лунки антигенов проводят электрофорез, условия которого подбирают так, чтобы максимально ограничить смещение молекул антител в электрическом поле (чаще всего используют барбиталовый буфер с рН 8,6 и низкое напряжение). Время электрофореза должно обеспечить выход всех молекул антигена из лунки в гель и вхождение их в состав преципитата, обычно это происходит в течение двух часов. Преципитаты в таких условиях образуются в зонах по ходу движения антигена, которые имеют форму вытянутого конуса (ракеты). Длина зоны образования преципитата пропорциональна концентрации антигена, что дает возможность, измерив длину «ракеты» и используя специально построенный калибровочный график, определить количество антигена в пробе.
Вариантом ракетного иммуноэлектрофореза является так называемый перекрестный электрофорез. Для его постановки готовят обычной гель и проводят обычный электрофорез анализируемой пробы. При этом используют одну пробу и лунку располагают у одного из краев пластинки. После проведения электрофореза часть пластинки (около 4/5 от исходного размера) отрезают и удаляют, оставляя только ту часть, в которой находится дорожка первого электрофореза. Затем в ту же камеру заливают гелеобразующий раствор с сывороткой так, чтобы оставшийся участок пластинки объединился с новым, содержащим сыворотку, гелем. Меняют положение пластинки (или электродов) так, чтобы направление движения антигенов было перпендикулярным тому, которое было при первом форезе, и проводят второй форез в условиях, как для ракетного.
