
- •§1. Макрокинетическая система.
- •§2. Основные задачи химической кинетики.
- •§3. Скорость химической реакции.
- •§4. Скорость простых химических превращений.
- •5. Реакции нулевого порядка.
- •§7. Последовательные реакции.
- •§8. Параллельные реакции.
- •§11. Кинетические уравнения обратимого химического проце-сса.Пусть имеем простую реак-цию:
- •§13. Колебательные режимы протекания химических реакций.При описании процесса окисления высших углеводородов используется модельная схема. Схема Вольтера:
- •§14. Элементарные понятия теории цепных реакций.
- •4. Стадия разветвления цепей.
- •§16. Окисление водорода при низком давлении, как пример црр.Рассмотрим одну из наибо-лее интересных реакций: окисле-ние водорода. Это высокоэнерге-тическая реакция.
- •§19. Элементы теории соударений.Данная теория была разработана и нашла широкое применение для газофазных реакций.
5. Реакции нулевого порядка.
Было показано, при каких условиях, происходит формаль-ное понижение порядка реакции. Для этого изменение одного из исходных веществ должно быть мало существенным по сравне-нию с его начальным значением. Если изменение концентрации всех исходных веществ не сущес-твенно по сравнению с их началь-ными концентрациями, то можно формально говорить о реакции нулевого порядка, поскольку в этом случае скорость реакции практически не будет зависеть от концентрации исходных веществ. Реально это возможно в двух слу-чаях:
1).если рассматривается
химичес-кий процесс при
![]() ,
т. е. в начале химического процесса.
Очевидно, при таких t,
изменение концентрации исходных веществ
незначительно. Поэтому, если ха-рактерное
время задачи много меньше характерного
времени хи-мического процесса, то
допусти-мо использовать модель реакции
нулевого порядка. Это часто ис-пользуется
в теории зажигания.
,
т. е. в начале химического процесса.
Очевидно, при таких t,
изменение концентрации исходных веществ
незначительно. Поэтому, если ха-рактерное
время задачи много меньше характерного
времени хи-мического процесса, то
допусти-мо использовать модель реакции
нулевого порядка. Это часто ис-пользуется
в теории зажигания.
2).если рассматривается
открытая система, и в неё извне поступает
ровно столько исходного вещест-ва,
сколько было израсходовано в химическом
процессе, то концент-рация исходного
вещества остает-ся неизменной,
следовательно, скорость реакции не
будет меня-ться при T=const,
и имеем реак-цию нулевого порядка. Модель
реакции нулевого порядка полу-чается
из уравнения (12). Обоз-начим расход
вещества
![]() ,
причем этот расход мал, т. е.
,
причем этот расход мал, т. е.
![]() ,
тогда
,
тогда
![]() ,
и из (12) получаем:
,
и из (12) получаем:
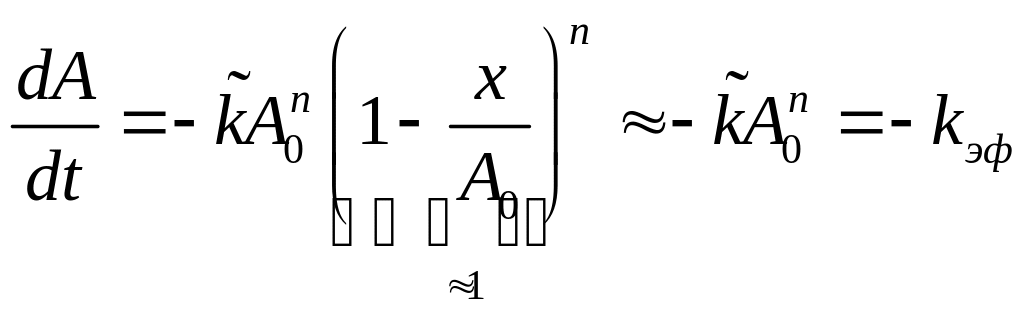
![]() ,
,
,
,![]() (13)(рис9)
(13)(рис9)
![]() – формально.
– формально.
6. Глубина выгорания.
Кине-тическое подобие. При
решении задач химической кинетики
удо-бно ввести безразмерные переме-нные.
Вводится следующая без-размерная
концентрация
![]() ,
η – глубина
превращения,
в ходе химичес-кого процесса 0≤η≤1.
По величине η
удобно следить за ходом процесса (m
– масса вещества A).
,
η – глубина
превращения,
в ходе химичес-кого процесса 0≤η≤1.
По величине η
удобно следить за ходом процесса (m
– масса вещества A).
Уравнение (12), с
использованием η
принимает вид:
![]() .
.
Перейдем к
безразмерному вре-мени: ![]()
![]() ,т.
е. за масш-таб времени взята величина
про-порциональная характерному вре-мени
реакции. Получаем уравне-ние в безразмерном
виде
,т.
е. за масш-таб времени взята величина
про-порциональная характерному вре-мени
реакции. Получаем уравне-ние в безразмерном
виде
![]() уравнение простой реакции n-го
порядка. (14)
уравнение простой реакции n-го
порядка. (14)
![]() – безразмерная
скорость простой реакции n-го
порядка.
– безразмерная
скорость простой реакции n-го
порядка.
Если выразить через
η,
то
![]() (14’)
В безраз-мерном виде скорость определя-ется
только порядком реакции, т. е. говорят,
что все простые реак-ции конкретного
порядка между собой кинетически подобны.
Это подобие определяется порядком
реакции. Поэтому очень удобно описывать
процесс в безразмер-ном виде, так как
решается не одна, а множество кинетически
подобных задач. (рис10). Таким образом,
для всех реакций n-го
порядка, при
(14’)
В безраз-мерном виде скорость определя-ется
только порядком реакции, т. е. говорят,
что все простые реак-ции конкретного
порядка между собой кинетически подобны.
Это подобие определяется порядком
реакции. Поэтому очень удобно описывать
процесс в безразмер-ном виде, так как
решается не одна, а множество кинетически
подобных задач. (рис10). Таким образом,
для всех реакций n-го
порядка, при
![]() ,
в ходе хи-мического процесса, скорость
монотонно уменьшается от 1 до 0. И только
при n=0
(реакция нуле-вого порядка), скорость
реакции неизменна (безразмерная скорость
,
в ходе хи-мического процесса, скорость
монотонно уменьшается от 1 до 0. И только
при n=0
(реакция нуле-вого порядка), скорость
реакции неизменна (безразмерная скорость
![]() ).Если
решить задачу (14), то получим поведение
глубины пре-вращения η(τ)
для кинетически подобных систем.
).Если
решить задачу (14), то получим поведение
глубины пре-вращения η(τ)
для кинетически подобных систем.
![]()
![]()
![]() (рис11).Т.
е. только для реакции нулевого порядка
процесс закан-чивается в конечный момент
вре-мени, для остальных реакций при τ→∞,
кривая асимптотически стремится к 1.
Таким образом, ра-ссмотрели закономерности
прос-той реакции, поведение скорости
простой реакции и кинетических кривых.
С математической точки зрения необходимо
было решать обыкновенные дифференциаль-ные
уравнения, и при решении на-до отмечать:
(рис11).Т.
е. только для реакции нулевого порядка
процесс закан-чивается в конечный момент
вре-мени, для остальных реакций при τ→∞,
кривая асимптотически стремится к 1.
Таким образом, ра-ссмотрели закономерности
прос-той реакции, поведение скорости
простой реакции и кинетических кривых.
С математической точки зрения необходимо
было решать обыкновенные дифференциаль-ные
уравнения, и при решении на-до отмечать:
1).существование решения;
2).единственность решения;
3).устойчивость решения;
4).получающуюся структуру (ре-жим решения); При рассмотрении простых случа-ев таких вопросов не возникало. В более сложных задачах требуются дополнитель-ные исследования.С химической и физической точки зрения, необхо-димо также определять константы скоростей реакции и механизмы химических реакций. Это решает-ся с помощью эксперимента, где выясняется, какие вещества при-сутствуют в ходе химического процесса, определяется механизм реакции по оптимальному усло-вию прохождения процесса. А математическая обработка резуль-татов эксперимента позволяет на-ходить константы скоростей хи-мических реакций.
§6. Системы
кинетических ура-внений химического
процесса, состоящего из нескольких
эле-ментарных стадий.Перейдем
к изучению сложных химических
процессов.Опыт показывает, что лишь в
частных случаях химичес-кий процесс
следует брутто урав-нению. Обычно реакция
выбирает оптимальный путь прохождения,
включающий образование проме-жуточных
продуктов. Это проис-ходит даже в том
случае, когда исходными являются одна
или две частицы. Пример:
реакция присоединения молекулярного
хлора к этилену.
![]() По
данному механизму реакция никогда не
проходит, это энергетически за-прещено.
Если на систему подейс-твовать таким
образом, чтобы произошло разложение
Cl2
на ато-мы, то тогда очень быстро реак-ция
проходит по цепному меха-низму. Таким
воздействием мо-жет быть, например,
освещение системы.1)
По
данному механизму реакция никогда не
проходит, это энергетически за-прещено.
Если на систему подейс-твовать таким
образом, чтобы произошло разложение
Cl2
на ато-мы, то тогда очень быстро реак-ция
проходит по цепному меха-низму. Таким
воздействием мо-жет быть, например,
освещение системы.1)![]() ;
;
2)
![]() ;
;
3)
![]() ;
;
4)
![]() ;
;
5)
![]() ;
;
6)![]() .(точка
означа-ет наличие свободной валент-ности,
hν
– квант света, атомы хлора легко вступают
во взаимо-действие)Получим необходимое
соотношение, если подвести бала-нс,
сложив последовательно все уравнения
(первое уравнение умножив на 7, второе
– на 4, C4H8Cl2
– дополнительный про-дукт, который
можно не учиты-вать ввиду его небольшого
коли-чества). Данный механизм подт-вержден
с помощью эксперимен-тальных данных и
энергетически он наиболее приемлем.
Пример:
реакция окисления водорода:
.(точка
означа-ет наличие свободной валент-ности,
hν
– квант света, атомы хлора легко вступают
во взаимо-действие)Получим необходимое
соотношение, если подвести бала-нс,
сложив последовательно все уравнения
(первое уравнение умножив на 7, второе
– на 4, C4H8Cl2
– дополнительный про-дукт, который
можно не учиты-вать ввиду его небольшого
коли-чества). Данный механизм подт-вержден
с помощью эксперимен-тальных данных и
энергетически он наиболее приемлем.
Пример:
реакция окисления водорода:
![]() включает 60 ста-дий и обладает большим
тепло-вым эффектом.Возникает задача:
определение в случае сложного химического
процесса скорости химической реакции.
Для харак-теристики взаимосвязи между
со-бой отдельных стадий процесса,
вводятся понятия последователь-ных,
параллельных и последова-тельно-параллельных
реакций.
включает 60 ста-дий и обладает большим
тепло-вым эффектом.Возникает задача:
определение в случае сложного химического
процесса скорости химической реакции.
Для харак-теристики взаимосвязи между
со-бой отдельных стадий процесса,
вводятся понятия последователь-ных,
параллельных и последова-тельно-параллельных
реакций.
- Две простые реакции называют-ся последовательными, если продукт одной из них является исходным веществом для другой.
- Две, и более реакции называют-ся параллельными, если исход-ным веществом для них является одно и тоже вещество.
- Реакции называются последова-тельно-параллельными, если по одному веществу они последова-тельные, а по другому параллель-ные. Таким образом, различные стадии химического процесса могут быть между собой трех типов. Реакции (1) и (6) – пос-ледовательные (в любой очеред-ности как по молекулам, так и по атомам).Реакции (2) и (3) – пос-ледовательные как по радикалу, так и по атому хлора.Реакции (2) и (4) – параллельные по атому хлора, и последовательные по ра-дикалу.Реакции (4) и (5) – парал-лельные по радикалу. Скорость простой реакции может быть за-писана согласно закону дейст-вующих масс. Поскольку каждая стадия химического процесса – простая реакция, то, согласно это-му закону, можно выписать ско-рость каждой стадии:
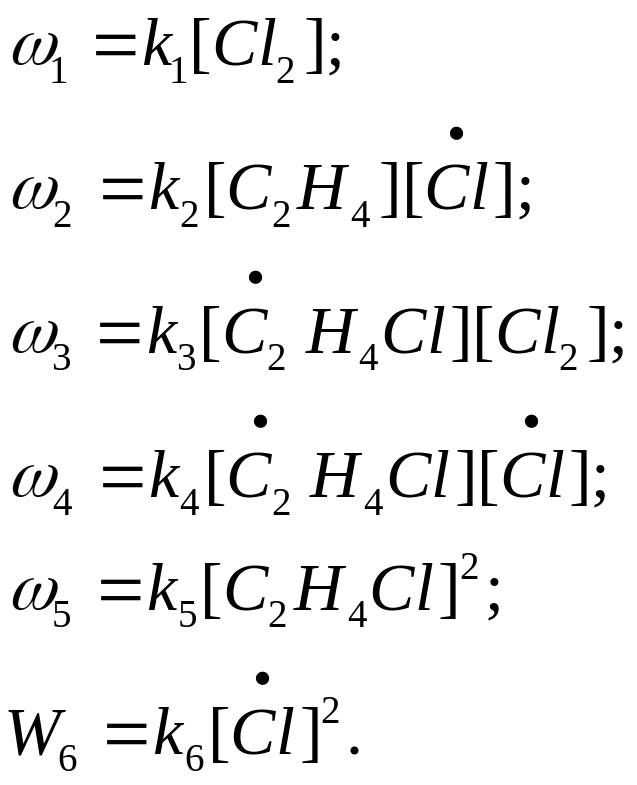
Согласно определению скорость химической реакции определяется по конкретному компоненту. В эксперименте можно следить за скоростью изменения масс отде-льных компонентов. Чтобы по-считать эту скорость через скоро-сти отдельных стадий для конк-ретного компонента, надо учиты-вать все стадии, в которых он уча-ствует с соответствующими сте-хиометрическими коэффициента-ми. Например:Скорость по моле-кулярному хлору Cl2:
![]() .
.![]() Скорость
по этилену:
Скорость
по этилену:
![]()
Скорость по
![]() :
:
![]() В
общем случае, если механизм химической
реакции можно запи-сать в виде:
В
общем случае, если механизм химической
реакции можно запи-сать в виде:![]() ,
i=1…N
, j=1…K,
(K
уравнений)
,
i=1…N
, j=1…K,
(K
уравнений)
N
– количество веществ, участву-ющих в
химическом процессе, включая промежуточные
проду-кты. К – количество стадий
хи-мического процесса.![]() – стехио-метрические коэффициенты,
если это продукт, то “+” ν,
если исхо-дное вещество, то “–“ ν.
– стехио-метрические коэффициенты,
если это продукт, то “+” ν,
если исхо-дное вещество, то “–“ ν.
![]() –символ
соответствующей ча-стицы. Скорость j-ой
стадии
–символ
соответствующей ча-стицы. Скорость j-ой
стадии
![]() ,
скорость по i-му
компоненту (по [Ai])
,
скорость по i-му
компоненту (по [Ai])
![]() :
:
![]() –
сумми-рование всех стадий, где нахо-дится
компонент.
–
сумми-рование всех стадий, где нахо-дится
компонент.
Если вещество не участвует в какой-то стадии, то в общем уравнении ее стехиометрический коэффициент в этой стадии равен нулю.
