
- •§1. Макрокинетическая система.
- •§2. Основные задачи химической кинетики.
- •§3. Скорость химической реакции.
- •§4. Скорость простых химических превращений.
- •5. Реакции нулевого порядка.
- •§7. Последовательные реакции.
- •§8. Параллельные реакции.
- •§11. Кинетические уравнения обратимого химического проце-сса.Пусть имеем простую реак-цию:
- •§13. Колебательные режимы протекания химических реакций.При описании процесса окисления высших углеводородов используется модельная схема. Схема Вольтера:
- •§14. Элементарные понятия теории цепных реакций.
- •4. Стадия разветвления цепей.
- •§16. Окисление водорода при низком давлении, как пример црр.Рассмотрим одну из наибо-лее интересных реакций: окисле-ние водорода. Это высокоэнерге-тическая реакция.
- •§19. Элементы теории соударений.Данная теория была разработана и нашла широкое применение для газофазных реакций.
§4. Скорость простых химических превращений.
Пусть имеется стехиометрии-чес-кое уравнение простой реак-ции: aA+bB+cC+…=pP+qQ+…(1)
A,B,C – символы исходных веще-ств; P,Q – символы продуктов реакции;
a, b, c, p, q – стехиометрические коэффициенты.
В дальнейшем будем использо-вать соответствующие обозначе-ния для концентраций или масс соответствующих компонентов (концентрация А равна А, и т. д.).
Стехиометрическое уравнение по-казывает, в какой пропорции из-меняются массы соответствую-щих компонентов, и т. к. реакция (1) простая, а стехиометрические коэффициенты указывают, в ка-кой пропорции изменяются (рас-ходуются) концентрации соотве-тствующих веществ, то согласно (1) можно составить пропорцию:
![]() (2)
(2)
В (2) символом “0”
обозначены концентрации соответствующих
веществ в начальный момент времени, и
вся реакция проходит при постоянном
объеме, поэтому скорость реакции можно
опре-делить по скорости изменения
концентрации.
![]() – расход (A<A0),
– расход (A<A0),
![]() –
образование (P>P0).
Продифференцируем (2) по времени:
–
образование (P>P0).
Продифференцируем (2) по времени:
![]() (3)
(3)
Согласно определению, для реак-ции при постоянном объеме, бу-дем иметь:
![]() ,
где
,
где
![]() ,
и т. д.Т. е. для
про-стой реакции
скорости по разли-чным веществам связаны
между собой через стехиометрические
коэффициенты. Поэтому, согла-сно равенству
(3), можно ввести понятие скорости
химической реакции ω.
Через эту общую скорость можно определить
ско-рость этой реакции по конкре-тному
веществу, используя соот-ветствующий
стехиометрический коэффициент.
,
и т. д.Т. е. для
про-стой реакции
скорости по разли-чным веществам связаны
между собой через стехиометрические
коэффициенты. Поэтому, согла-сно равенству
(3), можно ввести понятие скорости
химической реакции ω.
Через эту общую скорость можно определить
ско-рость этой реакции по конкре-тному
веществу, используя соот-ветствующий
стехиометрический коэффициент.
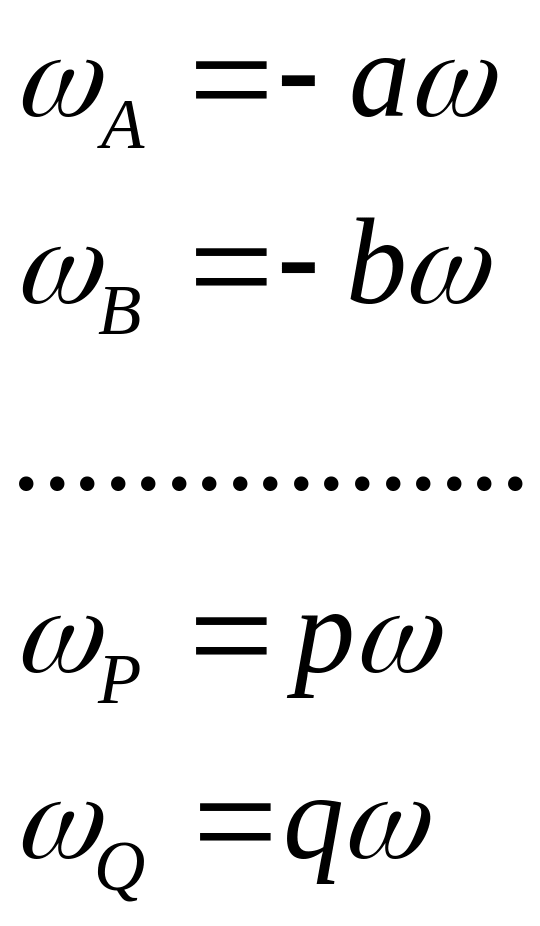 (3’)
(3’)
Исследование,
проведенное Гиль-бертом и Ваге при
T=const,
пока-зало, что скорость простой реак-ции
ω
пропорциональна концент-рациям исходных
веществ, в степени их стехиометрических
ко-эффициентов. ![]() (4)
(4)
Этот закон, называется законом действующих масс, т. е. действуют массы исходных веще-ств. Коэффициент пропорцио-нальности k=k(T).
Позже этот закон получил теоретическое обоснование исхо-дя из вероятностного подхода:
Произведение![]() определяет вероятность встречи молекул
в одной точке пространства.
определяет вероятность встречи молекул
в одной точке пространства.
Использование (3) для опреде-ления скорости по конкретным веществам удобно, поэтому это соотношение стали распрост-ранять и на сложные химические процессы. В этом случае испо-льзуют формальные константы, которые получают из экспе-римента. Скорость таких проце-ссов будет иметь вид:
ω=k(T) φ(A, B,…, P, Q,…) (5)
k(T) – константа скорости хими-ческой реакции, определяет зависимость скорости химической реакции от температуры. Функция φ(A, B,…,P, Q,…) – называется Кинетической функцией. Она определяет зависимость скорости химической реакции от концент-рации веществ, которые в ней участвуют, и данная зависимость может быть различной. Сюда мо-гут входить концентрации исход-ных веществ, продуктов а также промежуточных веществ. Функ-циональная зависимость может быть различной (логарифмиче-ской, дробной, и т. д.).
Данная зависимость
находится из эксперимента, хотя её можно
определить, используя механизм химической
реакции. Для простой реакции кинетическая
функция имеет вид:
![]() .
.
Если из эксперимента получено, что φ зависит еще и от продуктов, и промежуточных веществ, или если степени концентраций исх-одных веществ дробные, то это указывает на сложный механизм химической реакции. При этом, если используют формулу (5), то говорят, что рассматривают формальную кинетику химичес-кого процесса, поскольку это со-ответствует эксперименту, и поз-воляет получать зависимости из-менения масс веществ (кинети-ческие зависимости) с использо-ванием формального подхода:
![]() , где
, где
![]() –
порядки реак-ции по соответствующему
вещес-тву. Общий порядок реакции:
–
порядки реак-ции по соответствующему
вещес-тву. Общий порядок реакции:
![]() .
.
Для газофазных реакций общий порядок показывает степень зави-симости скорости химической реакции от давления:
![]()
![]() ,
,
где
![]() – давление. Подставим в формулу для φ,
получим:
– давление. Подставим в формулу для φ,
получим:
![]() Размерность
скорости химической реакции.
Согласно определению или формуле (3):
Размерность
скорости химической реакции.
Согласно определению или формуле (3):
![]() ,
,![]() Согласно
(5):
Согласно
(5):![]() ,
,
![]() – для степенных законов. Для ко-нстанты
скорости:
– для степенных законов. Для ко-нстанты
скорости:
![]() – для степенной
зависимости.
– для степенной
зависимости.
В частности:
1)если реакция
первого порядка, т. е. n=1,
тогда
![]() ,
,
![]() ;2).если
реакция вто-рого порядка (два исходных
веще-ства),то:
;2).если
реакция вто-рого порядка (два исходных
веще-ства),то:![]() ,
,
![]() ;Таким
образом, имеем:
;Таким
образом, имеем:
- Для описания химических про-цессов, используется скорость хи-мической реакции вида (5), через которую по соотношению (3’) оп-ределяются скорости хим. реак-ции по конкретным веществам.
- Для простых химических реак-ций выполняется закон действую-щих масс (4), в котором кинетиче-ская функция зависит только от произведения концентраций исхо-дных веществ в степенях их сте-хиометрических коэффициентов.
§5. Кинетические закономерно-сти протекания простых химии-ческих реакций в изотермичес-ких условиях. T=const.
Изучим зависимость поведения параметров системы в зависимос-ти от кинетической функции φ. Начнем с простых реакций.
1. Односторонние
реакции 1-го порядка.Рассмотрим
реакцию:
![]() ,тогда
согласно закону действующих масс (4):
,тогда
согласно закону действующих масс (4):![]() ,
,
и можно записать,
как изменяют-ся исходные вещества и
продукты реакции(a=p=1)![]() (1)
(1)![]() (2)Эти
диффе-ренциальные уравнения опреде-ляют
концентрацию вещества A
и продукта P.
Необходимо найти A(t)
и P(t)
(k=const,
так как T=const).
Для решения уравнения (1) и (2), и получения
однозна-чного ответа, необходимы
началь-ные условия (так как ДУ 1-го
по-рядка, то для двух уравнений не-обходимо
задать два начальных условия):
(2)Эти
диффе-ренциальные уравнения опреде-ляют
концентрацию вещества A
и продукта P.
Необходимо найти A(t)
и P(t)
(k=const,
так как T=const).
Для решения уравнения (1) и (2), и получения
однозна-чного ответа, необходимы
началь-ные условия (так как ДУ 1-го
по-рядка, то для двух уравнений не-обходимо
задать два начальных условия):
Из системы (1), (2) можно получить первый интеграл:
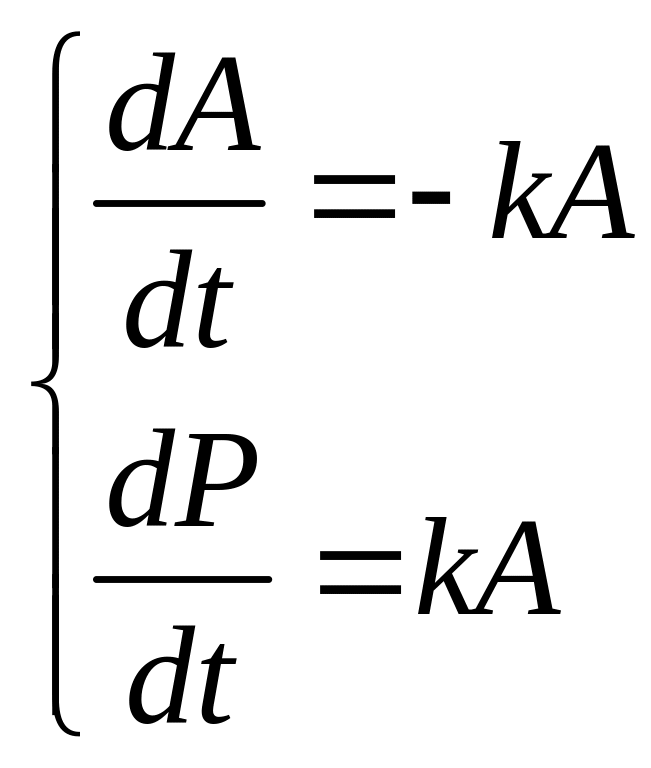 Складывая
эти два ура-внения, получим
Складывая
эти два ура-внения, получим
![]() .
.
![]() ,(3)
,(3)![]() .(3’)
.(3’)
(3), либо (3’) – первый интеграл системы (1), (2), он выражает закон сохранения массы вещества в системе.Чтобы найти A(t), надо решить (1), разделяя переменные, получим:
![]()
![]()
Из начальных условий
![]() ,
тогда
,
тогда![]() (4)
(4)
– кинетическая кривая (зависи-мость) исходного вещества.
По закону (4)
изменяется кон-центрация исходного
вещества в случае реакции 1-го порядка.Если
(4) подставить в (3’), то получим кинетическую
зависимость для продуктаP:![]() .
(рис4) Т. о., процесс закончится лишь при
t=∞
(все вещество
перейдет в продукт). Поскольку
чувствитель-ность измерительных приборов
ограничена, то они наблюдают окончание
процесса раньше. Од-нако это время не
может служить временем окончания
процесса, т. к. оно будет зависеть от
прибора.
.
(рис4) Т. о., процесс закончится лишь при
t=∞
(все вещество
перейдет в продукт). Поскольку
чувствитель-ность измерительных приборов
ограничена, то они наблюдают окончание
процесса раньше. Од-нако это время не
может служить временем окончания
процесса, т. к. оно будет зависеть от
прибора.
Для описания процессов необхо-димо характерное время прохож-дения процесса. Поскольку в описании t=∞, то в качестве хара-ктерного времени часто использу-ется среднее время жизни хи-мического процесса: это время, в течение которого концентрация исходного вещества уменьшилась в e раз. Тогда из (4) имеем:
![]() ,следовательно
,следовательно
![]() ,(5)т.
е. среднее время жизни зависит от
константы ско-рости. Также в качестве
характер-ного времени используется
время
полураспада (полупревращени-я):
это время, в течение которого концентрация
исходного вещест-ва уменьшилась в два
раза. Согла-сно (4):
,(5)т.
е. среднее время жизни зависит от
константы ско-рости. Также в качестве
характер-ного времени используется
время
полураспада (полупревращени-я):
это время, в течение которого концентрация
исходного вещест-ва уменьшилась в два
раза. Согла-сно (4):
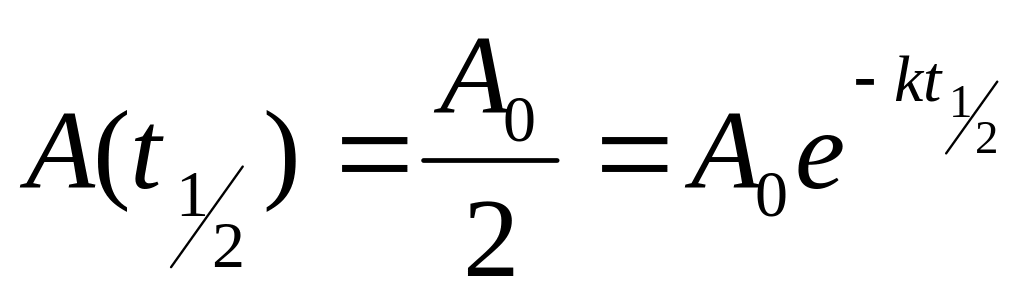 ,
,![]() ,
,
следовательно![]() .(6)
.(6)
ln2≈0,693.Времена
(5) и (6) близ-ки между собой, поэтому любое
из них можно использовать в кА-честве
характерного времени.Из (5) и (6) следует
характерная осо-бенность реакции первого
поряд-ка: характерные времена –
полуп-ревращения или среднее время
жизни зависят только от констан-ты
химической реакции и не зави-сят от
начальной концентрации исходного
вещества. Таким обра-зом, для этих
процессов важно знать k.
Её часто определяют из эксперимента, с
помощью получе-ния экспериментальной
кинети-ческой кривой A(t).
Результаты эксперимента обрабатываются
в координатах![]() .Согласно
(4) для простой реакции1-го по-рядка должно
быть
.Согласно
(4) для простой реакции1-го по-рядка должно
быть
![]() (4’).График
(4’): (рис5 tg=k
где α
угол наклона прямой, построенной по
эксперименталь-но полученным точкам
по методу наименьших квадратов. Пример
реакции 1-го порядка:
реакция
распада гексафенилэтана на два свободных
радикала трифенил-метана
(4’).График
(4’): (рис5 tg=k
где α
угол наклона прямой, построенной по
эксперименталь-но полученным точкам
по методу наименьших квадратов. Пример
реакции 1-го порядка:
реакция
распада гексафенилэтана на два свободных
радикала трифенил-метана![]()
2. Простые реакции
2-го поряд-ка.![]() Дифференциальные
кинетические уравнения:
Дифференциальные
кинетические уравнения:
![]() (1)
(1)![]() (2)
(2)![]() (3)Начальные
условия
(3)Начальные
условия
![]() ,
,
![]() ,
,
![]() .
.
Вычтем (2) из (1):
![]()
![]() ,
где
,
где![]() ,
,![]() (4)
– 1-й интеграл.
(4)
– 1-й интеграл.
Сложим(1)и(3):![]() (5)
(5)
– 2-ой интеграл.
То есть, концентрацию
продукта можно будет определить, когда
будет известна A(t).В
(1) заменим B
через А
используя (4), получим:
![]() (6)
(6)![]() ,
,
Разложив на простые
дроби полу-чим![]() .Интегрируем
.Интегрируем![]() Из
началь-ных условий
Из
началь-ных условий
![]() ,
получаем:
,
получаем: ![]() (7)
(7)
Из (7), с учетом (4) можно найти A(t), которая представляет кине-тическую кривую для исходного вещества A.
Рассмотрим частный случай ε=0.
С математической
точки зрения решение будет иметь
качественно другой вид (7), который можно
найти, используя правило Лапи-таля. С
химической точки зрения этот случай
интересен тем что
![]() ,
это означает, что:
,
это означает, что:
1).Либо два одинаковых
вещества вступают в химическое
взаимоде-йствие, с образованием продукта,
как например, в случае термичес-кого
разложения йодистого водо-рода:
![]() .
.
2).Либо в реакцию
вступают два различных вещества, но
началь-ные концентрации у них равны:
![]() .
При t=0
.
При t=0
![]() –
начальные концент-рации. Рассмотрим
последний случай, тогда (6) принимает
вид:
–
начальные концент-рации. Рассмотрим
последний случай, тогда (6) принимает
вид:
![]() ,
,![]() ,
,![]() ,
,
с учетом начальных
условий
![]() ,
тогда
,
тогда![]() , (8’)
, (8’)
![]() (8)-кинетическая
кри-вая. Так как B=A,
то для В
будем иметь эту же кривую.(рис6).В это-м
случае также требуется харак-терное
время реакции, т. к. мате-матически
процесс заканчивается лишь при t=∞.
В качестве харак-терного времени
используется ли-бо среднее время жизни
реакции, либо время полупревращения.
Определим
(8)-кинетическая
кри-вая. Так как B=A,
то для В
будем иметь эту же кривую.(рис6).В это-м
случае также требуется харак-терное
время реакции, т. к. мате-матически
процесс заканчивается лишь при t=∞.
В качестве харак-терного времени
используется ли-бо среднее время жизни
реакции, либо время полупревращения.
Определим
![]() из (8):
из (8):
![]()
![]() (9)
(9)
Из (9) следует, что в случае реакции 2-го порядка характерное время зависит не только от k, но и от начальной концентрации A0.
Используя кинетическую
кривую (8) можно находить константу
скорости с помощью эксперимен-тальных
данных. Для этого испо-льзуется (8’), и
результаты экспе-римента обрабатываются
в коор-динатах ![]() (рис7).tg=k,
где
α – угол
наклона прямой, постро-енной по методу
наименьших ква-дратов с использованием
получе-нных экспериментально точек.
(рис7).tg=k,
где
α – угол
наклона прямой, постро-енной по методу
наименьших ква-дратов с использованием
получе-нных экспериментально точек.
Другой предельный случай ε>>A.
Это означает, что
![]()
![]() .
То есть вещество B
на-ходится в системе в избытке. В этом
случае уравнение (6) можно преобразовать
.
То есть вещество B
на-ходится в системе в избытке. В этом
случае уравнение (6) можно преобразовать
![]() :
:
![]() ,
т. к.
,
т. к.
![]() .Тогда
формально мо-жно рассматривать уравнение:
.Тогда
формально мо-жно рассматривать уравнение:
![]() ,т.
е. получили урав-нение, как для случая
реакции 1-го порядка. Говорят, имеет
место формальное понижение по-рядка
реакции. Формализм: поря-док реакции
определяет степень зависимости от
давления. Для ре-акции 1-го порядка
,т.
е. получили урав-нение, как для случая
реакции 1-го порядка. Говорят, имеет
место формальное понижение по-рядка
реакции. Формализм: поря-док реакции
определяет степень зависимости от
давления. Для ре-акции 1-го порядка
![]() ,
для 2-го
,
для 2-го
![]() .ЗдесьA~P
и
.ЗдесьA~P
и
![]() .По
размерности kэф
соответствует константе скорости k.
.По
размерности kэф
соответствует константе скорости k.
3. Реакции 3-го
порядка
![]() .Запишем
кинети-ческие дифференциальные урав-нения
только для вещества A:
.Запишем
кинети-ческие дифференциальные урав-нения
только для вещества A:
![]() ,
если
,
если
![]() ;
;
![]() ,
если
,
если
![]() ;
;
![]() ,
если
,
если
![]() .
.
Аналогично для
других веществ. Поскольку для таких
систем также будут иметь место первые
интегралы, то решение будет оп-ределять
дифференциальное урав-нение для A.
Рассмотрим случай, когда
.
В этом случае смесь называется
эквимолеку-лярной.
![]() домножим на -2, и с учетом начальных
условий:
домножим на -2, и с учетом начальных
условий:
![]() ,получаем:
,получаем:![]() (10)Кинетическая
кривая (10) также будет предста-влять
монотонно-падающую кри-вую, которая при
t→∞
асимпто-тически стремится к 0(рис8).
(10)Кинетическая
кривая (10) также будет предста-влять
монотонно-падающую кри-вую, которая при
t→∞
асимпто-тически стремится к 0(рис8).
Характерное время
реакции мож-но определить по времени
полуп-ревращения:![]() (11)Зависимость
от начальной концентрации усилилась.
Аналогично выражает-ся среднее время
жизни. И также как и в случае реакции
2-го поря-дка константу скорости можно
получить экспериментально, об-работав
результаты эксперимента в координатах
(11)Зависимость
от начальной концентрации усилилась.
Аналогично выражает-ся среднее время
жизни. И также как и в случае реакции
2-го поря-дка константу скорости можно
получить экспериментально, об-работав
результаты эксперимента в координатах
![]() .
Классичес-ким примером простой реакции
3-го порядка является реакция:
.
Классичес-ким примером простой реакции
3-го порядка является реакция:
![]() –газофазная
реак-ция ( проходит при высокой
тем-пературе).
–газофазная
реак-ция ( проходит при высокой
тем-пературе).
![]() Чаще
по меха-низму реакции 3-го порядка
про-текают реакции между атомами и
свободными радикалами.Простые реакции
4-го, 5-го, и более высо-кого порядка
маловероятны. Там чаще реализуется
сложный меха-низм, с образованием
промежуто-чных продуктов.Реакция первого
порядка называется мономоле-кулярной.
Реакция второго поря-дка –
бимолекулярной.Реакция
третьего порядка – тримолекуля-рной.
В случае реакции третьего порядка также
возможно форма-льное понижение порядка
реак-ции до второго, а затем до перво-го.
Чаще
по меха-низму реакции 3-го порядка
про-текают реакции между атомами и
свободными радикалами.Простые реакции
4-го, 5-го, и более высо-кого порядка
маловероятны. Там чаще реализуется
сложный меха-низм, с образованием
промежуто-чных продуктов.Реакция первого
порядка называется мономоле-кулярной.
Реакция второго поря-дка –
бимолекулярной.Реакция
третьего порядка – тримолекуля-рной.
В случае реакции третьего порядка также
возможно форма-льное понижение порядка
реак-ции до второго, а затем до перво-го.
4. Обобщение на
реакцию n-го
порядка.Если
реакция протекает по схеме:![]() ,(n
веществ A
образуют продукт P)
, то уравне-ние для концентрации вещества
A
имеетвид
,(n
веществ A
образуют продукт P)
, то уравне-ние для концентрации вещества
A
имеетвид![]() (12)
(12)
Формально имеем реакцию n-го порядка. Получим кинетическую кривую
![]() ,
,
![]() ,
(n>1).
,
(n>1).
При n=1:
![]() .
.
При:-n>1:
![]() .
.
Таким образом, при
любом n≥1
кинетическая кривая монотонно падает,
асимптотически стремясь к 0. Наклон
кривой зависит от порядка реакции.
Характерное время реакции – время
полупрев-ращения:![]() ,
,
С ростом n порядка реакции, степень зависимости характерно-го времени от начальной концен-трации, возрастает.
