
- •§1. Макрокинетическая система.
- •§2. Основные задачи химической кинетики.
- •§3. Скорость химической реакции.
- •§4. Скорость простых химических превращений.
- •5. Реакции нулевого порядка.
- •§7. Последовательные реакции.
- •§8. Параллельные реакции.
- •§11. Кинетические уравнения обратимого химического проце-сса.Пусть имеем простую реак-цию:
- •§13. Колебательные режимы протекания химических реакций.При описании процесса окисления высших углеводородов используется модельная схема. Схема Вольтера:
- •§14. Элементарные понятия теории цепных реакций.
- •4. Стадия разветвления цепей.
- •§16. Окисление водорода при низком давлении, как пример црр.Рассмотрим одну из наибо-лее интересных реакций: окисле-ние водорода. Это высокоэнерге-тическая реакция.
- •§19. Элементы теории соударений.Данная теория была разработана и нашла широкое применение для газофазных реакций.
§19. Элементы теории соударений.Данная теория была разработана и нашла широкое применение для газофазных реакций.
Рассмотрим случай бимоле-кулярной реакции. Согласно тео-рии соударений химическое взаи-модействие происходит каждый раз, если сталкиваются молекулы нужного сорта и при этом они об-ладают энергией достаточной для преодоления потенциального бар-ьера реакции. Кроме того, они до-лжны быть ориентированны друг относительно дуга(рис41)нужным образом. При рассмотрении соу-дарения молекул считается, что они имеют форму сферы.Если ст-алкиваются молекулы А и В, то сферы будут иметь радиус rA и rB, соответственно. Расстояние меж-ду их центрами будет равно rА+rВ. Отсюда можно заключить, что столкновение молекулы А с моле-кулой В произойдет, если центр молекулы В столкнется с кругом, площадь которого будет равна
S=π(rА+rВ),
а центр этого круга бу-дет лежать в
центре молекулы А.
Таким образом, можно сделать за-ключение
о том, что В
обяза-тельно столкнётся с А,
если она
будет
находиться в цилиндричес-кой трубе
радиуса R=rА+rВ,
а ось этой трубы проходит через центр
молекулы А
в направлении
![]() ,
где
-
скорость относительного дви-жения
молекул В
и А.(рис42)
,
где
-
скорость относительного дви-жения
молекул В
и А.(рис42)
Сечение данной трубы называется сечением соударения, поскольку по нему можно судить о факторе соударения. Его обозначают
![]() Это
сечение можно найти через вязкость
газа. Соглас-но МКТГ вязкость:
Это
сечение можно найти через вязкость
газа. Соглас-но МКТГ вязкость:![]() ,
,
где М
– молярная масса газа, u
– скорость движения молекул этого газа,
![]() -
сечение соударения этого газа,
-
сечение соударения этого газа,
![]() -
число Авогадро. Отсюда можно найти
радиус молекул газа:
-
число Авогадро. Отсюда можно найти
радиус молекул газа:
![]() .
Тогда сечение соударения:
.
Тогда сечение соударения:
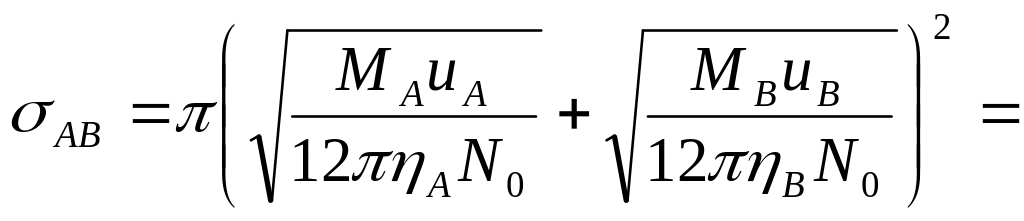
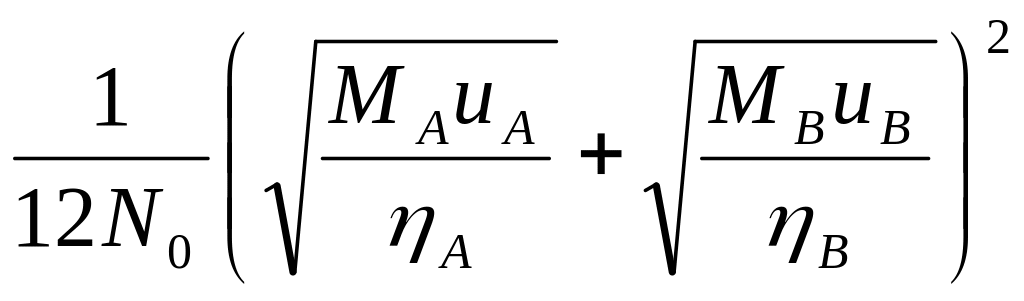 В
теку-щий момент времени соударение
произойдет, если молекула В
бу-дет находиться в указанной
цили-ндрической трубе, причем на
ра-сстоянии u
от сечения соударен-ия, проведенного
через центр мо-лекулы А.Т.о.
можно посчитать объем трубы, молекулы
которой столкнутся с молекулой А.
С мо-лекулой А
столкнутся в текущий момент времени
все молекулы со-рта В,
которые будут находиться в этой трубе
на расстоянии u
от ука-занного сечения соударения.
Чис-ло соударений:
В
теку-щий момент времени соударение
произойдет, если молекула В
бу-дет находиться в указанной
цили-ндрической трубе, причем на
ра-сстоянии u
от сечения соударен-ия, проведенного
через центр мо-лекулы А.Т.о.
можно посчитать объем трубы, молекулы
которой столкнутся с молекулой А.
С мо-лекулой А
столкнутся в текущий момент времени
все молекулы со-рта В,
которые будут находиться в этой трубе
на расстоянии u
от ука-занного сечения соударения.
Чис-ло соударений:![]() ,где
,где
![]() -
концентрация молекул В.Тогда,
согласно КТГ можно оценить ско-рость
теплового движения:
-
концентрация молекул В.Тогда,
согласно КТГ можно оценить ско-рость
теплового движения:
![]() ,k
– постоянная Больц-мана (переводит
температуру в энергию).
,k
– постоянная Больц-мана (переводит
температуру в энергию).
![]() -
приведенная масса молекул. Общее число
соударен-ий будет определяться числом
со-ударений всех молекул А
с молек-улами В
в текущую единицу вре-мени. Чтобы получить
это число, достаточно знать, сколько в
един-ице объема будет молекул A.
-
приведенная масса молекул. Общее число
соударен-ий будет определяться числом
со-ударений всех молекул А
с молек-улами В
в текущую единицу вре-мени. Чтобы получить
это число, достаточно знать, сколько в
един-ице объема будет молекул A.
![]() -
ко-личество соударений в единице объема
молекул сорта А
с моле-кулами сорта В.
-
ко-личество соударений в единице объема
молекул сорта А
с моле-кулами сорта В.
![]() - фактор соударения (определяется через
характеристики среды u,
σ).
Сог-ласно теории соударений, не все
соударения приведут к химичес-кому
процессу, а только те, кото-рые обладают
нужной энергией для преодоления
потенциального барьера реакции. Если
энергия со-ударения меньше нужной
энергии (
- фактор соударения (определяется через
характеристики среды u,
σ).
Сог-ласно теории соударений, не все
соударения приведут к химичес-кому
процессу, а только те, кото-рые обладают
нужной энергией для преодоления
потенциального барьера реакции. Если
энергия со-ударения меньше нужной
энергии (![]() ),
то соударение счита-ется упругим, и эти
сферы-молек-улы потом разлетаются
(энергия деформации уходит в кинетическ-ую
энергию).Если энергия соуда-рения больше
или равна нужной энергии (
),
то соударение счита-ется упругим, и эти
сферы-молек-улы потом разлетаются
(энергия деформации уходит в кинетическ-ую
энергию).Если энергия соуда-рения больше
или равна нужной энергии (![]() ),
то соударение считается неупругим, и
происхо-дит химическое взаимодействие.В
теории соударений энергия соуда-рения
определяется по кинетичес-кой энергии:
),
то соударение считается неупругим, и
происхо-дит химическое взаимодействие.В
теории соударений энергия соуда-рения
определяется по кинетичес-кой энергии:![]() .
.![]() -
потен-циальный барьер.Чтобы опреде-лить
количество эффективных со-ударений,
ведущих к химическо-му процессу,
воспользуемся расп-ределением Больцмана
по энер-гиям:
-
потен-циальный барьер.Чтобы опреде-лить
количество эффективных со-ударений,
ведущих к химическо-му процессу,
воспользуемся расп-ределением Больцмана
по энер-гиям: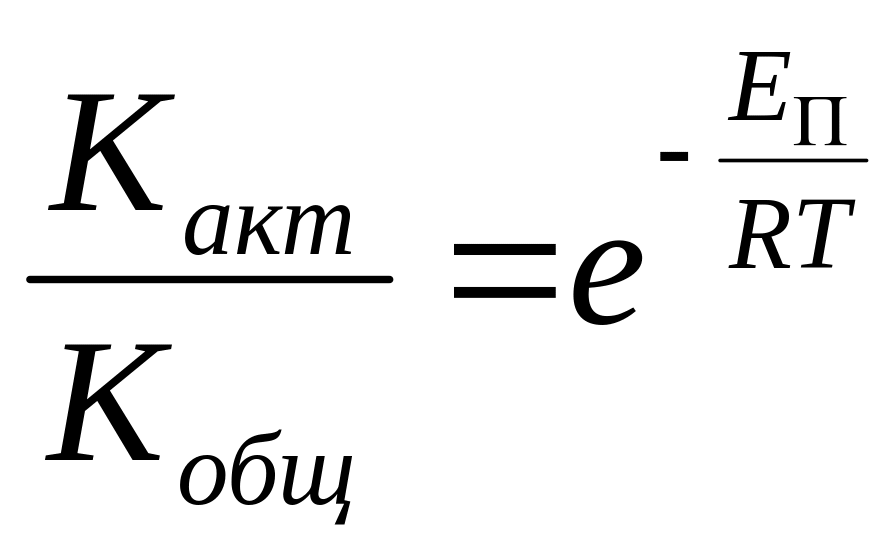 .Тогда
скорость химического процесса:
.Тогда
скорость химического процесса:
![]() ,
,
![]() .
.
R
– универсальная газовая постоя-нная.
Как было отмечено, в Тео-рии соударений
учитывается, как ориентированы молекулы
друг от-носиельно друга. Соударение
мо-жет быть нужной энергии и нуж-ных
молекул, но если при этом они неправильно
ориентированы друг относительно друга,
то взаи-модействия не произойдет. Это
стерический
фактор,
вводится он через сомножитель p,
0<p<1.
Тогда
![]() (1)
Сог-ласно закону действующих масс,
скорость химической реакции:
(1)
Сог-ласно закону действующих масс,
скорость химической реакции:
![]() .Сравнивая
с полученой формулой (1), можно записать
выражение для константы ско-рости:
.Сравнивая
с полученой формулой (1), можно записать
выражение для константы ско-рости:
![]() (2)–
константа скорости для бимо-лекулярных
газофазных реакций.
(2)–
константа скорости для бимо-лекулярных
газофазных реакций.
![]() - предэкспонента.
- предэкспонента.
Можно провести
оценку величин, входящих в (1) и (2). Из
(1):
.Обычно
радиус молекулы
![]() ,
,
![]() ,
,
![]() ,
тогда
,
тогда
![]() - довольна маленькая величина.
- довольна маленькая величина.
Из теории соударений:
![]() .
Тем самым отраже-но влияние температуры.
Хара-ктер влияния температуры рас-смотрим
на примерах.
.
Тем самым отраже-но влияние температуры.
Хара-ктер влияния температуры рас-смотрим
на примерах.
1. Взаимодействие водорода с йодом Это газофазная бимолеку-лярная реакция.
![]() .
.
По закону действующих масс
![]() .
.
Согласно (2) (при н. у.) величина
![]()
![]() большая энергия
акти-вации. Посчитаем время, за кото-рое
система прореагирует на 1%. При давлении
1 атм:
большая энергия
акти-вации. Посчитаем время, за кото-рое
система прореагирует на 1%. При давлении
1 атм:
![]() ,
тогда
,
тогда
![]() ,(3)
с точно-стью до константы. Влияние
температуры:
,(3)
с точно-стью до константы. Влияние
температуры:
1). Т=273°К
(0°С). По формуле (3)
![]() ,
,
1%![]() =1,35∙1017
шт/см3
,
=1,35∙1017
шт/см3
,
![]()
2). Т=600°К,
![]() ,
,
![]()
3). Т=800°К,
![]() ,
,
![]()
2. Взаимодействие атомов водорода Неактивированный про-цесс, сопровождается большим выходом энергии.
![]()
При давление 1 атм:
![]() ,
тогда
,
тогда
![]()
Из (2) определим k. Экспоненту не пишем, т.к. энергия активации мала. В данном случае достато-чно, чтобы частицы просто встре-тились. Посчитаем, за какое время система прореагирует на 99%. Для этого нужно решить уравне-ние:
![]() .
.
Разделяя переменные и интегри-руя, получаем
![]() ,
,
![]() .
.
Приведем к общему знаменателю и подставим выражение для концентрации:
![]() ,
тогда
,
тогда
![]()
![]()
Управлять таким процессом сло-жно. Температура при активиро-ванном процессе влияет сущест-венным образом (пример 1), при чем основное влияние оказывает экспонента.
§20. Феноменологическая теория температурной зависи-мости константы скорости хи-мической реакции.Константа скорости химической реакции очень сильно зависит от Т, по крайней мере, для активирова-нных процессов. Опыт показы-вает, что для большинства хими-ческих реакций скорость реакции сильно зависит от Т. В связи с этим влияние Т на скорость реак-ции ω изучалось давно (с конца XIXв.) Вант-Гоффом, Аррениу-сом и другими западно-европейс-кими физико-химиками. Вант-Гофф предложил правило:
Увеличение Т на 10% приводит к увеличению ω в 10 раз. Измене-ние скорости химической реакции определяли по температурному коэффициенту, зависящему от k:
![]() .(1)
.(1)
![]() в неши-роком интервале температур не
зависел от температуры, он при-нимался
постоянным. Это опреде-ление было очень
грубым.
в неши-роком интервале температур не
зависел от температуры, он при-нимался
постоянным. Это опреде-ление было очень
грубым.
В 1889г. Аррениусом была пре-дложена формула, которая опре-деляла зависимость k от T:
![]() (2)-
формула
Арре-ниуса.
Она была получена на основе обработки
эксперимента-льных данных 6 авторов, и
рабо-тала лучше предложенных дру-гими
авторами. A,
EA
– константы Аррениуса (определяются
из эксперимента). Если использовать (2)
при описании скорости химии-ческого
процесса, то она дает хо-рошее согласие
с экспериментом. Позже формула получила
обосно-вание в самых различных теориях.
(2)-
формула
Арре-ниуса.
Она была получена на основе обработки
эксперимента-льных данных 6 авторов, и
рабо-тала лучше предложенных дру-гими
авторами. A,
EA
– константы Аррениуса (определяются
из эксперимента). Если использовать (2)
при описании скорости химии-ческого
процесса, то она дает хо-рошее согласие
с экспериментом. Позже формула получила
обосно-вание в самых различных теориях.
A,
EA
можно найти, если обрабо-тать результаты
эксперимента в координатах:![]() .Из
(2):
.Из
(2):
![]() (2’)
(рис43)
(2’)
(рис43)
Точки спрямляются согласно (2’).
![]() .
.
![]() действительно будут константами, но в
опреде-ленном интервале температур.
Поэтому при их определении сле-дует
указать интервал Т:
действительно будут константами, но в
опреде-ленном интервале температур.
Поэтому при их определении сле-дует
указать интервал Т:
![]() .
В таком случае по-лучается модифицированный
за-кон Аррениуса:
.
В таком случае по-лучается модифицированный
за-кон Аррениуса:
![]() ,
,
![]() .
m
требуется определять дополнительно.
.
m
требуется определять дополнительно.
Температурная чувствите-льность константы скорости химической реакции.
Если будем определять про-центное изменение k при изме-нении Т, то из (2) получим:
![]() ,
,
отсюда
![]() .Если
Т
изменяется на 1%, т.е.
.Если
Т
изменяется на 1%, т.е.![]() ,
то
,
то
![]() .Эта
безразмерная величина определяет
чувствии-тельность скорости химической
реакции к изменению температу-ры.
.Эта
безразмерная величина определяет
чувствии-тельность скорости химической
реакции к изменению температу-ры.
![]() ,
,
![]() ,
,
![]() .
.
Чем больше Е и чем меньше T, тем больше чувствительность.
Эта величина большая для акти-вированных процессов.Посчитаем температурный коэффициент согласно закону Аррениуса:
![]() .Если
.Если
![]() мало:
мало:![]() ,
,
![]() ,
то можно воспользоваться разло-жением
экспоненты (ex=1+x+…).
,
то можно воспользоваться разло-жением
экспоненты (ex=1+x+…).
![]() .
.
И если ΔT
изменится на
![]() ,
то скорость химической реакции в этом
интервале изменится в е
раз. Последняя величина называется
семеновским
интервалом.
,
то скорость химической реакции в этом
интервале изменится в е
раз. Последняя величина называется
семеновским
интервалом.
