
- •Билет №1
- •1. Конденсационные методы получения лиофобных дисперсных систем.
- •2. Особенности адсорбции ионов и молекул из растворов на твердой поверхности.
- •3. Реология
- •4. Сравните давление насыщенного пара над одинаковыми по размерам каплями воды и пропилового спирта.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - ВеСl2, в - nh4oh, с - Be(oh)2
- •Билет 2
- •1. Диспергационные методы получения лиофобных дисперсных систем.
- •2. Межфазная поверхность, ее силовое поле. Поверхностное натяжение как характеристика этого поля
- •3. Что Вы знаете о структурообразовании в дисперсных системах и типах дисперсных структур?
- •4. Сравните давление насыщенного пара над каплями эквиконцентрированных водных растворов уксусной и масляной кислот (радиусы капель одинаковы). Ответ обоснуйте.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А: k2CrO4, b: AgNo3, c: Ag2CrO4
- •1. Седиментационный анализ суспензий и эмульсий.
- •2. Поверхностная активность. Экспериментальное определение, изменение в гомологических рядах, работа адсорбции.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na2 SiO3, в - hCl, с - h2SiO3
- •Билет 4
- •1. Смачивание и растекание:
- •2 Метод избыточных величин Гиббса и метод слоя конечной толщины
- •3. Дайте определение поверхностной активности и поясните выражение «понятие поверхностной активности относительно». Как экспериментально оценить поверхностную активность?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А (NaCl), в (kh2SbO4), с (NaH2SbO4).
- •Билет 5
- •1. Седиментационный анализ в центробежном поле как метод оценки размеров коллоидных частиц и макромолекул полимеров.
- •2. Адсорбция и ее характеристики. Теории полимолекулярной адсорбции.
- •3. Что такое аэрозоли? Чем обусловлены их специфические свойства и как их разрушают?
- •4. С каким коллоидно-химическим явлением в организме человека связано чувство жажды? Охарактеризуйте это явление и его особенности в коллоидных системах по сравнению с истинными растворами.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 6
- •1. Диффузия и ее особенности в коллоидных системах. Уравнение Эйнштейна.
- •2. Лиофильные коллоидные системы. Условия образования и свойства.
- •3. Изобразите изотермы поверхностного натяжения водных растворов метиламина и пропиламина и покажите, как от них можно перейти к изотермам адсорбции. Изобразите изотермы адсорбции этих веществ.
- •4. Как различаются осмотические давления апельсинового сока а) с мякотью, б) без мякоти. Ответ обоснуйте
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А – CaCl2, в - h2so4, с - CaSo4
- •Билет 7
- •1. Изотерма адсорбции Лэнгмюра.
- •2. Устойчивость дисперсных систем. Основы теории длфо.
- •3. Приведите на одном рисунке изотермы поверхностного натяжения пив и пав а)немицеллообразующего , б) мицеллообразующего, в) ионогенного немицеллообразующего.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 8.
- •1. Уравнение адсорбции Гиббса и его естественно-научное и философское значение.
- •2. Диффузионно-седиментационное равновесие и его использование для анализа д исперсных систем.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - k3(Fe(cn)6), в - AgNo3, с - Ag3(Fe(cn)6)
- •6. Изобразите графически изменение ζ-потенциала для золя MnO2 (стабилизатор Na2s2o3) при добавлении к нему электролитов NaCl, AgNo3, kMnO4, Na2s2o3 .
- •Билет 9.
- •1. Зависимость поверхностного натяжения от концентрации пав. Уравнение Шишковского, физический смысл его констант и методы их определения.
- •2. Образование и строение двойного электрического слоя на границе раздела фаз.
- •3. Что Вы знаете о критических эмульсиях и микроэмульсиях?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из рас - творов веществ а и в в случае избытка вещества а или в. А - k2so4, в - Ba(ch3coo)2, с - BaSo4
- •Билет 10.
- •2. Уравнение двухмерного состояния вещества в адсорбционном слое. Основные типы поверхностных пленок.
- •3. Как можно определить важнейшие характеристики молекул пав: площадь поперечного сечения и длину?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na 2SiO3, в - AgNo3, с - Ag2SiO3
2. Адсорбция и ее характеристики. Теории полимолекулярной адсорбции.
Адсорбция – самопроизвольное перераспределение компонентов между поверхностным слоем и объемной фазой.
Физическая адсорбция обусловлена действием физических сил притяжения – различными типами ван-дер-ваальсового взаимодействия. Обратима, является экзотермическим процессом (протекающим с выделением теплоты).
Химическая адсорбция (хемосорбция) происходит за счет образования химических связей между молекулами (ионами, атомами) адсорбата и адсорбента. Хемосорбция обычно необратима.
Поглощающее (адсорбирующее) вещество называют адсорбентом, а поглощающееся (адсорбирующееся) – адсорбатом.
Для количественной характеристики адсорбции используются две величины:
1.удельная
(гиббсовская) адсорбция Гi:
![]() ,
где ni
– количество вещества в реальной
системе;
,
где ni
– количество вещества в реальной
системе;
![]() – в фазе I,
– в фазе I,
![]() – в фазе II
идеальной системы, s
– площадь межфазной поверхности.
– в фазе II
идеальной системы, s
– площадь межфазной поверхности.
Т. е.
гиббсовская
адсорбция – это
избыток вещества в межфазном поверхностном
слое, приходящийся на единицу площади
поверхности по сравнению с количеством
вещества в таком же объеме фазы.
![]() ,
где
– толщина поверхностного слоя,
,
где
– толщина поверхностного слоя,
![]() [кг/м2],
либо [моль/кг],
либо [кг/кг].
[кг/м2],
либо [моль/кг],
либо [кг/кг].
2.полная
адсорбция аi
. Полная
адсорбция –
количество вещества в поверхностном
слое толщиной δ
в расчете на единицу поверхности или
массы адсорбента:
![]()
Между
Гi
и аi
существует
взаимосвязь:
![]() , аi
всегда больше
0
, аi
всегда больше
0
Гi может быть больше и меньше 0.
При адсорбции в условиях Т ‹ Ткр имеет место конденсация, и мономолекулярный слой не компенсирует поверхностную энергию образуется несколько адсорбционных слоев (полимолекулярная адсорбция).
Полимолекулярная адсорбция реализуется в двух случаях:

Для первого случая была предложена потенциальная теория адсорбции Поляни, которая дает термодинамическое описание процесса адсорбции.
Теория Поляни
Основные постулаты:
![]() все
адсорбированное вещество находится в
конденсированном состоянии;
все
адсорбированное вещество находится в
конденсированном состоянии;
адсорбат у поверхности адсорбента образует адсорбционный объем V.
![]() ,
,
где Vm – молярный объем адсорбата в конденсированном состоянии.
У поверхности действует поле адсорбционных сил, интенсивность которых уменьшается с расстоянием. Для характеристики интенсивности поля введен адсорбционный потенциал ε.
Физический смысл ε – это изотермическая работа по переносу 1 моль пара адсорбата из достаточно удаленного от поверхности объема в адсорбционный объем.или это изотермическая работа по сжатию адсорбата от давления р до давления насыщения рs.
![]() ,
,
где рs – давление насыщенного пара адсорбата в отсутствие адсорбента;
р – равновесное давление, т.е. давление пара адсорбата в присутствии адсорбента.
К аждой
точке изотермы адсорбции соответствуют
определенные значения а
и р/рs,
которые позволяют получить значения V
и ε,
т. е. найти зависимость адсорбционного
потенциала от объема адсорбата на
адсорбенте – потенциальную
кривую адсорбции.
аждой
точке изотермы адсорбции соответствуют
определенные значения а
и р/рs,
которые позволяют получить значения V
и ε,
т. е. найти зависимость адсорбционного
потенциала от объема адсорбата на
адсорбенте – потенциальную
кривую адсорбции.
![]()
- потенциальная характеристическая кривая данного адсорбента
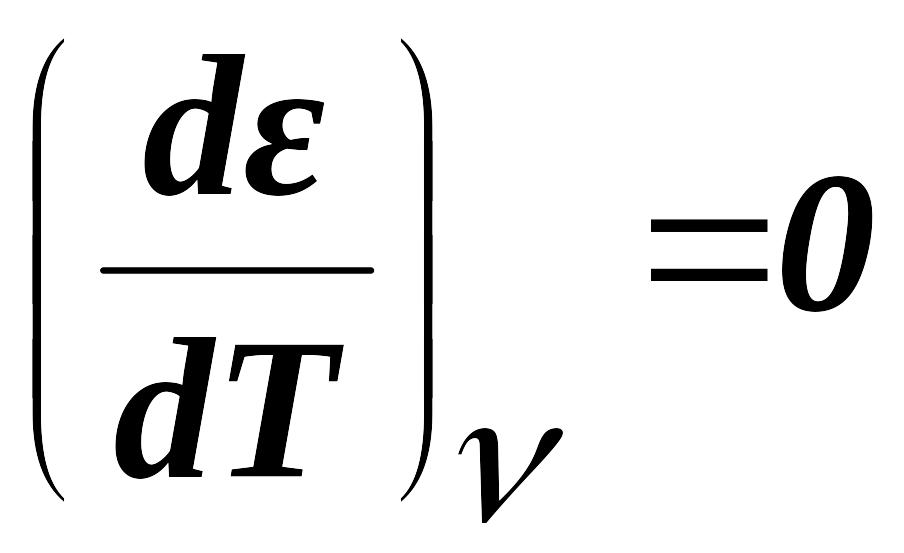 ,
т. е. адсорбционный потенциал от
температуры не зависит.
,
т. е. адсорбционный потенциал от
температуры не зависит.
Для
данного адсорбента и адсорбата, зная
изотерму адсорбции при данной температуре
Т1,
можно рассчитать изотерму для другой
температуры Т2.![]() .
.
Рассчитаем
а2
и р2
для другой температуры:
 ,
,
![]()


Важная
особенность потенциальных кривых была
обнаружена Дубининым. Она заключается
в том, что характеристические кривые
для одного и того же объема адсорбента
и разных адсорбатов при всех значениях
объемов адсорбата в поверхностном слое
находятся в постоянном отношении β:
 ,где
β
– коэффициент аффинности, ε
– адсорбционный потенциал для одного
адсорбата, εо
– для другого.
,где
β
– коэффициент аффинности, ε
– адсорбционный потенциал для одного
адсорбата, εо
– для другого.
Для данного адсорбента, имея β и зная изотерму адсорбции, можно рассчитать изотерму любого другого адсорбата на данном адсорбенте.
Эта теория не дает уравнения изотермы адсорбции, только термодинамическое описание.
Для второго случая используют теорию БЭТ (теория Брунауэра, Эммета и Теллера).
Теория
БЭТ. Согласно этой теории каждый
адсорбционный центр sх
связывает несколько молекул адсорбента
Х,
образуя цепочки:
![]()
Уравнение, описывающее адсорбцию, выглядит следующим образом:
![]() ,
где
,
где
 ;
Кр
– константа адсорбции; КL
– константа конденсации.
;
Кр
– константа адсорбции; КL
– константа конденсации.
Д ля
нахождения констант этого уравнения
на основании экспериментальных данных
строят график:
ля
нахождения констант этого уравнения
на основании экспериментальных данных
строят график:
![]()
Это уравнение работает только в интервале
 ,
в котором предполагается отсутствие
взаимодействия между цепочками
адсорбированных молекул.
,
в котором предполагается отсутствие
взаимодействия между цепочками
адсорбированных молекул.
При
![]() – большая степень заполнения, возникают
боковые взаимодействия между молекулами.
– большая степень заполнения, возникают
боковые взаимодействия между молекулами.
При
![]() – малая степень заполнения, на величину
адсорбции сильно влияют энергетические
неоднородности поверхности.
– малая степень заполнения, на величину
адсорбции сильно влияют энергетические
неоднородности поверхности.
теория имеет практическое значение, т. к. можно определить удельную поверхность адсорбента.
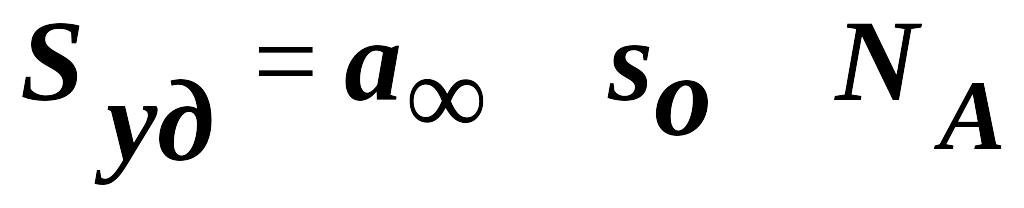 ,
где sо
– площадь, занимаемая молекулой
адсорбата.
,
где sо
– площадь, занимаемая молекулой
адсорбата.
Величина а∞ зависит от энергетической равноценности поверхности и наличия пор.
Для
характеристики адсорбента используется
понятие «пористость»
П:

