
- •Билет №1
- •1. Конденсационные методы получения лиофобных дисперсных систем.
- •2. Особенности адсорбции ионов и молекул из растворов на твердой поверхности.
- •3. Реология
- •4. Сравните давление насыщенного пара над одинаковыми по размерам каплями воды и пропилового спирта.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - ВеСl2, в - nh4oh, с - Be(oh)2
- •Билет 2
- •1. Диспергационные методы получения лиофобных дисперсных систем.
- •2. Межфазная поверхность, ее силовое поле. Поверхностное натяжение как характеристика этого поля
- •3. Что Вы знаете о структурообразовании в дисперсных системах и типах дисперсных структур?
- •4. Сравните давление насыщенного пара над каплями эквиконцентрированных водных растворов уксусной и масляной кислот (радиусы капель одинаковы). Ответ обоснуйте.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А: k2CrO4, b: AgNo3, c: Ag2CrO4
- •1. Седиментационный анализ суспензий и эмульсий.
- •2. Поверхностная активность. Экспериментальное определение, изменение в гомологических рядах, работа адсорбции.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na2 SiO3, в - hCl, с - h2SiO3
- •Билет 4
- •1. Смачивание и растекание:
- •2 Метод избыточных величин Гиббса и метод слоя конечной толщины
- •3. Дайте определение поверхностной активности и поясните выражение «понятие поверхностной активности относительно». Как экспериментально оценить поверхностную активность?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А (NaCl), в (kh2SbO4), с (NaH2SbO4).
- •Билет 5
- •1. Седиментационный анализ в центробежном поле как метод оценки размеров коллоидных частиц и макромолекул полимеров.
- •2. Адсорбция и ее характеристики. Теории полимолекулярной адсорбции.
- •3. Что такое аэрозоли? Чем обусловлены их специфические свойства и как их разрушают?
- •4. С каким коллоидно-химическим явлением в организме человека связано чувство жажды? Охарактеризуйте это явление и его особенности в коллоидных системах по сравнению с истинными растворами.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 6
- •1. Диффузия и ее особенности в коллоидных системах. Уравнение Эйнштейна.
- •2. Лиофильные коллоидные системы. Условия образования и свойства.
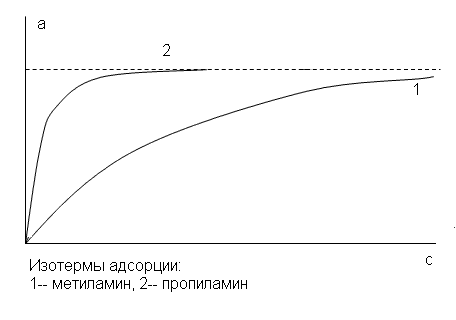
- •3. Изобразите изотермы поверхностного натяжения водных растворов метиламина и пропиламина и покажите, как от них можно перейти к изотермам адсорбции. Изобразите изотермы адсорбции этих веществ.
- •4. Как различаются осмотические давления апельсинового сока а) с мякотью, б) без мякоти. Ответ обоснуйте
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А – CaCl2, в - h2so4, с - CaSo4
- •Билет 7
- •1. Изотерма адсорбции Лэнгмюра.
- •2. Устойчивость дисперсных систем. Основы теории длфо.
- •3. Приведите на одном рисунке изотермы поверхностного натяжения пив и пав а)немицеллообразующего , б) мицеллообразующего, в) ионогенного немицеллообразующего.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 8.
- •1. Уравнение адсорбции Гиббса и его естественно-научное и философское значение.
- •2. Диффузионно-седиментационное равновесие и его использование для анализа д исперсных систем.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - k3(Fe(cn)6), в - AgNo3, с - Ag3(Fe(cn)6)
- •6. Изобразите графически изменение ζ-потенциала для золя MnO2 (стабилизатор Na2s2o3) при добавлении к нему электролитов NaCl, AgNo3, kMnO4, Na2s2o3 .
- •Билет 9.
- •1. Зависимость поверхностного натяжения от концентрации пав. Уравнение Шишковского, физический смысл его констант и методы их определения.
- •2. Образование и строение двойного электрического слоя на границе раздела фаз.
- •3. Что Вы знаете о критических эмульсиях и микроэмульсиях?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из рас - творов веществ а и в в случае избытка вещества а или в. А - k2so4, в - Ba(ch3coo)2, с - BaSo4
- •Билет 10.
- •2. Уравнение двухмерного состояния вещества в адсорбционном слое. Основные типы поверхностных пленок.
- •3. Как можно определить важнейшие характеристики молекул пав: площадь поперечного сечения и длину?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na 2SiO3, в - AgNo3, с - Ag2SiO3
3. Изобразите изотермы поверхностного натяжения водных растворов метиламина и пропиламина и покажите, как от них можно перейти к изотермам адсорбции. Изобразите изотермы адсорбции этих веществ.
П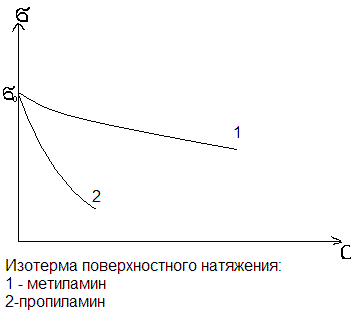 равило
Дюкло-Траубе:
равило
Дюкло-Траубе:
В гомологическом ряду нормальных жирных кислот, спиртов, аминов и т.д., поверхностная активность по отношению к воде резко возрастает на каждую группу СН2.
Количественной
мерой поверхностной активности служит
величина g:
![]() )p,T
)p,T
Адсорбция – это изменение концентрации компонента в поверхностном слое по сравнению с объёмной фазой, отнесённое к единице площади поверхности; самопроизвольное перераспределение компонентов системы между повехностным слоем и объёмной фазой.
Уравнение,
связывающее адсорбцию с изменением
поверхностного натяжения: ![]()
a- адсорбция, с – концентр растворённого вещества.
4. Как различаются осмотические давления апельсинового сока а) с мякотью, б) без мякоти. Ответ обоснуйте
Если считать концентрацию дисперсной фазы в соке с мякотью и без мякоти одинаковой, то осмотическое давление с мякотью будет меньше, чем без мякоти.
![]() ,где
с – молярность раствора, моль/м3,
П – осмотическое давление.
,где
с – молярность раствора, моль/м3,
П – осмотическое давление.
Для
коллоидных систем можно записать:
![]() .
.
Частичная
или численная концентрация – это число
отдельных частиц в единице объема
дисперсной системы:![]() .
где V0
– общий объем дисперсной системы, Nч
– число частиц дисперсной фазы.
.
где V0
– общий объем дисперсной системы, Nч
– число частиц дисперсной фазы.
Связь с массой и размерами частиц такова:
т. к.
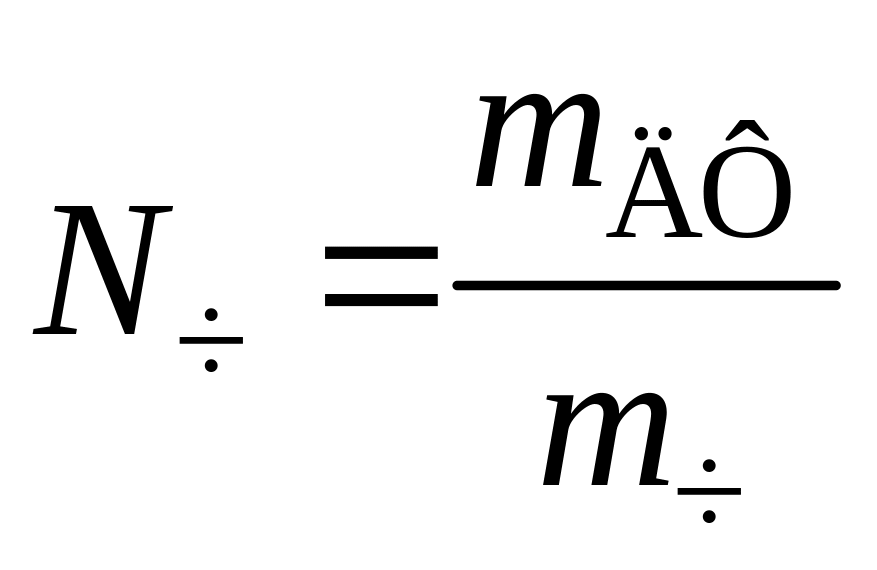 ,
то
,
то
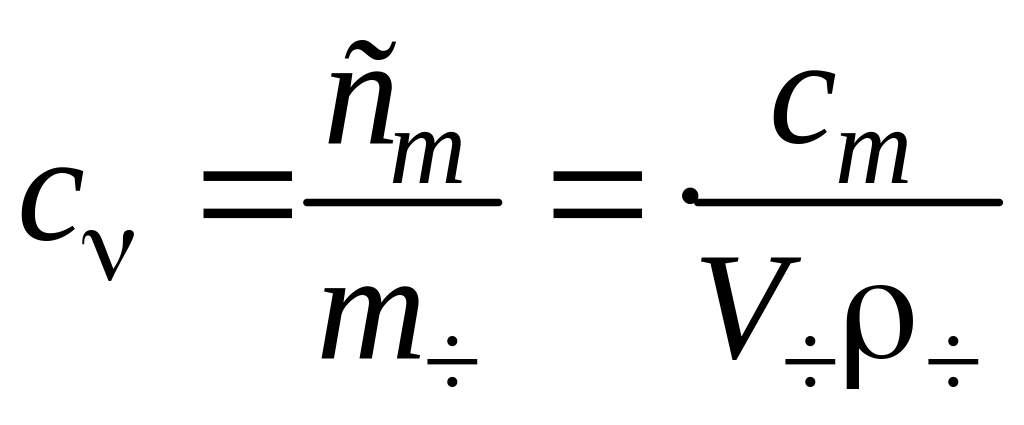 ,
где mДФ
и mч
– это масса всех частиц дисперсной фазы
и одной частицы соответственно. Таким
образом, при одной и той же массовой
доле частичная концентрация тем меньше,
чем крупнее частицы.
,
где mДФ
и mч
– это масса всех частиц дисперсной фазы
и одной частицы соответственно. Таким
образом, при одной и той же массовой
доле частичная концентрация тем меньше,
чем крупнее частицы.
Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор).
5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А – CaCl2, в - h2so4, с - CaSo4
Реакция: CaCl2+ H2SO4 = CaSO4 + 2HCl
В первом случае(избыток А): {m[CaSO4]nCa2+2(n-x)Cl-}2x+2xCl-
В избытке B: {m[CaSO4]nSO42-2(n-x)H+}2x-2xH+
6. Пороги коагуляции золя Cu(OH)2 для электролитов Na2SO4 и BaCl2 соответственно равны 0.04 и 0.004 моль/л . Определите заряд колоидной частицы и запишите структурную формулу мицеллы гидрозоля. Изобразите графически как изменится ζ-потенциал при добавлении к такому гидрозолю NaOH.
Мицелла гидрозоля: {m[Cu(OH)2]nOH-(n-x)H+}x-xH+
Порог коагуляции однозарядного иона (порог 1) и двухзарядного иона (порог 2 ) в соответствии с эмпирическим правилом Шульце – Гарди должны приблизительно соотноситься: порог1 : порог2 = 500 : 25 = 20 : 1. Пороги коагуляции Na2SO4 и BaCl2 соотносятся 0,04 : 0,004 = 10 : 1. Следовательно, в соединении Na2SO4 коагуляцию вызывает однозарядный ион (Na+), в соединении BaCl2 – двузарядный ион (Ba2+). Значит коагуляция вызывается катионами, а заряд коллоидной частицы имеет отрицательный знак.
Билет 7
1. Изотерма адсорбции Лэнгмюра.
В области высоких концентраций закон Генри не соблюдается, но можно использовать уравнение Ленгмюра (изотерму адсорбции Лэнгмюра):
![]()
где а∞ – предельная адсорбция (адсорбция при предельном заполнении поверхности монослоем), к – константа, с – общая концентрация ПАВ в растворе.
Вывод данного уравнения основан на описании адсорбции формальным химическим уравнением:
![]()
где Х – молекула ПАВ в объемной фазе; sХ – свободный участок поверхности; ХsХ – «комплекс» молекулы с соответствующим участком поверхности.
Динамическое равновесие, устанавливающееся между поверхностным слоем и объемной фазой в отношении растворенного вещества характеризуется константой адсорбции:
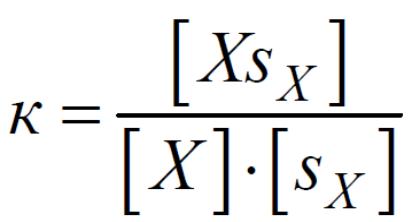
Величина адсорбции равна:
![]()
где Y – степень насыщения поверхности веществом Х (доля участков sХ, занятых веществом). Получаем:

Чтобы перейти к уравнению Ленгмюра, надо заменить [Х ] на с (общую концентрацию ПАВ в растворе):
 Принцип
независимости поверхностного действия:
в гомологических рядах различных ПАВ
(спиртов, аминов, кислот и др.) предельное
значение адсорбции для всех членов
одинаково, т. е. не зависят от длины
углеводородного радикала. При предельном
заполнении поверхностного слоя возможен
только один вариант расположения молекул
– частокол Ленгмюра.
Принцип
независимости поверхностного действия:
в гомологических рядах различных ПАВ
(спиртов, аминов, кислот и др.) предельное
значение адсорбции для всех членов
одинаково, т. е. не зависят от длины
углеводородного радикала. При предельном
заполнении поверхностного слоя возможен
только один вариант расположения молекул
– частокол Ленгмюра.
а∞ и к можно найти графически:
Преобразуем уравнение Ленгмюра к такому виду:
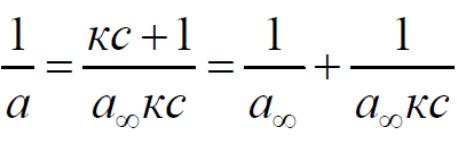
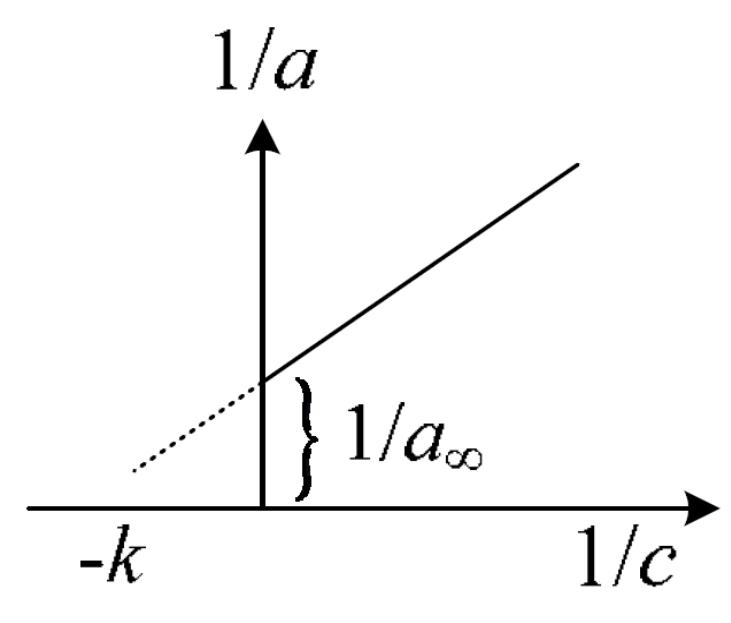
/с = −к.
