
- •1. Физические основы механики, молекулярной физики и
- •Предисловие
- •Общие методические указания
- •Понятие о физической картине мира
- •Контрольные вопросы по физике, ч. 1.
- •Контрольные вопросы по физике, ч. 2.
- •Методические рекомендации при изучении курса общей физики Физические основы классической механики
- •Элементы специальной теории относительности
- •Основы молекулярной физики и термодинамики
- •Электростатика
- •Постоянный электрический ток
- •Электромагнетизм
- •Колебания и волны
- •Волновая оптика
- •Квантовая природа излучения
- •Элементы атомной физики и квантовой механики
- •Элементы физики атомного ядра и элементарных частиц
- •Учебные материалы по разделам курса физики
- •1. Физические основы механики, молекулярной физики и термодинамики
- •Кинематика
- •Динамика материальной точки и поступательное движение твёрдого тела
- •Работа и энергия
- •Механика твёрдого тела
- •Тяготение. Элементы теории поля.
- •Элементы механики жидкостей
- •Элементы специальной (частной) теории относительности
- •Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Реальные газы, жидкости и твердые тела
- •Примеры решения задач
- •Контрольная работа №1
- •2. Основы электродинамики
- •Электрическое поле в вакууме и веществе
- •Постоянный электрический ток
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитные свойства вещества
- •Контрольная работа №2
- •3. Колебания. Волны. Оптика
- •Механические и электромагнитные колебания
- •Упругие волны
- •Электромагнитные волны
- •Оптика квантовая природа излучения Элементы геометрической оптики
- •Интерференция света
- •Дифракция света
- •Взаимодействие электромагнитных волн с веществом
- •Поляризация света
- •Квантовая природа излучения
- •Примеры решения задач
- •Контрольная работа № 3
- •4. Элементы атомной и ядерной физики и физики твёрдого тела
- •Теория атома водорода по Бору
- •Элементы квантовой механики
- •Элементы физики атомов и молекул
- •Контрольная работа № 4 (номер темы выбирается по последней цифре зачётной книжке)
- •1. Строение атома
- •2. Атомное ядро
- •3. Элементарные частицы
- •4. Радиоактивность
- •5. Атом на службе человека
- •6. Лазеры и их применение
- •7. Aдроны
- •9. Квантовые эффекты в ядерной физике
- •Приложения
- •1. Основные физические постоянные
- •2. Некоторые астрономические величины
- •3. Плотности веществ
- •4. Эффективный диаметр молекулы газов
- •5. Удельная теплота плавления
- •6. Удельная теплота парообразования
- •Удельное электрическое сопротивление проводников
- •Диэлектрическая проницаемость веществ
- •Показатель преломления
- •Интервалы длин волн, соответствующие различным цветам спектра
- •Подвижности некоторых положительных газовых ионов
- •Работа выхода электронов из металла Авых, эВ
- •Формулы для приближенных вычислений
- •Десятичные приставки к названиям единиц
- •Некоторые числа
- •Буквы греческого алфавита
- •Литература
Молекулярно-кинетическая теория идеальных газов
●Закон Бойля-Мариотта
![]() при
при
![]() ,
,
где p – давление; V – объем; Т – термодинамическая температура; m – масса газа.
● Закон Гей-Люссака и закон Шарля
![]() ,
или
,
или
 при
при
![]() ;
;
![]() ,
или
,
или
 при
при
![]() ,
,
где t
– температура по шкале Цельсия;
![]() и
и
![]() - соответственно объем и давление при
00
С; коэффициент
- соответственно объем и давление при
00
С; коэффициент
![]() ;
индексы 1 и 2 относятся к произвольным
состояниям.
;
индексы 1 и 2 относятся к произвольным
состояниям.
● Закон Дальтона для давления смеси n идеальных газов
 ,
,
где
![]() - парциальное давление i
– го компонента смеси.
- парциальное давление i
– го компонента смеси.
● Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
 ,
,
где
![]() – газовая постоянная, μ – молярная
масса газа.
– газовая постоянная, μ – молярная
масса газа.
● Зависимость давления газа от концентрации n молекул и температуры Т
![]() ,
,
где
![]() – постоянная Больцмана ( k=R/Na
,
– постоянная Больцмана ( k=R/Na
,
![]() –
постоянная Авогадро).
–
постоянная Авогадро).
● Основное уравнение молекулярно-кинетической теории идеальных газов
![]() ,
,
или
 ,
,
или
![]() ,
,
где
![]() -
средняя квадратичная скорость молекул;
Е- суммарная кинетическая энергия
поступательного движения всех молекул
газа; n-
концентрация молекул;
-
средняя квадратичная скорость молекул;
Е- суммарная кинетическая энергия
поступательного движения всех молекул
газа; n-
концентрация молекул;
![]() -
масса одной молекулы;
-
масса одной молекулы;
![]() -
масса газа; N-
число молекул в объеме газа V.
-
масса газа; N-
число молекул в объеме газа V.
● Скорость молекул:
наиболее вероятная
 ;
;
средняя квадратичная
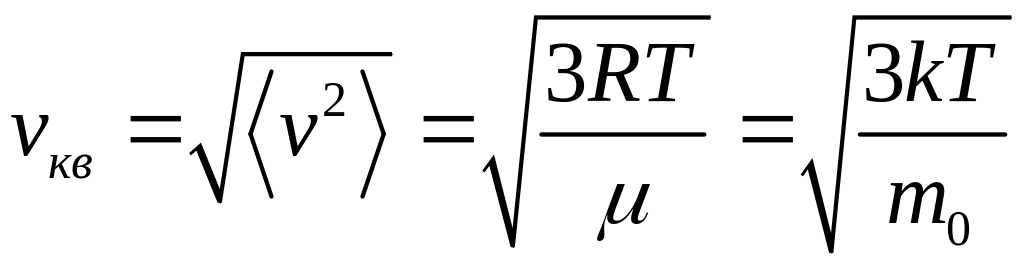 ;
;
средняя арифметическая
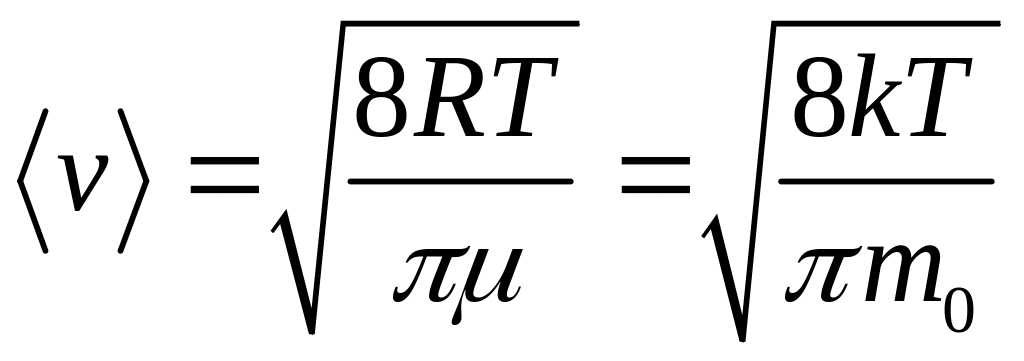 .
.
● Средняя кинетическая энергия поступательного движения молекулы идеального газа
![]() .
.
● Закон Максвелла для распределения молекул идеального газа по скоростям
 ,
,
где функция
![]() (
)
распределения молекул по скоростям
определяет относительное число молекул
(
)
распределения молекул по скоростям
определяет относительное число молекул
![]() из общего числа N
молекул, скорости которых лежат в
интервале от
до
из общего числа N
молекул, скорости которых лежат в
интервале от
до
![]() .
.
● Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
 ,
,
где функция f(ε)
распределения молекул по энергиям
теплового движения определяет
относительное число молекул
![]() из общего числа N
молекул, которые имеют кинетические
энергии
из общего числа N
молекул, которые имеют кинетические
энергии
![]() ,
заключенные в интервале от ε до ε+dε.
,
заключенные в интервале от ε до ε+dε.
● Барометрическая формула
![]() ,
,
где
![]() и
–
давление газа на высоте h
и h0.
и
–
давление газа на высоте h
и h0.
● Распределение Больцмана во внешнем потенциальном поле
![]() ,
,
где n и n0 – концентрация молекул на высоте h и h0 .
● Среднее число соударений, испытываемых молекулой газа за 1 секунду,
![]() ,
,
где d –эффективный диаметр молекулы; n – концентрация молекул; - средняя арифметическая скорость молекул.
● Средняя длина свободного пробега молекул газа
 .
.
● закон теплопроводности Фурье
![]() ,
,
где Q
теплота, прошедшая посредством
теплопроводности через площадь S
за время t;
![]() -
градиент температуры; λ- теплопроводность:
-
градиент температуры; λ- теплопроводность:
![]() ,
,
где сv – удельная теплоемкость газа при постоянном объеме; ρ- плотность газа.
● Закон диффузии Фика
![]() ,
,
где М – масса
вещества, переносимая посредством
диффузии через площадь S
за время t;
![]() -
градиент плотности, D
– диффузия:
-
градиент плотности, D
– диффузия:
![]() .
.
● Закон Ньютона для внутреннего трения (вязкости)
![]() ,
,
где F – сила внутреннего трения между движущимися слоями площадью S;
![]() -
градиент скорости; η – динамическая
вязкость:
-
градиент скорости; η – динамическая
вязкость:
![]() .
.
Основы термодинамики
● Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы,
![]() .
.
● Средняя энергия молекулы
![]() ,
,
где
![]() -
число степеней свободы.
-
число степеней свободы.
● Внутренняя энергия газа
 ,
,
где
![]() – количества вещества; m
– масса газа; μ – молярная масса газа.
– количества вещества; m
– масса газа; μ – молярная масса газа.
● Первое начало термодинамики
![]() ,
,
где Q
– количество теплоты, сообщенное системе
или отданное ею;
![]() -
изменение её внутренней энергии; А –
работа системы против внешних сил.
-
изменение её внутренней энергии; А –
работа системы против внешних сил.
● Первое начало термодинамики для малого изменения системы
![]() .
.
● Молярные теплоемкости газа при постоянном объеме и постоянном давлении
![]() ,
,
![]() .
.
● Уравнение Р. Майера, для 1 моля идеального газа
![]() .
.
● Изменение внутренней энергии идеального газа
 .
.
● Работа, совершаемая газом при изменении его объема,
![]() .
.
● Полная работа при изменении объема газа
 ,
,
где V1 и V2 – соответственно начальный и конечный объемы газа.
● Работа газа:
при изобарном процессе
![]() ,
или
,
или
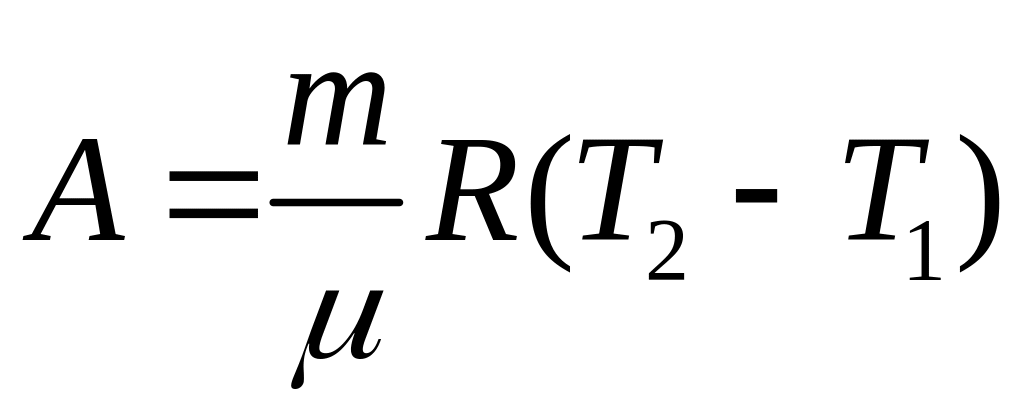 ;
;
при изотермическом процессе
 ,
или
,
или
 .
.
● Уравнение адиабатического процесса (уравнение Пуассона)
![]()
где
 - показатель адиабаты.
- показатель адиабаты.
● Работа в случае адиабатического процесса
 или
или
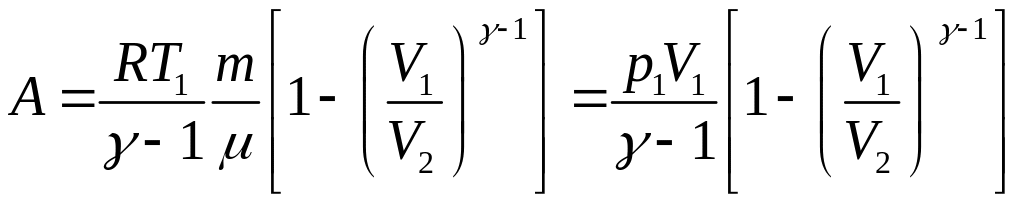 ,
,
где T1 , T2 и V1, V2 – соответственно начальные и конечные температура и объем газа.
● Термический коэффициент полезного действия для кругового процесса (цикла)
 ,
,
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
● Термический коэффициент полезного действия цикла Карно
 ,
,
где T1 – температура нагревателя; T2 – температура холодильника.
● Изменение энтропии при равновесном переходе из состояния 1 в состояние 2, в переменных Р V
 .
.
