- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Лабораторна робота
- •Визначення температурного коефіцієнту та енергії активації розкладу
- •Тіосульфатної кислоти
- •Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
- •76018, М. Івано-Франківськ, вул. Галицька, 2.
Характерні особливості каталізаторів
Каталізатори мають ряд загальних характерних особливостей:
1. Каталізатор не впливає на загальну стехіометрію реакції, він бере хімічну участь у процесі, витрачається на одній стадії і регенерується на іншій.
2. Каталізатор зменшує енергію активації реакції, завдяки чому збільшується її швидкість
k = A ∙e–Ea/(RT).
3. Каталізатор не впливає на константу рівноваги, він тільки скорочує час досягнення рівноваги, однаково збільшуючи швидкість прямої та зворотної реакцій
K = kпр/kзв.
4. Для всіх каталізаторів характерні такі загальні властивості, як специфічність і селективність дії.
Специфічність каталізатора полягає в його здатності прискорювати лише одну реакцію або групу однотипних реакцій і не впливати на швидкість інших реакцій.
Селективність каталізатора – здатність прискорювати лише одну з можливих за даних умов паралельних реакцій. Завдяки цьому стало можливим, використовуючи різні каталізатори, з одних й тих самих вихідних речовин одержувати різні продукти:
[Cu]: CO + Н2 СНзОН [Аl2О3]: С2Н5ОН С2Н4 + Н2О,
[Ni]: CO + Н2 СН4 + Н2О [Сu]: С2Н5ОН СН3СНО + Н2.
|
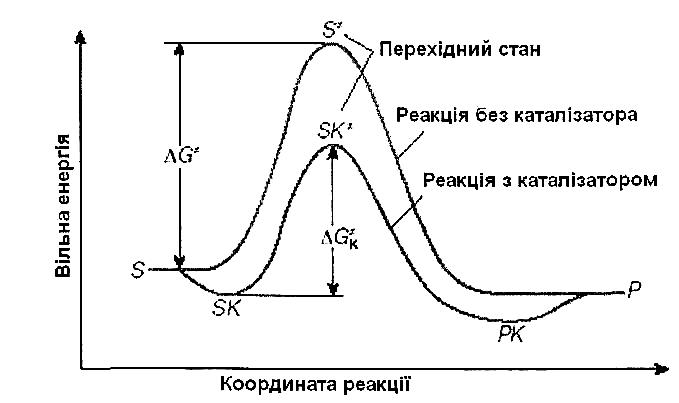
Рис. Енергетична діаграма хімічної реакції без каталізатора і в присутності каталізатора |
Швидкість хімічної реакції при певній температурі визначається швидкістю утворення активованого комплексу, яка, в свою чергу, залежить від величини енергії активації. У багатьох хімічних реакціях в структуру активованого комплексу можуть входити речовини, які стехіометрично не є реагентами; вочевидь, у цьому випадку змінюється і величина енергії активації процесу. При наявності декількох перехідних станів реакція буде йти переважно по шляху з найменшим активаційним бар'єром. Розрізняють позитивний і негативний каталіз (відповідно збільшення або зменшення швидкості реакції), хоча часто під терміном "каталіз" мають на увазі лише позитивний каталіз; негативний каталіз називають інгібуванням.
Причиною збільшення швидкості реакції при позитивному каталізі є зменшення енергії активації при протіканні реакції через активований комплекс з участю каталізатора (рис).
За рівнянням Арреніуса константа швидкості хімічної реакції знаходиться в експоненційній залежності від величини енергії активації, зменшення останньої веде до значного збільшення константи швидкості. Зменшення енергії активації всього на 50 кДж/моль веде до збільшення швидкості реакції в 27∙105 раз (насправді, внаслідок низки побічних ефектів, таке зменшення енергії активації прискорює реакцію «всього» в 105 раз).
Гомогенний каталіз
У цьому випадку і реагенти і каталізатор утворюють одну фазу. При цьому каталізатор утворює з реагентами проміжні реакційноздатні продукти. Розглянемо деяку реакцію:
А +В С.
Без каталізатора вона проходить в одну стадію, причому процес внаслідок великої енергії активації відбувається повільно. У присутності каталізатора відбуваються дві стадії, в результаті яких утворюються частинки проміжної сполуки АК (швидка стадія) і потім кінцевий продукт реакції з регенерацією каталізатора (повільна стадія):
А + К ↔ АК, АК + В С + К.
Енергетичні бар'єри, які треба подолати на кожній з цих стадій, значно менші, ніж для некаталітичного процесу, тому вони відбуваються з більшою швидкістю, ніж некаталітична реакція. Прикладом такого процесу може бути реакція розкладення ацетальдегіду, енергія активації якої ЕА = 190 кДж/моль:
CH3CHO СН4 + CO.
В присутності парів йоду процес протікає в дві стадії:
СН3СНО + І2 СН3І + НІ + CO ,
СН3І + НІ СН4 + І2.
Зменшення енергії активації цієї реакції в присутності каталізатора складає 54 кДж/моль; константа швидкості реакції при цьому збільшується приблизно в 100000 раз. Найбільш розповсюдженим типом гомогенного каталізу є кислотний каталіз, при якому в ролі каталізатора виступають йони Н+.
Існують такі типи гомогенного каталізу: кислотно-основний, окисно-відновний, координаційний, гомогенний газофазний, ферментний.