
- •Предназначение ферровольфрама и влияние его на свойства стали
- •3. Минералы, руды, месторождения, концентраты вольфрама, их характеристика.
- •4. Углетермический способ выплавки ферровольфрама на блок.
- •5. Углетермический способ производства ферровольфрама
- •6. Алюминотермический способ производства ферровольфрама
- •7. Предназначение ферромолибдена и влияние его на свойства стали
- •8) Физико-химические свойства молибдена и его соединений
- •9 )Минералы руды место рождения молибдена и их характеристика?
- •10) Для чего прокаливают концентрат молибдена и при каких режимах? Какие процессы протекают ?
- •11) Углетермический способ выплавки ферромолибденну
- •12) Силикотермический способ выплавки ферромолибденна
- •13. Применение феррованадия и влияние его на свойства сталей.
- •14. Физико-химические свойства ванадия и его соединений.
- •15. Минералы, руды ванадия, этапы переработки руд.
- •16. Технология получения феррованадия. Деление плавки на периоды.
- •17. Алюмотермическая плавка феррованадия
- •18 Предназначение ферротитана и влияние титана на свойства сталей
- •20 Минералы руды и концентраты титана их характеристика
- •21 Технология производства ферротитана
- •22 Производство ферротитана проводят с нижним запалом.
- •23 Электропечной способ получения феротитана
- •24 Технология чистого титана
- •25 Теоретический анализ восстановления титана разными восстановителями
- •26 Применение феррониобия и влияние ниобия на свойства стали
- •27. Физико-химические свойства Ниобия и его соединений
- •28 Минералы руды и концентраты Nb
- •Физические свойства
- •38. Минералы, руды и концентраты Алюминия
- •39. Особенности восстановления алюминия Углеродом
- •45. Технология получения ферроалюмоциркония
- •46. Технология силикоциркония
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора Обладает хрупкостью и полупроводниковыми свойствами

33. Минералы, руды и концентраты В
Основные минеральные формы бора:
![]()

34. технология получения ферробора

35 технология получения карбида и нитрида бора

36. Применение алюминия и влияние его на свойства стали

37. Физико-химические свойства алюминия и его соединений
Физические свойства:
Металл серебристо-белого цвета, лёгкий, плотность — 2,7 г/см³,температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C,удельная теплота плавления — 390 кДж/кг,температура кипения — 2500 °C,удельная теплота испарения — 10,53 МДж/кг,Твёрдость по Бринеллю — 24…32 кгс/мм², Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Химические свойства:
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
с галогенами (кроме фтора)[6], образуя хлорид, бромид или иодид алюминия:
2Al + 3Hal2 = 2AlHal3 (Hal = Cl, Br, I)
с другими неметаллами реагирует при нагревании:
с фтором, образуя фторид алюминия:
2Al + 3F2 = 2AlF3
с серой, образуя сульфид алюминия:
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
38. Минералы, руды и концентраты Алюминия
В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Некоторые из них:
Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд (сапфир, рубин, наждак) — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях возможно образование самородного алюминия.
39. Особенности восстановления алюминия Углеродом
Оксид алюминия в условиях протекания восстановительной плавки не способен разлагать образующиеся карбиды и оксидкарбиды алюминия. По аналогии с восстановлением кремнезема можно представить процесс восстановления оксида алюминия следующими суммарными реакциями: Al2O3 + ЗС =2А1 + ЗСО; А1 + ЗС = Аl4С3; 2Al2O3 + 9С = Аl4С3 + 6СО. В результате восстановления получается смесь металлического алюминия 60—80 %, карбида алюминия 20—35 % и оксида алюминия 3—5 %. Термодинамический анализ системы А1—О—С дает ориентировочное представление о протекании процесса в связи с недостаточной надежностью термодинамических данных промежуточных соединений и отсутствием надежных данных о взаимной их растворимости.
Взаимодействие оксида алюминия с углеродом до 1650 С протекает в небольшой степени. С ростом температуры и появлением жидкой фазы взаимодействие резко возрастает. Образованием жидкой фазы обусловливается ускорение процесса. Основным конденсированным продуктом восстановления на этой стадии является карбид алюминия, содержание которого возрастает до 1950 °С. Металлический алюминий появляется при 1900 °С. В процессе восстановления при температурах, близких к 2000 °С, содержание карбида алюминия снижается и одновременно возрастает содержание свободного углерода, что обусловлено разложением карбида алюминия.
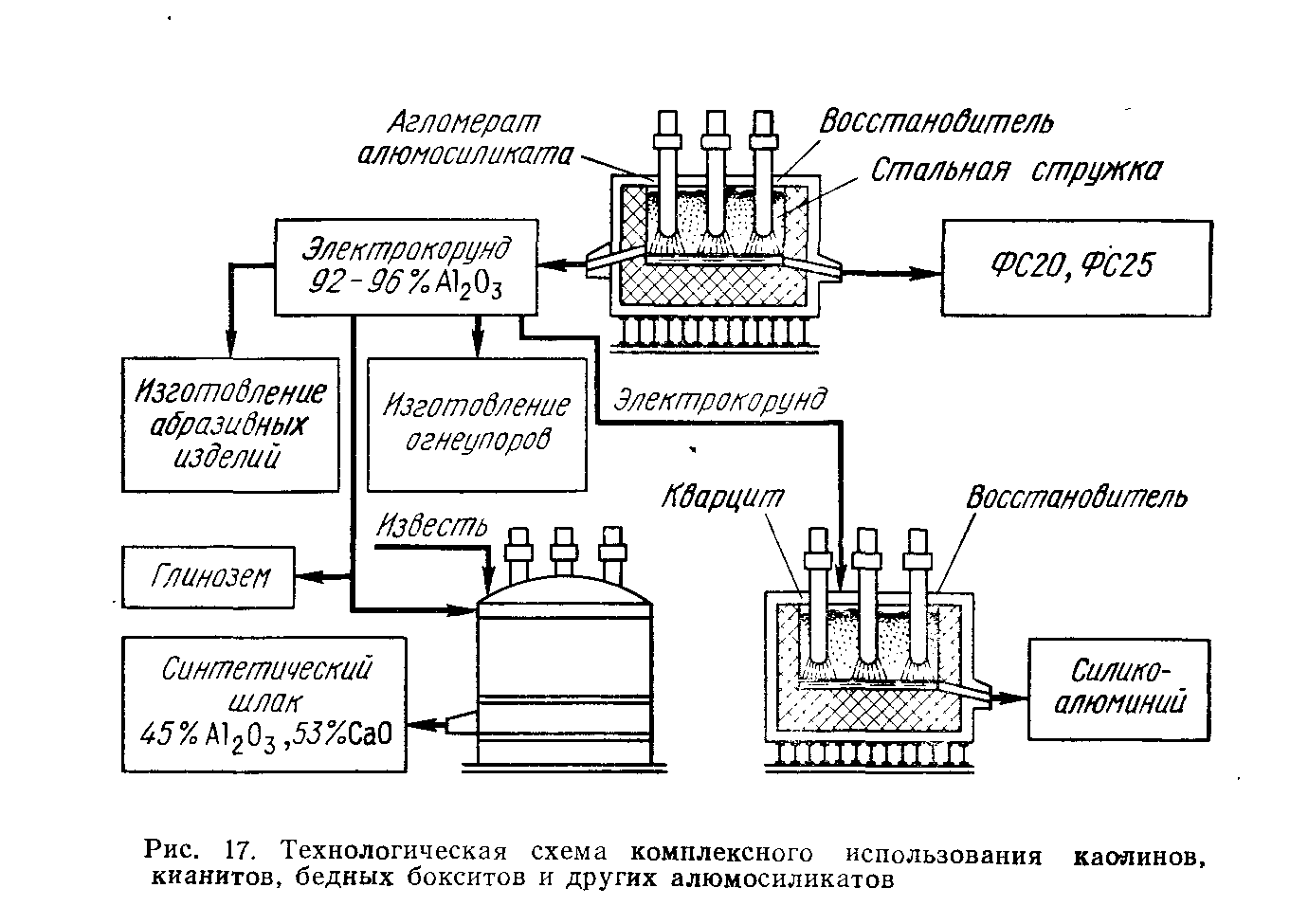
. 40Технология выплавки ферроалюминия
ферроалюминия должен быть следующим: содержание алюминия в зависимости от марки от 8 до 24 %, содержание примесей для всех марок (не более): 4% Si, 4% С, 0,06% S, P. Выплавку ферроалюминия целесообразно вести в типовых закрытых электропечах большой мощности. Технология выплавки сплава состоит в восстановлении алюминия из электрокорунда, получаемого из агломерата бокситов любого состава, ставролитового концентрата или другого алюмосиликатного сырья. При этом получают также ферросилиций марок ФС20 и ФС25. Вторая стадия представляет собой непрерывный процесс с периодическим выпуском металла и очень небольшого количества шлака.
Физико-химические основы процесса производства сплавов алюминия
Восстановление оксидов алюминия углеродом связано с образованием сложных оксикарбидов и карбида алюминия, имеющих высокую устойчивость в присутствии некоторых других оксидов и металлов. Отсутствие надежных термодинамических данных по оксикарбидам алюминия затрудняет достоверный термодинамический анализ всех ступеней последовательного восстановления Al2O3 углеродом, протекающего по схеме: Al2O3>Al4O4C>Al2OC>Al4C3>Al
Примерный состав руды: 30% Al2O3, 45% SiO2, 4% Fe2O3, 15% Na2O, 5,3% K2O, 0,7 % MgO.
41. техлнология выплавки ферромарганец-алюминия

42 технология выплавки ферросиликоалюминия и силикоалюминия


43. Физико –химические свойства Циркония

Минералы, руды и концентраты циркония
В природе распространены главным образом циркон (ZrSiO4)(67,1 % ZrO2), бадделеит (ZrO2) и различные сложные минералы (эвдиалит (Na, Ca)5(Zr, Fe, Mn)[O,OH,Cl][Si6O17] и др.). Во всех земных месторождениях цирконию сопутствует Hf, который входит в минералы циркона благодаря изоморфному замещению атома Zr.
Основные методы обогащения руд — гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон — ортосиликат циркония ZrSiO4 (67,2 % ZrO2, 32,8 % SiO2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4,7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепа-рациями.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США, на Урале, Украине.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Na, Ca)6Zr[Si6O18][OH,Cl]2.
Эвколит — разновидность эвдиалита, содержащего ионы Fe2+. Химический состав эвдиалита, %: Na2O 11,6-17,3; ZrO2 12-14,5; FeO
