
- •13. Белки: строение, классификация и их роль в растениях.
- •14.Свойства белков
- •15. Аминокислоты: строение, классификация, роль в обмене веществ. Незаменимые аминокислоты.
- •По функциональным группам
- •18. Ферменты: значение и строение. Влияние условий среды на активность ферментов. Эндоферменты, экзоферменты, изоферменты.
- •21. Витамины: классификация. Биологическая роль.
- •22. Липиды: классификация, роль в природе.
- •23. Качественные реакции на белки.
13. Белки: строение, классификация и их роль в растениях.
Белки - высокомолекулярные природные полимеры, состоящих из индивидульной последовательности аминокислот и соединенных между собой пептидной связью-CO-NH-.
Белки - высокомолекулярные азотосодержащие органические полимеры, мономерными единицами которых являются аминокислоты (их 20, все они -аминокислоты). Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот(которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Классификация : делят на протеины и протеиды.
Протеины- простые белки, построенные только из остатков аминокислот; разделяются на группы в зависимости от их растворимости в различных растворителях:
Альбумины – растворимы в воде, небольшой молекулярный вес, представители- альбумин куриного яйца, лейкозины пшеницы ржи, легумелины семян сои и гороха ; А встречается во всех растительных тканях.
Глобулины – нерастворимые в воде и слабых кислотах, есть в семенах бобовых масляночных; представители- эдестин у конопли, фазеолин у фасоли и тд.
Проламин – растворимы в 70% этиловом спирте; чаще встречаются в семенах злаковых; в П много пролина амидов глутаминовой к-ты; представители: глиадины пшеницы и ржи, гордеин ячменя, зеин у кукурузы, авенин у овса.
Глютелин – растворимы в слабых р-рах щелочей;
Протамины – имеют основные св-ва; высока щелочность из –за присутствия аргенина ; П в молоках рыб.
Гистоны – щелочные белки; в ядрах животных клеток.
Протеиды – сложные белки, в составе которых кроме белковой части есть небелковая группа, прочно связанная с белком. Все П делят в зависимости от природы этой небелковой части:
Фосфопротеиды- белок связан с фосфорной кислотой эфирной связью; представители-казеин молока.
Линопротеиды – белок связан с производными липидов (лецитин).
Гликопротеид – входят углеводы; представители- белки, входящие в состав слюны.
Металлопротеиды – в составе- металлы; к ним относят белки с ферментативными сво-ми- каталаза, пероксидаза, цитохромы.
Хромопротеиды - белок связан с окрашенными соед-ми небелковой природы; представители- соединения белка с хлорофиллом, гемоглобин.
Нуклеопротеиды – соединения белка с нуклеиновыми кис-ми; важную роль играют в процессах организма.
Роль в растениях- спросим у кого нить)
14.Свойства белков
1. Амфотерность - Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белкаотрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд положительный и обусловлен этими, положительно заряженными, аминокислотами. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативной конформации.
2.Влияние рН на заряд белка При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным. При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
3.Растворимость
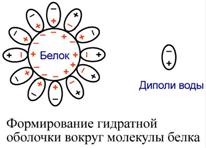
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
наличием заряда и взаимоотталкиванием заряженных молекул белка,
наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды.
4.Белки имеют высокий молекулярный вес 16 000-1 000 000.
5. Белковые растворы- коллоидные растворы с разными свойствами. Белки бывают кислыми и основными. Кислые белки содержат много глу и асп, у которых есть дополнительные карбоксильные и меньше аминогрупп. В щелочных белках много лиз и арг. Каждая молекула белка в водном растворе окружена гидратной оболочкой, так как у белков за счет аминокислот есть много гидрофильных группировок (-СООН, -ОН, -NH2, -SH). В водных растворах белковая молекула имеет заряд. Заряд белка в воде может меняться в зависимости от РН.
6. Основным свойством белков является возможность их связывания с различными веществами. У каждого белка имеются центры, состоящие из аминокислот, которые участвуют в связывании с другими веществами - белками, углеводами, липидами, нуклеиновыми кислотами. Вещества, которые присоединяются к белкам, называются лигандами (О2 к гемоглобину).
