
Все тела состоят из частиц (атомов, молекул, ионов и др.);
Частицы непрерывно хаотически движутся;
Частицы взаимодействуют друг с другом.
Основными доказательствами этих положений считались:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
В современной (теоретической) физике термин молекулярно-кинетическая теория уже не используется, хотя он встречается в учебниках по курсу общей физики. В современной физике МКТ заменила кинетическая теория, в русскоязычной литературе — физическая кинетика, и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения.
Основное
уравнение МКТ: Еk= kT
где k является постоянной Больцмана
(отношение универсальной газовой
постоянной R к числу Авогадро NA), i —
число степеней свободы молекул (i = 3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура.
kT
где k является постоянной Больцмана
(отношение универсальной газовой
постоянной R к числу Авогадро NA), i —
число степеней свободы молекул (i = 3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
2.
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12) , где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27 кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
3.
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними. Taк, в 1 м3 газа при нормальных условиях содержится 2,68×1025 молекул, занимающих объем примерно 10–4 м3 (радиус молекулы примерно 10–10 м), которым по сравнению с объемом газа (1 м3) можно пренебречь. При давлении 500 МПа (1 атм = 101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях £ 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
По мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На рис. 88, а приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fо и Fп — соответственно силы отталкивания и притяжения, a F — их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.

На расстоянии r=r0 результирующая сила F = 0, т.е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние r0 соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При r < r0 преобладают силы отталкивания (F>0), при r > r0 — силы притяжения (F<0). На расстояниях r > 10–9 м межмолекулярные силы взаимодействия практически отсутствуют (F®0).
Элементарная работа dA силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
![]()
(60.1)
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рис. 88, б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r®¥), то П=0. При постепенном сближении молекул между, ними появляются силы притяжения (F<0), которые совершают положительную работу (dA=Fdr > 0). Тогда, согласно (60.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при r= r0. При r < r0 с уменьшением r силы отталкивания (F>0) резко возрастают и совершаемая против них работа отрицательна (dA=Fdr<0). Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (r = r0) обладает минимальной потенциальной энергией.
Критерием различных агрегатных состояний вещества является соотношение между величинами Пmin и kT. Пmin — наименьшая потенциальная энергия взаимодействия молекул — определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (r= r0); kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул.
Если Пmin<<kT, то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния r0, т. е. вероятность образования агрегатов из молекул достаточно мала. Если Пmin>>kT, то вещество находится в твердом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием r0. Если Пmin»kT, то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее r0.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причем температура перехода из одного агрегатного состояния в другое зависит от значения Пmin, для данного вещества. Например, у инертных газов Пmin мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
Простые опыты и наблюдения убеждают нас, что при повышении температуры размеры тел немного увеличиваются, а при охлаждении — уменьшаются до прежних размеров. Так, например, сильно разогретый болт не входит в резьбу, в которую он свободно входит, будучи холодным. Когда болт охладится, он снова входит в резьбу. Телеграфные провода в жаркую летнюю погоду провисают заметно больше, чем во время зимних морозов. Увеличение провисания, а следовательно, и длины натянутых проволок при нагревании легко воспроизвести на опыте, изображенном на рис. 353. Нагревая натянутую проволоку электрическим током, мы видим, что она заметно провисает, а по прекращении нагревания снова натягивается.
При нагревании увеличиваются не только длина тела, но также и другие линейные размеры. Изменение линейных размеров тела при нагревании называют линейным расширением. Если однородное тело (например, стеклянная трубка) нагревается одинаково во всех частях, то оно, расширяясь, сохраняет свою форму. Иное происходит при неравномерном нагревании.
4.
Закон Бойля-Мариотта устанавливает зависимость между абсолютным давлением и удельным объемом ν газа при постоянной температуре:
P1v1 = P2v2 = const (2.14)
Закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
Vt = V0 (1 + βpt) = V0(1 + t/273,15) (2.15)
или при постоянном объеме:
Pt = Р0 (1 + βpt) = Р0 (1 + t/273,15) (2.16)
где Vt, V0 — объемы газа при t°С и 0°С; pt и р0 — давление газа (абсолютное) при t°С и 0°С; βp — коэффициент объемного расширения идеального газа, равный коэффициенту изменения давления:
βp = 1/273,15 = 0,00366 (2.17)
Подставив значения βp и заменив температуру практической шкалы t абсолютной термодинамической Т, получим:
V1/V2 = Т1/Т2 (2.18)
р1/p2 = Т1/Т2 (2.19)
На основании законов Бойля-Мариотта и Гей-Люссака получаем уравнения, связывающие объем и плотность с температурой и давлением:
V1 = V2 (p2Т1)/(р1Т2) (2.20)
v2 = v1 (р2Т1)/(р1Т2) (2.21)
р1 = p2 (р1T2)/(p2T1) (2.22)
Приведение газа к нормальным условиям при рабc = 101,3 кПа и t = 0°С (Т = 273,15 К) и от нормальных условий к заданным осуществляется по уравнениям:
Vн = 2,6965V (Рабс/Т); Рн = 0,3708р (Т/рабс); (2.23)
V = 0,3708Vн (Т/рабс); р = 2,6965рн (рабс/Т) (2.24)
Приведение газа к стандартным условиям [рабс = 101,3 кПа и t = 20°C (Т = 293,15 К)] и обратно выполняется по уравнениям:
Vст = 2,894V (Рабс/Т); Рст = 0,3455р (Т/рабс) (2.25)
V = 0,3455Vст (Т/рабс); р = 2,894рст (рабс/Т) (2.26)
где Vн, ρн — объем (м3) и плотность (кг/м3) газа при рабс = 101,3 кПа и Т = 273,15 К; V, ρ — объем и плотность газа при рабс, кПа, и Т, К; Vст, ρст — объем и плотность газа при рабс= 101,3 кПа и Т = 293,15 К.
Закон Авогадро: различные газы, занимающие одинаковые объемы при равных условиях (одинаковых давлении и температуре), содержат одинаковое число молекул. Это число для 1 грамм-молекулы (1 моль) любого газа составляет около 6,025•1023 и называется числом Авогадро. Таким образом, массы различных газов, занимающие одинаковый объем при равных условиях, соотносятся между собой как их молекулярные массы. Средний объем 1 моль двухатомных газов и метана равен 22,4 л, соответственно, объем 1 кмоль сжиженных газов приблизительно равен 22 м3.
Основные значения молекулярных масс и молярных объемов, а также плотности газов приведены в табл. 2.4. Одно из следствий закона Авогадро: произведение удельного объема на молекулярную массу есть величина постоянная, равная молярному объему.
Объединив законы Бойля-Мариотта и Гей-Люссака, получим уравнение состояния идеального газа:
Pa6cv/T = R = сonst (2.27)
где v — удельный объем газа; R — универсальная газовая постоянная.
Газовая постоянная — физическая величина, равная работе изменения объема, совершаемой 1 кг идеального газа в изобарическом процессе при изменении температуры на 1°С (1 К). Единицы газовой постоянной — кг•м/(кг•°С); ккал/(кг•°С); Дж/(кг•К). 1 Дж/(кг•К) = 0,238846 кал/(кг•°С) = 0,10197 кг•м/(кг•°С).
Уравнение относится к 1 кг газа. Так как удельный объем v = V/m, то для произвольного количества газа уравнение примет вид:
РабсV = mRT (2.28)
или для смеси газов
РабcV = mсмRT (2.28)
где mсм — масса смеси, кг.
Для 1 кмоль Vм в соответствии с законом Авогадро постоянная имеет одно и то же значение для всех газов и называется универсальной газовой постоянной:
Рабc vм = MRT (2.29)
Так как VM = vM, то
Рабc vм = MRT (2.30)
Последние уравнения, отображающие параметры состояния любого газа, носят название уравнений Менделеева. Значение и единица универсальной газовой постоянной зависят от того, в каких единицах выражены давление и объем газа.
При рабс = 10330 кгс/м2, VM = 22,0 м3/кмоль и Т = 273,15 К газовая постоянная для 1 кмоль MR = 831,96 кгс•м/(кмоль•°С) = 8153,21 Дж/(кмоль•К).
Для двухатомных газов и для метана — 847,1 кгс•м/(кмоль•°С) = 8301,6 Дж/(кмоль•К). По универсальной газовой постоянной и по молекулярной массе определяется удельная газовая постоянная любого углеводородного газа:
R = 8153,21/М (2.31)
Примечания:
1. Газы могут быть превращены в жидкость сжатием, но при условии, что температура не превышает значения, строго определенного для каждого однородного газа. Температура, при которой и выше которой данный газ не может быть сжижен никаким повышением давления, называется критической Ткр. Давление, при котором и выше которого повышением температуры нельзя испарить жидкость, называется критическим ркр. Объем газа, соответствующий критической температуре, называется критическим Vкр, а состояние газа, отвечающее критической температуре, критическому давлению и критическому объему, — критическим состоянием газа. При критическом состоянии плотность пара становится равной плотности жидкости.
2. Приведенные данные по смесям ПБА и ПБТ (ГОСТ Р 52087-2003) рассчитаны из следующих соотношений: для ПБА — доля пропана составляет не менее 50%, доля бутана и других газов — не более 50%; для ПБТ — доля бутана может достигать 70% (по ГОСТ Р 52087-2003 — 60%) согласно внутренним ТУ изготовителей.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: p*VM=R*T,
где
p— давление,
VM — молярный объём,
R — универсальная газовая постоянная
T — абсолютная температура,К.
Закон Дальтона.
Рассмотрим газ, состоящий из молекул различных веществ, который находится в объёме V. Вследствие хаотического теплового движения молекулы каждой компоненты смеси будут распределены по объёму равномерно, т.е. так как если бы остальные компоненты газа отсутствовали. Из–за постоянных соударений молекул друг с другом, сопровождающихся частичным обменом между ними импульсами и энергиями, в смеси устанавливается тепловое равновесие. Всё это приводит к тому, что давление каждой из компонент смеси не будет зависеть от присутствия остальных.
Тогда результирующее давление определяется суммарным давлением всех компонентов, т.е. для смеси газов справедлив закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов.
 (14)
,
(14)
,
где k – номер газовой компоненты в смеси, Pk – ее парциальное давление, т.е. то давление, которое имел бы k–ый газ, если бы только он один занимал весь объём, занимаемый смесью.
5.
Давление газов
Мы знаем, что газы, в отличие от твёрдых тел и жидкостей заполняют весь сосуд, в котором они находятся, например стальной баллон для хранения газов, камеру автомобильной шины или волейбольного мяча. При этом газ оказывает давление на стенки, дно и крышку баллона, камеры или любого другого тела, в котором он находится. Давление газа обусловлено иными причинами, чем давление твёрдого тела на опору.
Известно, что молекулы газа беспорядочно движутся. При своём движении они сталкиваются друг с другом, а также со стенками сосуда, в котором находится газ. Молекул в газе много, потому и число их ударов очень велико. Хотя сила удара отдельной молекулы мала, но действие всех молекул о стенки сосуда значительно, оно и создаёт давление газа.
Итак, давление газа на стенки сосуда (и на помещённое в газ тело) вызывается ударами молекул газа.
При уменьшении объёма газа его давление увеличивается, а при увеличении объёма давление уменьшается при условии, что масса и температура газа остаются неизменными.
Давление газа в закрытом сосуде тем больше, чем выше температура газа, при условии, что масса газа не меняется.
Закон Паскаля
Давление, производимое на жидкость или газ, передаётся без изменения в каждую точку объёма жидкости или газа.
Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Теория создана немецким физиком Р. Клаузисом в 1957 году для модели реального газа, которая называется идеальный газ. Основные признаки модели:
расстояния между молекулами велики по сравнению с их размерами;
взаимодействие между молекулами на расстоянии отсутствует;
при столкновениях молекул действуют большие силы отталкивания;
время столкновения много меньше времени свободного движения между столкновениями.
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ.
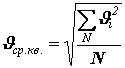
 где
n
где
n
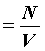
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Получим связь давления со средней кинетической энергией поступательного движения молекулы

Из
формулы (11)
 ,
следовательно:
,
следовательно:
Таким образом, давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.
7.
Модель идеального газа
Основные предположения
Число молекул в газе велико: N >> 1, среднее расстояние между отдельными молекулами много больше их размеров (l >> a).
Молекулы газа совершают неупорядоченное, хаотическое движение.
Движение отдельных молекул подчиняется законам классической механики. При этом молекулы рассматриваются как материальные точки, совершающие только поступательное движение. Величина потенциальной энергии взаимодействия в среднем мала по сравнению со средней кинетической энергией.
Все соударения молекул друг с другом и со стенками сосуда, в котором находится газ, являются абсолютно упругими (происходят без потери энергии). При ударе о стенку компонента импульса молекулы, перпендикулярная стенке, меняет знак (но не величину). Таким образом, в целом выполняются законы сохранения импульса и энергии для молекул газа.
Понятие
об усреднении. По определению среднее
значение какой-то величины, которая
случайным образом в N независимых
испытаниях принимает N значений ai, равно
.

Ввиду
полной хаотичности движения молекул
проекции скорости молекул на ось X с
равной вероятностью могут принимать
как положительные, так и отрицательные
значения. Поэтому среднее значение
проекции скорости i-ой молекулы на ось
X равно нулю: <vix> = 0. Аналогично <viy>
= <viz> = 0. Однако средние значения
квадратов проекций скорости не равны
нулю! Определим для i-ой молекулы:
![]() .
Тогда .
.
Тогда .![]() Поскольку все направления эквивалентны,
то
Поскольку все направления эквивалентны,
то![]() , следовательно .
, следовательно .

Основное уравнения модели идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа утверждает:
Произведение
давления идеального газа на его объем
пропорционально плотности числа молекул
в газе и средней кинетической энергии
поступательного движения отдельной
молекулы, т.е.

Внутренней энергией тела называют часть его полной энергии за вычетом кинетической энергии движения тела как целого и потенциальной энергии тела во внешнем поле. Таким образом, во внутреннюю энергию входят кинетическая энергия поступательного и вращательного движений молекул, потенциальная энергия их взаимодействия, энергия колебательного движения атомов в молекулах, а также энергия различных видов движения частиц в атомах.
В идеальном газе потенциальная энергия взаимодействия молекул пренебрежимо мала и внутренняя энергия равна сумме энергий отдельных молекул

(2.24)
где
Ei — энергия отдельной молекулы. До сих
пор мы пользовались представлением о
молекулах как о материальных точках.
Кинетическая энергия молекул считалась
совпадающей с энергией их поступательного
движения, а средняя кинетическая энергия
молекулы полагалась равной
 .
Эта энергия распределяется между тремя
поступательными степенями свободы.
.
Эта энергия распределяется между тремя
поступательными степенями свободы.
Ввиду полной беспорядочности движения молекул в газе все направления перемещения молекулы равновероятны. Поэтому на каждую степень свободы поступательного движения приходится в среднем энергия
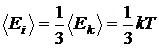
Представление о молекулах как о материальных точках оправдывается только для одноатомных газов. В случае многоатомных газов нужно рассматривать молекулы как сложные системы, способные вращаться как целое, причем атомы в них могут совершать колебания вблизи своих положений равновесия. Общее число степеней свободы молекулы при этом увеличивается.
Вспомним, что числом степеней свободы механической системы называется количество независимых параметров, с помощью которых может быть задано положение системы. Так, положение материальной точки в пространстве определяется заданием значений трех ее координат. В соответствии с этим материальная точка имеет три степени свободы.
Положение абсолютно твердого тела можно определить, задав три координаты его центра инерции и три угла, характеризующие возможные повороты тела в пространстве. Таким образом, абсолютно твердое тело имеет шесть степеней свободы — три поступательных и три вращательных.
N материальных точек, не связанных между собой, имеют 3N степеней свободы. Поскольку положение в пространстве системы как целого точно так же, как и положение абсолютно твердого тела определяется шестью параметрами, упомянутыми выше, то число степеней свободы такой системы равно 3·N-6. Это число соответствует возможным смещениям точек относительно друг друга около своих положений равновесия. Такой тип движения называется колебательным. Значит, количество колебательных степеней свободы и есть 3·N-6.
Энергия молекул, состоящих из некоторого числа атомов, не жестко связанных друг с другом, будет теперь складываться из энергии поступательного движения, вращательной энергии и энергии колебаний
Ei = Eпоступ + Eвращ +Eколеб. (2.26)
Нет причин полагать, что поступательное движение является в какой-то мере выделенным по сравнению с вращательным или колебательным. Поэтому следует считать, что по-прежнему на каждую степень свободы молекулы приходится энергия, равная kT/2. Однако следует учесть особенность, связанную с колебательным движением. Средняя энергия колебательного движения складывается из средней кинетической энергии и равной ей средней потенциальной энергии. Поэтому на каждую колебательную степень свободы приходится энергия, в два раза большая, чем на поступательные или вращательные степени свободы. Следовательно, средняя энергия молекулы должна равняться:
<Ei> = i·k·T, (2.27)
где i — сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпоступ + iвращат + 2·iколеб. (2.28)
Внутренняя
энергия на один моль идеального газа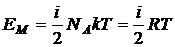 (2.29)
(2.29)
8.
МЕТОДЫ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ И ТЕМПЕРАТУРНЫЕ ШКАЛЫ
Температурой называется степень нагретости вещества. Это представление о температуре основано на теплообмене между двумя телами, находящимися в тепловом контакте. Тело, более нагретое, отдающее тепло, имеет и более высокую температуру, чем тело, воспринимающее тепло. При отсутствии передачи тепла от одного тела к другому, т. е. в состоянии теплового равновесия, температуры тел равны.
а) Методы измерения температуры
Переход тепла от одного тела к другому указывает на зависимость температуры от количества внутренней энергии, носителями которой являются молекулы вещества. Согласно молекулярно-кинетической теории сообщаемая телу тепловая энергия, вызывающая повышение его температуры, преобразуется в энергию движения молекул.
Измерить температуру какого-либо тела непосредственно, т. е. так, как измеряют другие физические величины, например длину, массу, объем или время, не представляется возможным, ибо в природе не существует эталона или образца единицы этой величины. Поэтому определение температуры вещества производят посредством наблюдения за изменением физических свойств другого, так называемого термометрического (рабочего) вещества, которое, будучи приведено в соприкосновение с нагретым телом, вступает с ним через некоторое время в тепловое равновесие. Такой метод измерения дает не абсолютное значение температуры нагретой среды, а лишь разность относительно исходной температуры рабочего вещества, условно принятой за нуль.
Вследствие изменения при нагреве внутренней энергии вещества практически все физические свойства последнего в большей или меньшей степени зависят от температуры, но для ее измерения выбираются по возможности те из них, которые однозначно меняются с изменением температуры, не подвержены влиянию других факторов и сравнительно легко поддаются измерению. Этим требованиям наиболее полно соответствуют такие свойства рабочих веществ, как объемное расширение, изменение давления в замкнутом объеме, изменение электрического сопротивления, возникновение термоэлектродвижущей силы и интенсивность излучения положенные в основу устройства приборов для измерения температуры.
б) Температурные шкалы
Изменение агрегатного состояния химически чистого вещества (плавление или затвердевание, кипение или конденсация), как известно, протекает при постоянной температуре, значение которой определяется составом вещества, характером его агрегатного изменения и давлением. Значения этих воспроизводимых температур равновесия между твердой и жидкой или жидкой и газообразной фазами различных веществ при нормальном атмосферном давлении1 (1 Нормальное атмосферное давление условно принято равным среднему давлению воздушного столба земной атмосферы ) равном 101 325 Па (760 мм рт. ст.), называются реперными точками .
Если принять в качестве основного интервал температур между реперными точками плавления льда и кипения воды, обозначив их соответственно 0 и 100, в пределах этих температур измерить объемное расширение какого-либо рабочего вещества, например ртути, находящейся в узком цилиндрическом стеклянном сосуде, и разделить на 100 равных частей изменение высоты ее столба, то в результате будет построена так называемая температурная шкала.
Для измерения температуры, лежащей выше или ниже выбранных значений реперных точек, полученные деления наносят на шкале и за пределами отметок 0 и 100. Деления температурной шкалы называются градусами.
При построении указанной температурной шкалы была произвольно принята пропорциональная зависимость объемного расширения ртути от температуры, что, однако, не соответствует действительности, особенно при температурах выше 100 градусов. Поэтому при помощи такой шкалы можно точно измерить температуру только в двух исходных точках 0 и 100 градусов, тогда как результаты измерения во всем остальном диапазоне шкалы будут неточны. То же явление наблюдалось бы и при построении температурной шкалы с использованием других физических свойств рабочего вещества, таких, как изменение электрического сопротивления проводника, возбуждение термоэлектродвижущей силы и т. п.
Пользуясь
вторым законом термодинамики, английский
физик Кельвин в 1848 г. предложил совершенно
точную и равномерную, не зависящую от
свойств рабочего вещества шкалу,
получившую название термодинамической
температурной шкалы (шкалы Кельвина).
Последняя основана на уравнении
термодинамики для обратимого процесса
(цикла Карно)
,
имеющем вид:
 .
.
Это уравнение показывает, что при работе теплового двигателя по обратимому циклу отношение количества тепла Q1 получаемого рабочим веществом от нагревателя, к количеству тепла Q2 отдаваемого им холодильнику, пропорционально только отношению температур T1 и Т2 нагревателя и холодильника. Придав определенное значение Т2, при известных значениях Q1 и Q2 можно из соотношения (2-1) найти искомую величину T1. Однако практически указанный метод измерения температуры использован быть не может, так как нельзя осуществить обратимый цикл работы теплового двигателя.
Позднее было установлено, что термодинамическая температура совпадает с показанием газового термометра, заполненного идеальным (воображаемым) газом, обладающим пропорциональным изменением давления от температуры. Близкими по своим свойствам к идеальному газу являются водород, гелий и азот, которые и применяются для измерения термодинамической температуры с введением небольших поправок на отклонение их свойств от свойств идеального газа1. (1 Свойства водорода и гелия близки к законам идеального газа при низких температурах, а азота-при высоких). Точность показаний газового термометра очень высока, но пользование им сложно, а диапазон измерения незначителен.
Термодинамическая температурная шкала начинается с абсолютного нуля2 ( 2Абсолютным нулем называется температура, при которой давление идеального газа при постоянном объеме равно нулю). и в настоящее время является основной. Единицы термодинамической температуры обозначаются знаком К (кельвин), а условное значение ее - буквой Т.
В дальнейшем с помощью газовых термометров была построена так называемая Международная практическая температурная шкала (МПТШ), легко и точно воспроизводимая и близкая к термодинамической шкале. МПТШ была принята на VII Генеральной конференции по мерам и весам в 1927 г. Это вызывалось необходимостью облегчить измерение температуры с помощью газовой термометрии и унифицировать существующие в разных странах температурные шкалы.
Международная практическая температурная шкала была уточнена в 1948 г., а в 1960 г. изложена в новой редакции, принятой на XI Генеральной конференции по мерам и весам, где получила название Международной практической температурной шкалы 1948 г. (МПТШ-48). Позднее появились две важные причины для пересмотра МПТШ-48, первая из которых заключалась в необходимости расширения шкалы в области низких температур (10 - 90 К), а вторая - в повышении ее точности, так как современные измерения с помощью газовых термометров показали, что МПТШ-48 дает в основном более низкие значения по сравнению с термодинамической шкалой.
Исходя из указанных причин Международный комитет мер и весов в 1968 г. в соответствии с решением XIII Генеральной конференции по мерам и весам (1967 г.) принял новую Международную практическую температурную шкалу 1968 г. (МПТШ-68), градусы которой обозначаются знаком °С (градус Цельсия), а условное значение температуры - буквой t. Для этой шкалы градус Цельсия равен кельвину.
лассификация приборов для измерения температуры
Приборы для измерения температуры разделяются в зависимости от используемых ими физических свойств веществ на следующие группы с диапазоном показаний:

9.
ПОРЯДОК ПРОВЕДЕНИЯ ОПЫТА
Опыт проводился в следующей последовательности. По платиновой нити, располагающейся по оси малого цилиндра, пропускался электрический ток. Нить нагревалась практически до температуры плавления серебра Тп = 1234° К, и серебро начинало испаряться. Часть атомов серебра проходило сквозь щель. Отфильтрованные диафрагмой, далее они двигались по радиальным направлениям к внутренней поверхности большого цилиндра прямолинейно и равномерно со скоростью, соответствующей температуре платиновой нити. Стенка большого цилиндра охлаждалась так, чтобы попадающие на нее атомы «прилипали» к ней, образуя налет серебра в форме щели, но немного больших размеров.
Сначала прибор покоился, и изображение щели на экране (латунной пластинке) приходилось как раз против нее самой (рис. 3). Затем прибор приводился в быстрое вращение вокруг собственной оси с частотой 1500 - 2700 об/мин и, результаты опыта существенно изменялись. Каждый атом по-прежнему двигался прямолинейно, но за время, которое требовалось атому, чтобы, пройдя щель, долететь до латунной пластинки, последняя успевала повернуться на некоторый угол, и атом уже прилипал к ней не точно против щели, а несколько в стороне [ там же] (рис. 4).
Смещение полоски серебра при вращении установки позволяло определить величину скорости движения атомов серебра и сравнить ее со значением, полученным теоретическим путем.
Способ нахождения скорости атомов серебра был достаточно прост. Атом, двигаясь со скоростью υ, проходил расстояние:
![]()
где R и r – радиусы внешнего и внутреннего цилиндров, а τ – время прохождения этого расстояния.
Любая точка внешнего цилиндра за это время проходила путь:

Решая эти уравнения совместно, О. Штерн определил среднюю скорость движения атомов:

Измеряя значения ω, R, r и S можно рассчитать среднюю скорость движения атомов серебра при температуре нити – Тн. Меняя температуру накала нити можно найти температурную зависимость скорости теплового движения атомов.

Рис. 4. При вращении прибора по часовой стрелке налет серебра смещается.
Толщина налета серебра определялась в опыте О.Штерна оптическим методом.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ОПЫТА
Ширина полоски из серебра при неподвижной установке составила 0,4 мм. При вращении установки смещение полоски также не превысило нескольких долей миллиметра (0,035 – 0,063 см). По величине смещения полоски серебра была определена скорость движения атомов, которая составила около 600 м/с [17, с.147]
Другим важным результатом опыта О. Штерна явилось то, что полоска серебра при вращении прибора приобрела принципиально другой вид. Оказалось, что изображение щели не просто сместилось, но оно стало еще и размытым. Если бы все атомы, вылетающие из нити, имели одинаковую скорость, то изображение щели на экране не изменилось бы по форме и размеру, а лишь немного бы сместилось в сторону. Размытость же полоски из серебра позволила О. Штерну сделать заключение о том, что вылетающие из раскаленной нити атомы движутся с разными скоростями. Атомы, движущиеся быстро, смещались меньше, чем атомы движущиеся с меньшей скоростью.
Возникла проблема определения скорости движения атомов серебра. В этой ситуации можно было определить только смещение для середины изображения щели и, соответственно, вычислить среднюю скорость движения атомов [8, С. 49].
Температура нити в опытах О.Штерна равнялась 1225°С, что соответствует среднеквадратичной скорости = 588 м/с. О.Штерном для этого значения температуры были получены значения скорости движения атомов серебра от 560 до 640 м/с.
Изучение профиля полоски серебра позволило ученому сделать вывод о существовании наиболее вероятной средней скорости движения частиц (т.е. скорости с которой движется наибольшее число молекул).
С ростом температуры профиль полоски серебра смещался меньше, что убедительно свидетельствовало о зависимости средней скорости движения частиц от температуры металла.
Как видно, результаты опыта О.Штерна хорошо согласовались с предварительными теоретическими расчетами и выводами
ОБЪЯСНЕНИЕ ДАННЫХ ОПЫТА С ПОЗИЦИИ СОВРЕМЕННЫХ НАУЧНЫХ ТЕОРИЙ
Результаты опыта О. Штерна подтвердили справедливость предсказанного Р.Клаузиусом значения скорости движения молекул газа, послужили ярким доказательством верности полученного Д. Максвеллом закона распределения числа молекул по скоростям и явились, в конечном счете, блестящим свидетельством правильности молекулярно-кинетических представлений о строении вещества, а также статистического характера закономерностей, которым подчиняется поведение молекулярных систем.
21 сентября 1859 г. на собрании Британской Ассоциации содействия прогрессу наук Джеймс Клерк Максвелл сделал доклад «Пояснения к динамической теории газов». Д. Максвелл отметил, что из молекулярной гипотезы «... может быть выведено так много свойств материи, в особенности, если ее рассматривать в газообразной форме, что истинная природа этого движения является предметом естественного интереса».
Д. Максвелл считал невероятным, что все молекулы движутся с одной скоростью. По его мнению, при каждой заданной температуре большинство молекул обладает скоростями, лежащими в довольно узких пределах, но некоторые молекулы могут двигаться с большей или меньшей скоростью. Более того, считал ученый, в каждом объеме газа при той или иной температуре есть молекулы, обладающие как очень малыми, так и очень большими скоростями. Сталкиваясь между собой, одни молекулы увеличивают скорость, а другие уменьшают. Но если газ находится в стационарном состоянии, то число молекул, обладающих той или иной скоростью, остается постоянным. Исходя из такого представления, Д. Максвелл исследовал вопрос о распределении молекул по скоростям в газе, находящемся в стационарном состоянии.
На основе законов механики он теоретически исследует движение и столкновение некоторого числа твердых упругих шаров малого размера и приходит к выводу, что в такой системе в результате взаимных столкновений устанавливается распределение «живых сил»(в современной терминологии – кинетической энергии) между частицами «согласно некоторому правильному закону». При этом возможно определить «среднее число частиц, скорости которых лежат между определенными пределами, хотя скорость каждой отдельной частицы изменяется при каждом столкновении». Д. Максвелл в качестве общего вывода констатирует, что «скорости распределяются между частицами по тому же закону, по которому распределяются ошибки между наблюдениями в теории «метода наименьших квадратов». Скорости молекул, согласно его расчетам, лежат в пределах от 0 до , однако число молекул, имеющих очень большие скорости, по мнению Д. Максвелла, сравнительно невелико.
В ходе данных исследований Д.Максвелл ввел в физику понятие вероятности, до этого понятием вероятности оперировали только математики. Примечательно, что в резюме к докладу Д. Максвелл ни слова не говорит об открытом им законе распределения скоростей. Между тем именно в этом открытии сейчас мы видим одну из главных заслуг Д. Максвелла.
Массовость и случайность событий в микромире определяют статистический характер открытого Д.Максвеллом закона. Согласно этому закону нельзя сказать, сколько частиц тела имеют определенные скорости или координаты в данный момент времени (строго говоря, ни одной), можно лишь рассчитать вероятность нахождения в заданном объеме той или иной частицы со скоростью из заданного интервала скоростей. Можно также ответить на вопрос: сколько (приблизительно, но достаточно обоснованно) частиц тела в данный момент имеют скорости и координаты из заданных интервалов. Причем точность ответа на этот вопрос будет тем выше, чем больше частиц в рассматриваемом объеме.
Вид
функции распределения молекул по
скорости движения Д. Максвелл определил
теоретическим путем (на основе теории
вероятностей). Максвелловская функция
распределения, называемая законом
Максвелла, выражается следующей формулой:
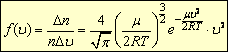
,где n - общее число молекул, - молярная масса газа, R - универсальная газовая постоянная, е - основание натурального логарифма.
На основе выведенной им формулы Д. Максвелл смог определить, например, что у молекулы азота при температуре 140° С наиболее вероятная скорость равна 500 м/с. Со скоростью от 300 до 700 м/с движется 59 % молекул. Меньшей скоростью обладает 12,6%, а большей – 28,4 % всех молекул.
Результаты работы Д. Максвелла получили всеобщее признание, но при этом не были подтверждены экспериментально.
О. Штерн в 1920 г., воспользовавшись методом молекулярных пучков, изобретенным французским физиком Луи Дюнойе (1911 г.) измерил скорость газовых молекул и на опыте подтвердил полученное Д. Максвеллом распределение молекул газа по скоростям [17, С. 47] .(Результаты опыта Штерна подтвердили правильность оценки средней скорости атомов, которая вытекает из распределения Максвелла. О характере самого распределения этот опыт мог дать лишь весьма приближенные сведения.
Более точно закон распределения был проверен в опытах Ламмерта (1929 г.), в которых молекулярный пучок пропускался через два вращающихся диска с радиальными щелями, смещенными относительно друг друга на некоторый угол. Меняя скорость вращения прибора или угол между щелями, можно выделить из пучка молекулы, обладающими различными значениями скорости. Результаты опытов Ламмерта и других исследований, предпринимавшихся с той же целью, находятся в полном соответствии с теоретическим законом распределения скоростей молекул Максвелла.)
10.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для
идеального газа, имеющего постоянную
температуру T
и находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения g
одинаково), барометрическая формула
имеет следующий вид: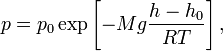
где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:
 где
m
— масса молекулы газа, k
— постоянная Больцмана.
где
m
— масса молекулы газа, k
— постоянная Больцмана.
Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Статистика Максвелла — Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
Барометрическая
формула показывает, что плотность газа
уменьшается с высотой по экспоненциальному
закону. Величина
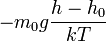 ,
определяющая быстроту спада плотности,
представляет собой отношение потенциальной
энергии частиц к их средней кинетической
энергии, пропорциональной kT.
Чем выше температура T,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести mg
(при неизменной температуре) приводит
к значительно большему уплотнению
нижних слоев и увеличению перепада
(градиента) плотности. Действующая на
частицы сила тяжести mg
может изменяться за счёт двух величин:
ускорения g
и массы частиц m.
,
определяющая быстроту спада плотности,
представляет собой отношение потенциальной
энергии частиц к их средней кинетической
энергии, пропорциональной kT.
Чем выше температура T,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести mg
(при неизменной температуре) приводит
к значительно большему уплотнению
нижних слоев и увеличению перепада
(градиента) плотности. Действующая на
частицы сила тяжести mg
может изменяться за счёт двух величин:
ускорения g
и массы частиц m.
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
Барометрическая формула лежит в основе барометрического нивелирования — метода определения разности высот Δh между двумя точками по измеряемому в этих точках давлению (p1 и p2). Поскольку атмосферное давление зависит от погоды, интервал времени между измерениями должен быть возможно меньшим, а пункты измерения располагаться не слишком далеко друг от друга. Барометрическая формула записывается в этом случае в виде: Δh = 18400(1 + at)lg(p1 / p2) (в м), где t — средняя температура слоя воздуха между точками измерения, a — температурный коэффициент объёмного расширения воздуха. Погрешность при расчётах по этой формуле не превышает 0,1—0,5 % от измеряемой высоты. Более точна формула Лапласа, учитывающая влияние влажности воздуха и изменение ускорения свободного падения.
РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:
n = n0exp( -mgh / kT )
где n - концентрация молекул на высоте h, n0 - концентрация молекул на начальном уровне h = 0, m - масса частиц, g - ускорение свободного падения, k - постоянная Больцмана, T - температура.
концентрация молекул у дна сосуда оказывается выше, чем концентрация в верхней части сосуда. Под действием теплового движения молекулы подбрасываются вверх, а затем падают вниз за счет действия сил тяжести.
Если высота сосуда много меньше чем kT/mg, то зависимостью концентрации от высоты можно пренебречь. С другой стороны, в атмосфере концентрация молекул быстро уменьшается с увеличением высоты и, поэтому, величина атмосферного давления также уменьшается. Принимая во внимание, что P = nkT, мы можем записать так называемую барометрическую формулу, описывающую изменение атмосферного давления в зависимости от высоты:
P = P0exp( -mgh / kT )
Измеряя давление за бортом самолёта, мы можем вычислить при помощи барометрической формулы приблизительную высоту полёта.
11.
Средняя длина свободного пробега молекул
Под средней длиной свободного пробега понимают среднее расстояние, которое проходит молекула между двумя последовательными соударениями.
За
секунду молекула в среднем проходит
расстояние, численно равное ее средней
скорости
![]() .
Если за это же время она испытает в
среднем
.
Если за это же время она испытает в
среднем
![]() столкновений с другими молекулами, то
ее средняя длина свободного пробега
столкновений с другими молекулами, то
ее средняя длина свободного пробега
![]() ,
очевидно, будет равна
,
очевидно, будет равна
![]()
(3.1.1)
Предположим, что все молекулы, кроме рассматриваемой, неподвижны. Молекулы будем считать шарами с диаметром d. Столкновения будут происходить всякий раз, когда центр неподвижной молекулы окажется на расстоянии меньшем или равном d от прямой, вдоль которой двигается центр рассматриваемой молекулы. При столкновениях молекула изменяет направление своего движения и затем движется прямолинейно до следующего столкновения. Поэтому центр движущейся молекулы ввиду столкновений движется по ломаной линии (рис. 1).

рис. 1
Молекула
столкнется со всеми неподвижными
молекулами, центры которых находятся
в пределах ломаного цилиндра диаметром
2d.
За секунду молекула проходит путь,
равный
. Поэтому число происходящих за это
время столкновений равно числу молекул,
центры которых попадают внутрь ломаного
цилиндра, имеющего суммарную длину
и
радиус d.
Его объем примем равным объему
соответствующего спрямленного цилиндра,
т. е. равным
![]() Если в единице объема газа находится n
молекул, то число столкновений
рассматриваемой молекулы за одну секунду
будет равно
Если в единице объема газа находится n
молекул, то число столкновений
рассматриваемой молекулы за одну секунду
будет равно
![]()
(3.1.2)
В действительности движутся все молекулы. Поэтому число столкновений за одну секунду будет несколько большим полученной величины, так как вследствие движения окружающих молекул рассматриваемая молекула испытала бы некоторое число соударений даже в том случае, если бы она сама оставалась неподвижной.
Предположение
о неподвижности всех молекул, с которыми
сталкивается рассматриваемая молекула,
будет снято, если в формулу (3.1.2) вместо
средней скорости
представить
среднюю скорость относительного движения
![]() рассматриваемой
молекулы. В самом деле, если налетающая
молекула движется со средней относительной
скоростью , то молекула, с которой она
сталкивается, оказывается покоящейся,
что и предполагалось при получении
формулы (3.1.2). Поэтому формулу (3.1.2) следует
написать в виде:
рассматриваемой
молекулы. В самом деле, если налетающая
молекула движется со средней относительной
скоростью , то молекула, с которой она
сталкивается, оказывается покоящейся,
что и предполагалось при получении
формулы (3.1.2). Поэтому формулу (3.1.2) следует
написать в виде:
![]() (3.1.3)
(3.1.3)
Предположим,
что скорости молекул до столкновения
были
![]() и
и
![]() Тогда
Тогда
![]() Из треугольника скоростей имеем (рис.
2)
Из треугольника скоростей имеем (рис.
2)
![]() (3.1.4)
(3.1.4)
Так как углы и скорости и , с которыми сталкиваются молекулы, очевидно, являются независимыми случайными величинами, то среднее
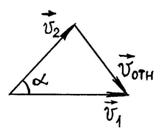 рис.
2
рис.
2
от произведения этих величин равно произведению их средних. Поэтому
 (3.1.5)
(3.1.5)
С учетом последнего равенства формулу (3.1.4) можно переписать в виде:
![]() (3.1.6)
(3.1.6)
так
как
![]() Cредняя
квадратичная скорость пропорциональна
средней скорости,
Cредняя
квадратичная скорость пропорциональна
средней скорости,
(3.1.7)
![]()
т.
е.
![]() .
.
Поэтому соотношение (3.1.6) можно представить так:
![]() (3.1.8)
(3.1.8)
С учетом последнего выражения формула для средней длины свободного пробега приобретает вид:
![]() (3.1.9)
(3.1.9)
Для
идеального газа
![]() . Поэтому
. Поэтому
![]() (3.1.10)
(3.1.10)
Отсюда видно, что при изотермическом расширении (сжатии) средняя длина свободного пробега растет (убывает).
Как было отмечено во введении, эффективный диаметр молекул убывает с ростом температуры. Поэтому при заданной концентрации молекул средняя длина свободного пробега увеличивается с ростом температуры.
Вычисление
средней длины свободного пробега для
азота (d
= 3•10-10 м), находящегося при нормальных
условиях (р = 1,01•105 Па, Т = 273,15 К) дает:
![]() ,
а для числа столкновений за одну секунду:
,
а для числа столкновений за одну секунду:
![]() . Таким образом, средняя длина свободного
пробега молекул при нормальных условиях
составляет доли микрон, а число
столкновений – несколько миллиардов
в секунду. Поэтому процессы выравнивания
температур (теплопроводность), скоростей
движения слоев газа (вязкое трение) и
концентраций (диффузия) являются
достаточно медленными, что подтверждается
опытом.
. Таким образом, средняя длина свободного
пробега молекул при нормальных условиях
составляет доли микрон, а число
столкновений – несколько миллиардов
в секунду. Поэтому процессы выравнивания
температур (теплопроводность), скоростей
движения слоев газа (вязкое трение) и
концентраций (диффузия) являются
достаточно медленными, что подтверждается
опытом.
12.
Диффузия лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму[1]. В некоторых ситуациях одно из веществ уже имеет выравненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (против градиента концентрации)
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения. Важную роль диффузия частиц играет в физике плазмы.
Обычно под диффузией понимают процессы, сопровождающиеся переносом материи, однако иногда диффузионными называют также другие процессы переноса: теплопроводность, вязкое трение и т. п.
Скорость протекания диффузии зависит от многих факторов. Так, в случае металлического стержня тепловая диффузия проходит очень быстро. Если же стержень изготовлен из синтетического материала, тепловая диффузия протекает медленно. Диффузия молекул в общем случае протекает ещё медленнее. Например, если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, если медь покрыть золотом, то будет происходить диффузия золота в медь, но при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет.
Общее описание
Все виды диффузии подчиняются одинаковым законам. Скорость диффузии пропорциональна площади поперечного сечения образца, а также разности концентраций, температур или зарядов (в случае относительно небольших величин этих параметров). Так, тепло будет в четыре раза быстрее распространяться через стержень диаметром в два сантиметра, чем через стержень диаметром в один сантиметр. Это тепло будет распространяться быстрее, если перепад температур на одном сантиметре будет 10 °C вместо 5 °C. Скорость диффузии пропорциональна также параметру, характеризующему конкретный материал. В случае тепловой диффузии этот параметр называется теплопроводность, в случае потока электрических зарядов — электропроводность. Количество вещества, которое диффундирует в течение определённого времени, и расстояние, проходимое диффундирующим веществом, пропорциональны квадратному корню времени диффузии.
Диффузия представляет собой процесс на молекулярном уровне и определяется случайным характером движения отдельных молекул. Скорость диффузии в связи с этим пропорциональна средней скорости молекул. В случае газов средняя скорость малых молекул больше, а именно она обратно пропорциональна квадратному корню из массы молекулы и растёт с повышением температуры. Диффузионные процессы в твёрдых телах при высоких температурах часто находят практическое применение. Например, в определённых типах электронно-лучевых трубок (ЭЛТ) применяется металлический торий, продиффундировавший через металлический вольфрам при 2000 °C.
Если в смеси газов масса одной молекулы в четыре раза больше другой, то такая молекула передвигается в два раза медленнее по сравнению с её движением в чистом газе. Соответственно, скорость диффузии её также ниже. Эта разница в скорости диффузии лёгких и тяжёлых молекул применяется, чтобы разделять субстанции с различными молекулярными весами. В качестве примера можно привести разделение изотопов. Если газ, содержащий два изотопа, пропускать через пористую мембрану, более лёгкие изотопы проникают через мембрану быстрее, чем тяжёлые. Для лучшего разделения процесс производится в несколько этапов. Этот процесс широко применялся для разделения изотопов урана (отделение 235U от основной массы 238U). Поскольку такой способ разделения требует больших энергетических затрат, были развиты другие, более экономичные способы разделения. Например, широко развито применение термодиффузии в газовой среде. Газ, содержащий смесь изотопов, помещается в камеру, в которой поддерживается пространственный перепад (градиент) температур. При этом тяжёлые изотопы со временем концентрируются в холодной области.
13.
Теплопроводность
Теплопроводность – это перенос тепла от одних частей тела к другим обусловленный разновидностью температур. С физической точки зрения это молекулярный перенос.
Если внутри тела или материала имеется разность температур, то тепловая энергия переходит от более горячей его части к более холодной и передаёт ей свою тепло. Данный вид теплопередачи, который обусловлен тепловыми движениями и столкновениями молекул, называется теплопроводность. При достаточно высоких температурах в твердых телах его можно наблюдать визуально.
Виды теплопроводности
Бывает:
-стационарная теплопроводность
-не стационарная теплопроводность
В теплотехнике, перенос тепловой энергии теплопроводностью зависит от нескольких параметров:
-от физических свойств тела
-от геометрических размеров
-от разности температур между телами
В общем случае процесс теплопереноса теплопроводностью сопровождается изменением температуры в пространстве и во времени.
Стационарное температурное поле – это если температура тела не изменяется с течением времени и зависит только от геометрических размеров тела.
Нестационарное температурное поле – это когда изменение температуры тела зависит от времени.
Количественная характеристика изменения температуры на бесконечно малом отрезке тела характеризует градиент температуры.
Градиент температуры математическими терминами – это предел изменения температуры к нормали, причём последнее стремиться к нулю.
Градиент – это вектор направленный к изометрической поверхности в сторону возрастания температуры и численно равен частной производной этой температуры по этому направлению.
Закон Фурье (закон переноса среды)
Этот закон устанавливает зависимость между количеством теплоты, проходящую через элементарную площадку, расположенную на изометрической поверхности за промежуток времени и градиент температуры.
Плотность теплового потока – это отношение количества теплоты проходящая через заданную поверхность.
Вектор плотности теплового потока прямопропорционален градиенту температуры и направлен в сторону её убывания на что показывает знак минус.
λ – коэффициент теплопроводности (Вт/м*градус)
Физический смысл коэффициента теплопроводности
Коэффициент теплопроводности численно равен тепловому потоку проходящему в единицу времени изометрической поверхности при едином градиенте температуры.
Коэффициента теплопроводности зависит от давления и температуры
Пример изменения коэффициента теплопроводности:
1.Металлы
λ = от 3 до 400 Вт/м*градус
С увеличением температуры коэффициент теплопроводности падает. Исключением является КОБАЛЬТ (Со) и БЕРИЛЛИЙ (Ве).
2.Теплоизоляционные материалы с пористой структурой
λ = от 0,02 до 3 Вт/м*градус
С увеличением температуры коэффициент теплопроводности возрастает. Также, на коэффициент теплопроводности влияет влажность.
3.Газы
λ = от 0,01 до 1 Вт/м*градус
С увеличением температуры коэффициент теплопроводности увеличивается.
4.Жидкости
λ = от 0,1 до 0,5 Вт/м*градус
С увеличением температуры коэффициент теплопроводности падает. Исключением является вода и глицерин.
Дифференциальное уравнение теплопроводности
Дифференциальное уравнение теплопроводности устанавливает связь между величинами которые осуществляют перенос теплоты.
Дифференциальное уравнение теплопроводности описываются двумя основными уравнениями:
1.Закон переноса среды (закон Фурье)
2.Закон сохранения соответствующего вида материи (закон сохранения энергии).
Оператор Лапласа – это изменение температуры по координате.
Для рассмотрения конкретного случая теплообмена необходимо знать конкретные условия протекания процесса, которые определяют условия однозначности.
Различают четыре условия однозначности
1.Геометрические условия – характеризует линейные размеры объекта (длинна, ширина, высота);
2.Физические условия – характеризуют материал (коэффициент теплопроводности, плотность, агрегатное состояние);
3.Временные условия (начальные) – характеризует распределение температуры в начальный момент времени;
4.Граничные условия – определяют условия взаимодействия на границах периода объекта.
Граничные условия делятся на:
-граничные условия первого рода – задаётся постоянное распределение температуры;
-граничные условия второго рода – определяют постоянную величину теплового потока;
-граничные условия третьего рода – определяются законом теплообмена между поверхностью и окружающей средой.
Пример теплопроводности: при нагревании арматуры с одного конца с помощью пламени газовой горелки, будет видно как нагреваемая часть арматуры становится горячей. Одновременно по длине арматуры будет передаваться тепловая энергия и если замерять температуру по всей длине арматуры, то будет видно, что при увеличении температуры одной части, противоположная часть будет также нагреваться. Это значит, что тепловая энергия передаётся по длине арматуры, и на некотором расстоянии от нагреваемого конца распространяется свечение (с удалением от места нагрева все менее интенсивное).
Интенсивность теплопередачи за счет теплопроводности зависит от градиента температуры, т.е. отношения DТ/Dx разности температур на концах арматуры к расстоянию между ними. Интенсивность теплопередачи зависит также от площади поперечного сечения стержня (в м2) и коэффициента теплопроводности материала [в соответствующих единицах Вт/( м2*градус)]. Соотношение между этими величинами было выведено французским математиком Ж.Фурье и имеет следующий вид:
q = – кА (∆Т / ∆х )
где:
q – тепловой поток;
k – коэффициент теплопроводности;
A – площадь поперечного сечения стержня;
Это соотношение называется как закон теплопроводности Фурье; знак «минус» обозначает на то, что тепловая энергия передается в направлении, обратном градиенту температуры, то есть от более нагретому к менее нагретому.
Из закона Фурье видно, что тепловой поток можно снизить, уменьшив одну из величин – коэффициент теплопроводности, площадь или градиент температуры.
Для отапливаемых зданий в зимних условиях площадь и градиент температуры практически постоянны, и следовательно для того чтобы в помещениях поддерживалась требуемая нормативная температура воздуха, остается только влиять на коэффициент теплопроводности, т.е. уменьшать теплопроводность наружных стен, или улучшать их теплоизоляцию.
Ниже таблице представлены коэффициенты теплопроводности некоторых веществ и материалов. Из этой таблицы видно, что одни металлы проводят тепло гораздо лучше других, но все они являются значительно лучшими проводниками тепла, чем воздух и пористые материалы.
Теплопроводность металлов обусловлена колебаниями кристаллической решетки и движением большого числа свободных электронов (называемых иногда как электронный газ). Движение электронов ответственно и за электропроводность металлов, а потому неудивительно, что хорошие проводники тепла (например, серебро или медь) являются также хорошими проводниками электрической энергии.
Тепловое и электрическое сопротивление многих веществ резко уменьшается при понижении температуры материала ниже температуры жидкого гелия (1,8 K). Это явление называется сверхпроводимость. Сверхпроводимость используется для повышения эффективности работы многих электрических и тепловых устройств – от приборов микроэлектроники, микросхем до линий электропередачи и больших электромагнитов.
14.
Явление внутреннего трения (вязкости) связано с возникновением сил трения между двумя слоями газа (или жидкости), перемещающимися параллельно друг другу с различными по величине скоростями. Причиной внутреннего трения является перенос молекулами количества движения из одного слоя газа к другому. Можно сказать: внутреннее трение - явление переноса количества движения от быстро движущихся к медленнее движущимся частям газа. В случае одномерной задачи V=V(x) уравнение внутреннего трения (вязкости) записывается в виде
F = -hdV/dx, (3.32)
которое называется уравнением Ньютона для вязкости и читается следующим образом: сила внутреннего трения при движении слоев в газе прямо пропорциональна градиенту скорости (dV/dx). Считается, что сила действует на единицу площади поверхностного слоя; градиент скорости направлен в перпендикулярном к поверхности слоя направлении и h (кг/м с) - коэффициент вязкости. Знак минуc в (3.32) указывает, что сила внутреннего трения направлена против градиента скорости. Согласно кинетической теории коэффициент вязкости пропорционален средней скорости теплового движения молекул; их средней длине свободного пробега и плотности газа. Коэффициент вязкости слабо зависит от давления и возрастает пропорционально корню квадратному из абсолютной температуры. Приведенная выше формула для ? определяет динамическую вязкость, которая равна силе внутреннего трения, действующей на единицу площади поверхностного слоя при градиенте скорости равном единице. Для описания внутреннего трения в жидкостях вводится величина, n = c /r , называемая кинематической вязкостью. Между коэффициентами переноса существует достаточно простая связь:
h = r D; c = r DCV; c = h CV. (3.33)
15.
Метод Пуазейля.* Этот метод основан на ламинарном течении жидкости в тонком капилляре. Рассмотрим капилляр радиусом R и длиной l. В жидкости мысленно выделим цилиндрический слой радиусом r и толщиной dr (рис. 54). Сила внутреннего трения (см. (31.1)), действующая на боковую поверхность этого слоя,

где dS — боковая поверхность цилиндрического слоя; знак минус означает, что при возрастании радиуса скорость уменьшается.
* Ж. Пуазейль (1799—1868) — французский физиолог и физик.
Для установившегося течения жидкости сила внутреннего трения, действующая на боковую поверхность цилиндра, уравновешивается силой давления, действующей на его основание:
![]()
После интегрирования, полагая, что у стенок имеет место прилипание жидкости, т. е. скорость на расстоянии R от оси равна нулю, получаем


Отсюда видно, что скорости частиц жидкости распределяются по параболическому закону, причем вершина параболы лежит на оси трубы (см. также рис. 53).
За время t из трубы вытечет жидкость, объем которой

откуда вязкость
![]()
16.
дной из важнейших задач аэро- и гидродинамики является исследование движения твердых тел в газе и жидкости, в частности изучение тех сил, с которыми среда действует на движущееся тело. Эта проблема приобрела особенно большое значение в связи с бурным развитием авиации и увеличением скорости движения морских судов.
На тело, движущееся в жидкости или газе, действуют две силы (равнодействующую их обозначим R), одна из которых (Rx) направлена в сторону, противоположную движению тела (в сторону потока), — лобовое сопротивление, а вторая (Ry) перпендикулярна этому направлению — подъемная сила (рис. 55).
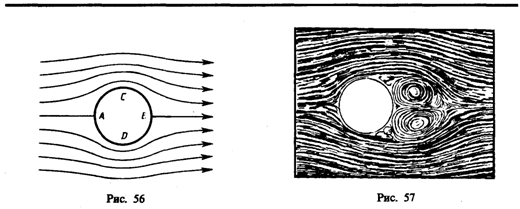
Если тело симметрично и его ось симметрии совпадает с направлением скорости, то на него действует только лобовое сопротивление, подъемная же сила в этом случае равна нулю. Можно доказать, что в идеальной жидкости равномерное движение происходит без лобового сопротивления. Если рассмотреть движение цилиндра в такой жидкости (рис. 56), то картина линий тока симметрична как относительно прямой, проходящей через точки А и В, так и относительно прямой, проходящей через точки С и D, т. с. результирующая сила давления на поверхность цилиндра будет равна нулю.
Иначе обстоит дело при движении тел в вязкой жидкости (особенно при увеличении скорости обтекания). Вследствие вязкости среды в области, прилегающей к поверхности тела, образуется пограничный слой частиц, движущихся с меньшими скоростями. В результате тормозящего действия этого слоя возникает вращение частиц и движение жидкости в пограничном слое становится вихревым. Если тело не имеет обтекаемой формы (нет плавно утончающейся хвостовой части), то пограничный слой жидкости отрывается от поверхности тела. За телом возникает течение жидкости (газа), направленное противоположно набегающему потоку. Оторвавшийся пограничный слой, следуя за этим течением, образует вихри, вращающиеся в противоположные стороны (рис. 57).
Лобовое сопротивление зависит от формы тела и его положения относительно потока, что учитывается безразмерным коэффициентом сопротивления Сx, определяемым экспериментально:
![]() (33.1)
(33.1)
где r — плотность среды; v — скорость движения тела; S — наибольшее поперечное сечение тела.
Составляющую Rx можно значительно уменьшить, подобрав тело такой формы, которая не способствует образованию завихрения.
Подъемная
сила может быть определена формулой,
аналогичной (33.1):![]()
где Су — безразмерный коэффициент подъемной силы.
Для крыла самолета требуется большая подъемная сила при малом лобовом сопротивлении (это условие выполняется при малых углах атаки a (угол к потоку); см. рис. 55). Крыло тем лучше удовлетворяет этому условию, чем больше величина К=Су/Сx называемая качеством крыла. Большие заслуги в конструировании требуемого профиля крыла и изучении влияния геометрической формы тела на коэффициент подъемной силы принадлежат «отцу русской авиации» Н. Е. Жуковскому (1847—1921).
17.
Ва́куум (от лат. vacuum — пустота) — среда, содержащая газ при давлениях значительно ниже атмосферного. Вакуум характеризуется соотношением между длиной свободного пробега молекул газа λ и характерным размером среды d. Под d может приниматься расстояние между стенками вакуумной камеры, диаметр вакуумного трубопровода и т. д. В зависимости от величины соотношения λ/d различают низкий (λ/d 1), средний (λ/d~1) и высокий (λ/d 1) вакуум.
Следует различать понятия физического вакуума и технического вакуума.
Технический вакуум.
На практике сильно разреженный газ называют техническим вакуумом. В макроскопических объёмах идеальный вакуум недостижим на практике, поскольку при конечной температуре все материалы обладают ненулевой плотностью насыщенных паров. Кроме того, многие материалы (в том числе толстые металлические, стеклянные и иные стенки сосудов) пропускают газы. В микроскопических объёмах, однако, достижение идеального вакуума в принципе возможно.
Мерой степени разрежения вакуума служит длина свободного пробега молекул газа < λ > , связанной с их взаимными столкновениями в газе, и характерного линейного размера l сосуда, в котором находится газ.
Строго говоря, техническим вакуумом называют газ в сосуде или трубопроводе с давлением ниже, чем в окружающей атмосфере. Согласно другому определению, когда молекулы или атомы газа перестают сталкиваться друг с другом, и газодинамические свойства сменяются вязкостными (при давлении около 1 Торр) говорят о достижении низкого вакуума (λ < < l) (1016 молекул на 1см³). Обычно низковакуумный насос стоит между атмосферным воздухом и высоковакуумным насосом, создавая предварительное разрежение, поэтому низкий вакуум часто называют форвакуум. При дальнейшем понижении давления в камере, увеличивается средняя длина свободного пробега λ молекул газа. При λ/d>>1 молекулы газа уже почти не сталкиваются друг с другом, а свободно перемещаются от стенки до стенки, в этом случае говорят о высоком вакууме (10−5 Торр) (1011 молекул на 1 см³). Сверхвысокий вакуум соответствует давлению 10−9 Торр и ниже. В сверхвысоком вакууме, например, обычно проводятся эксперименты с использованием сканирующего туннельного микроскопа. Для сравнения, давление в космосе на несколько порядков ниже, в дальнем же космосе и вовсе может достигать 10−16 Торр и ниже (1 молекула на 1 см³).
Высокий вакуум в микроскопических порах некоторых кристаллов достигается при атмосферном давлении, что связано именно с длиной свободного пробега газа.
Аппараты, используемые для достижения и поддержания вакуума, называются вакуумными насосами. Для поглощения газов и создания необходимой степени вакуума используются геттеры. Более широкий термин вакуумная техника включает также приборы для измерения и контроля вакуума, манипулирования предметами и проведения технологических операций в вакуумной камере, и т. д. Высоковакуумные насосы являются сложными техническими приборами. Основные типы высоковакуумных насосов это диффузионные насосы, основанные на увлечении молекул остаточных газов потоком рабочего газа, геттерные, ионизационные насосы, основанные на внедрении молекул газа в геттеры (например титан) и криосорбционные насосы (в основном для создания форвакуума).
Стоит отметить, что даже в идеальном вакууме при конечной температуре всегда имеется некоторое тепловое излучение (газ фотонов). Таким образом, тело, помещённое в идеальный вакуум, рано или поздно придёт в тепловое равновесие со стенками вакуумной камеры за счёт обмена тепловыми фотонами.
Физический вакуум
Под физическим вакуумом в современной физике понимают полностью лишённое массы пространство. Даже если бы удалось получить это состояние на практике, оно не было бы абсолютной пустотой. Квантовая теория поля утверждает, что, в согласии с принципом неопределённости, в физическом вакууме постоянно рождаются и исчезают виртуальные частицы: происходят так называемые нулевые колебания полей. В некоторых конкретных теориях поля вакуум может обладать нетривиальными топологическими свойствами, но не только, а также в теории могут существовать несколько различных вакуумов, различающихся плотностью энергии или другими физическими параметрами (в зависимости от применяемых гипотез и теорий).
Некоторые из этих предсказаний теории поля уже были успешно подтверждены экспериментом. Так, эффект Казимира[1] и лэмбовский сдвиг атомных уровней объясняется нулевыми колебаниями электромагнитного поля в физическом вакууме. На некоторых других представлениях о вакууме базируются современные физические теории. Например, существование нескольких вакуумных состояний (так называемых ложных вакуумов) является одной из главных основ инфляционной теории Большого взрыва.
Применение вакуума в науке и технике.
Области применения весьма широки. Практически ни одно технологически сложное производство не обходится без применения вакуума.
В электронной технике: осветительные лампы, газоразрядные, генераторные и сверхвысокочастотные приборы, телевизионные и рентгеновские трубки.
В производстве микросхем и приборов: нанесение тонких плёнок, ионное внедрение, плазмохимическое травление, электронолитографию.
В металлургии: плавка и переплав металлов в вакууме освобождает их от растворённых газов, что придаёт им высокую прочность, пластичность и вязкость.
Машиностроение: электроннолучевая сварка, диффузионная сварка, плазменная обработка.
Химическая промышленность: вакуумные сушильные аппараты, вакуумная пропитка, вакуумные фильтры.
Основной инструмент современной ядерной физики – ускоритель частиц – немыслим без вакуума. Поддержание почти космического вакуума требуется в установках для проведения экспериментов.
18.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Формулировка
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
![]()
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале μ, и работы A'[3], совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил
ΔU = Q − A + μΔN + A'.
Для элементарного количества теплоты δQ, элементарной работы δA и малого приращения dU внутренней энергии первый закон термодинамики имеет вид:
dU = δQ − δA + μdN + δA'.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что dU и dN являются полными дифференциалами, а δA и δQ — нет.
Первое начало термодинамики:
при изобарном процессе

при изохорном процессе (A = 0)

при изотермическом процессе (ΔU = 0)
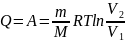
Здесь m— масса газа, M — молярная масса газа, CV — молярная теплоёмкость при постоянном объёме, p, V, T — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
Термодинамическими величинами называют физические величины, применяемые при описании состояний и процессов в термодинамических системах.
Термодинамика рассматривает эти величины как некоторые макроскопические параметры и функции, присущие системе, но не связанные с её микроскопическим устройством. Вопросы микроскопического устройства изучает статистическая физика.
Функции состояния
Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние.
Функции состояния в термодинамике включают:
температуру,
давление,
объём,
энтропию,
а также термодинамические потенциалы.
В зависимости от выбранной модели некоторые из этих величин, строго говоря, могут быть не функциями, а независимыми переменными.
Эти величины не являются независимыми. Связь между термодинамическими параметрами для конкретной системы называется уравнением состояния.
В случае, если известно каноническое уравнение состояния, задание любой пары параметров из следующих:
энтропия и объём,
энтропия и давление,
температура и объём,
температура и давление,
позволяет вычислить остальные два параметра.
Функции процесса
Функции процесса зависят не только от текущего состояния системы, но также и от пути, по которому система пришла в данное состояние.
Функции процесса в термодинамике включают:
количество теплоты и
термодинамическую работу.
Эти величины, однако, могут быть «превращены» в функции состояния с помощью интегрирующего множителя:
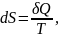 где
S
(энтропия) — функция состояния.
где
S
(энтропия) — функция состояния.PdV = δA, где P (давление) и V (объём) — функции состояния.
Работа в термодинамике — обобщение понятия «работа в механике» (выраженного в дифференциальной форме). Обобщённые координаты в термодинамике — это внешние параметры термодинамической системы (объём, напряжённость внешние магнитное или электрические поля и т. п.), а обобщённые силы (давление и др.) — величины, зависящие не только от координат, но и от внутренних параметров системы (температуры или энтропии). Работа термодинамической системы над внешними телами заключается в изменении состояния этих тел и определяется количеством энергии, передаваемой системой внешним телам при изменении внешних параметров системы. В квазистатических (т. е. бесконечно медленных) адиабатических процесса работа равна изменению внутренней энергии системы, в квазистатических изотермических процессах — изменению энергии Гелъмголъца. В ряде случае работа может быть выражена через другие термодинамические потенциалы. В общем случае величина работы при переходе системы из начального состояния в конечное зависит от способа (пути), каким осуществляется этот переход. Это означает, что бесконечно малая (элементарная) работа системы не является полным дифференциалом какой-либо функции состояния системы; поэтому элементарная работа обозначают обычно не dA (как полный дифференциал), а δA. Зависимость работы от пути приводит к тому, что для кругового процесса, когда система вновь возвращается в исходное состояние, работа системы может оказаться не равной нулю, что используется во всех тепловых двигателях. Работа внешних сил над системой δA = − δA, если энергия взаимодействия системы с внешними телами не меняется в процессе совершения работы.
Примерами работы при изменении одного из внешних параметров системы могут служить:
работа сил давления p при изменении объёма V системы δA = pdV,
работа сил поверхностного натяжения при изменении поверхности системы δA = − σdΣ, (σ — коэфф. поверхностного натяжения, dΣ — элемент поверхности);
работа намагничивания системы δA = − HdJ (H — напряжённость в магн. поля, J — намагниченность) и т. д.
Работа системы в неравновесном (необратимом) процессе всегда выше, чем в равновесном.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:

Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Другие определения
Массовая теплоёмкость (С) — это количество теплоты, которую необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которую необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (Сμ) — это количество теплоты, которую необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Теория теплоёмкости
Сравнение моделей Дебая и Эйнштейна для теплоёмкости твёрдого тела
Существует несколько теорий теплоёмкости твердого тела:
Закон Дюлонга — Пти и закон Джоуля — Коппа. Оба закона выведены из классических представлений и с определенной точностью справедливы лишь для нормальных температур (примерно от 15 °C до 100 °C).
Квантовая теория теплоёмкостей Эйнштейна. Первое применение квантовых законов к описанию теплоёмкости.
Квантовая теория теплоёмкостей Дебая. Содержит наиболее полное описание и хорошо согласуется с экспериментом.
Теплоёмкость системы невзаимодействующих частиц (например, газа) определяется числом степеней свободы частиц.
19.
Изохорный процесс. Изохорным процессом называется процесс, протекающий при неизменном объеме V и условии m = const и M = const.
При
этих условиях из уравнения состояния
идеального газа (26.7) для двух значений
температуры T0
и T
следует
 и
и
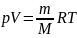
Или
![]() ,
,
![]()
Если
T0
выбрать равным 273 К (0 °С), то
 .
.
Обозначив
 ,
получим уравнение для изохорного
процесса
,
получим уравнение для изохорного
процесса
![]() ,
(26.9)
,
(26.9)
где
p
— давление газа при абсолютной температуре
T,
p0
— давление газа при температуре 0 °С, —
температурный коэффициент давления
газа, равный
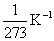 .
.
График уравнения изохорного процесса называется изохорой. Изохора, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (рис. 89).

Экспериментальным путем зависимость давления газа от температуры исследовал французский физик Жак Шарль (1746—1823) в 1787 г. Поэтому уравнение (26.9) называется законом Шарля.
Изохорный процесс можно осуществить, например, нагреванием воздуха при постоянном объеме.
20.
Изобарный процесс. Изобарным процессом называется процесс, протекающий при неизменном давлении p и условии m = const и M = const.
Таким же способом, как это было сделано для изохорного процесса, можно получить для изобарного процесса уравнение
![]()
, (26.10)
где
V
— объем газа при абсолютной температуре
T,
V0
— объем газа при температуре 0 °С;
коэффициент α, равный
 ,
называется температурным коэффициентом
объемного расширения газов.
,
называется температурным коэффициентом
объемного расширения газов.
График уравнения изобарного процесса называется изобарой. Изобара, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается объем газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (рис. 90).

Экспериментальное исследование зависимости объема газа от температуры провел в 1802 г. французский физик Жозеф Гей-Люссак (1778—1850). Поэтому уравнение (26.10) называется законом Гей-Люссака.
Изобарный процесс происходит, например, при нагревании или охлаждении воздуха в стеклянной колбе, соединенной со стеклянной трубкой, отверстие в которой закрыто небольшим столбом жидкости
21.
Изотермический процесс. Изотермическим процессом называется процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа (26.7) следует, что при постоянной температуре T и неизменных значениях массы газа и его молярной массы M произведение давления p газа на его объем V должно оставаться постоянным:
pV=Const. (26.8)
Изотермический процесс можно осуществить, например, путем изменения объема газа при постоянной температуре.
График изотермического процесса называется изотермой. Изотерма, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объем, является гиперболой (рис. 88).
У равнение
(26.8), устанавливающее связь между
давлением и объемом газа при постоянной
температуре, было получено из эксперимента
до создания молекулярно-кинетической
теории газов в 1662 г. английским физиком
Робертем Бойлем (1627 — 1691) и в 1676 г.
французским физиком Эдмом Мариоттом
(1620—1684). Поэтому это уравнение называют
законом Бойля — Мариотта.
равнение
(26.8), устанавливающее связь между
давлением и объемом газа при постоянной
температуре, было получено из эксперимента
до создания молекулярно-кинетической
теории газов в 1662 г. английским физиком
Робертем Бойлем (1627 — 1691) и в 1676 г.
французским физиком Эдмом Мариоттом
(1620—1684). Поэтому это уравнение называют
законом Бойля — Мариотта.
22.
Адиабатный процесс в идеальном газе. Q = mc2, (1)
Так как при адиабатном процессе из вне энергия не поступает, то изменение параметров газа происходит за счет перераспределения масс эфира между межмолекулярной областью и областью молекул.
При адиабатном расширении газ совершает работу, что связано с поступлением эквивалентного количества тепловой энергии (в виде массы эфира) в область молекул [1]. Так как из вне энергия не поступает, то она берется из межмолекулярной области, объем которой к тому же еще и увеличивается. Уменьшение массы эфира в межмолекулярной области при увеличении объема ее приводит к уменьшению плотности эфира в этой области, что согласно (2) и приводит к спаду давления. Причем этот спад более значительный по сравнению с изотермическим спадом, так как при изотермическом расширении уменьшение давления происходит только в связи с увеличением объема. Кроме этого, уменьшение массы эфира в межмолекулярной области при том же количестве молекул приводит к понижению температуры [1].
При адиабатном сжатии совершается работа над газом, что связано с выделением эквивалентного количества тепловой энергии (в виде массы эфира) из области молекул в межмолекулярную область [1]. Увеличение массы эфира в межмолекулярной области при уменьшении
объема ее приводит к увеличению плотности эфира в этой области, что согласно (2) и приводит к увеличению давления. Кроме этого, увеличение массы эфира в межмолекулярной области при том же количестве молекул приводит к повышению температуры [1].
24.
Обратимые и необратимые процессы
В изолированной термодинамической системе через некоторый промежуток времени устанавливается внутреннее равновесие, при котором рабочее тело по всей массе имеет одинаковую температуру и давление.
При равенстве давлений в системе и в окружающей среде изменение объема рабочего тела прекращается, и передача энергии в форме работы отсутствует (система находится в механическом равновесии со средой). Равенство температур рабочего тела и среды обеспечивает термическое равновесие. При этом между системой и окружающей средой не возникает передачи энергии в форме теплоты. Термодинамический процесс возможен только при нарушении механического или термического равновесия, и чем сильнее нарушается равновесие, тем быстрее протекает процесс. Все реальные термодинамические системы не изолированы от окружающей среды, которая выводит их из равновесия. Поэтому они являются неравновесными. Учитывая чрезвычайную сложность теплотехнических расчетов таких процессов, на практике их заменяют равновесными, то есть такими, при которых система проходит последовательно бесчисленное множество равновесных состояний. Эти равновесные процессы называют квазистатическими.
Для любой термодинамической системы можно представить два состояния, между которыми будет проходить два процесса: один от первого состояния ко второму и другой, наоборот, от второго состояния к первому. Первый процесс называют прямым, второй — обратным. Если после прямого процесса 1—2 следует обратный 2—1 и при этом термодинамическая система возвращается в исходное состояние, то такие процессы принято считать обратимыми. При обратимых процессах система в обратном процессе проходит через те же равновесные состояния, что и в прямом процессе. При этом ни в окружающей среде, ни в самой системе не возникает никаких остаточных явлений, то есть не имеет значения идет процесс А-В или В-А (рис. 5.1).
Различают механически и термически обратимые процессы.
В механически обратимом процессе обмен энергией между системой и окружающей средой протекает в форме работы при бесконечно малой разности давлений.
В термически обратимом процессе термодинамическая система обменивается с окружающей средой энергией в форме теплоты при бесконечно малой разности температур.
Любой равновесный термодинамический процесс изменения состояния рабочего тела будет всегда обратимым. Обратимые процессы являются идеальными.
Действительные термодинамические процессы совершаются при конечной разности давлений и температур рабочего тела и окружающей среды и поэтому являются неравновесными. Такие процессы необратимы.
Необратимый термодинамический процесс – это процесс, при котором система не возвращается в исходное состояние после обратного процесса. Все необратимые процессы протекают в направлении достижения в термодинамической системе равновесия, то есть выравнивания в ней давлений, температур, концентраций.
От греческого entropia -- поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии. Энтропия широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого -- либо макроскопического состояния; в теории информации -- мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Все эти трактовки энтропии имеют глубокую внутреннюю связь.
Энтропия -- это функция состояния, то есть любому состоянию можно сопоставить вполне определенное (с точность до константы -- эта неопределенность убирается по договоренности, что при абсолютном нуле энтропия тоже равна нулю) значение энтропии.
Для обратимых (равновесных) процессов выполняется следующее математическое равенство (следствие так называемого равенства Клаузиуса)
 ,
где δQ
подведенная теплота, T-
температура, A
и B-
состояния, SA
и SB-
энтропия, соответствующая этим состояниям
(здесь рассматривается процесс перехода
из A
состояния в состояние B).
,
где δQ
подведенная теплота, T-
температура, A
и B-
состояния, SA
и SB-
энтропия, соответствующая этим состояниям
(здесь рассматривается процесс перехода
из A
состояния в состояние B).
Для необратимых процессов выполняется неравенство, вытекающее из так называемого неравенства Клаузиуса
 ,
где δQ
- подведенная теплота, T-
температура, A
и B-
состояния, SA
и SB
- энтропия, соответствующая этим
состояниям.
,
где δQ
- подведенная теплота, T-
температура, A
и B-
состояния, SA
и SB
- энтропия, соответствующая этим
состояниям.
Поэтому энтропия адиабатически изолированной (нет подвода или отвода тепла) системы при необратимых процессах может только возрастать.
Используя понятие энтропии Клаузиус (1876) дал наиболее общую формулировку 2-го начала термодинамики: при реальных (необратимых) адиабатических процессах энтропия возрастает, достигая максимального значения в состоянии равновесия (2-ое начало термодинамики не является абсолютным, оно нарушается при флуктуациях).
Подводим итог: Что бы мы не делали -- энтропия увеличивается, следовательно любыми своими действиями мы увеличиваем хаос, и, следовательно, приближаем "конец света". Вероятно, можно точно подсчитать, когда он, то есть "конец света", наступит, но я думаю, что ближайшие несколько миллиардов лет можно об этом не беспокоиться.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Формулировки
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло Q1 у нагревателя, отдав Q2 холодильнику и совершив при этом работу A = Q1 − Q2. После этого воспользуемся процессом Клаузиуса и вернем тепло Q2 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S(T,x,N), называемая энтропией, такая, что ее полный дифференциал dS = δQ / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
Ограничения
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала.
