
- •1. Основные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •2. Классификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •Толщина окисных пленок на железе и меди
- •3. Стадии окисления металла. Физическая и химическая адсорбция.
- •4. Эпитаксильный рост оксидной пленки. Псевдоморфный слой.
- •5. Законы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •Кинетика окисления
- •Образование очень тонких пленок
- •6. Виды напряжений и разрушений в оксидных пленках. Причины вызывающие их.
- •Причины разрушения оксидных пленок в процессе их роста.
- •7. Ионно-электронный механизм окисления Ме (т. Вагнера)
- •8. Оксидные пленки на железе и стали (состав, структура, свойства)
- •9. Жаростойкость и теории жаростойкого легирования металлов. Жаростойкие защитные покрытия
- •10. Коррозия металлов в диссоциирующих газах
- •11. Электролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •12. Работа микрогальванического элемента. Процессы, происходящие на электродах.
- •13. Причины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •14. Положение элементов в ряду стандартных потенциалов.
- •15.Явление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •16. Пассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •17. Анодная поляризационная диаграмма, ее характеристика и применение.
- •18. Электрохимическая защита металлов. Протекторная защита. Катодная защита.
- •19. Влияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры
- •Влияние скорости движения электролита
- •20. Коррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •21. Термический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •Термический перенос массы
- •22. Влияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Процессы, обусловленные наличием неметаллических компонентов.
- •23. Способы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •24. Совместимость как один из критериев при выборе конструкционных материалов для яэу.
8. Оксидные пленки на железе и стали (состав, структура, свойства)
Структура и св-ва различных окисных слоев на примере Fe
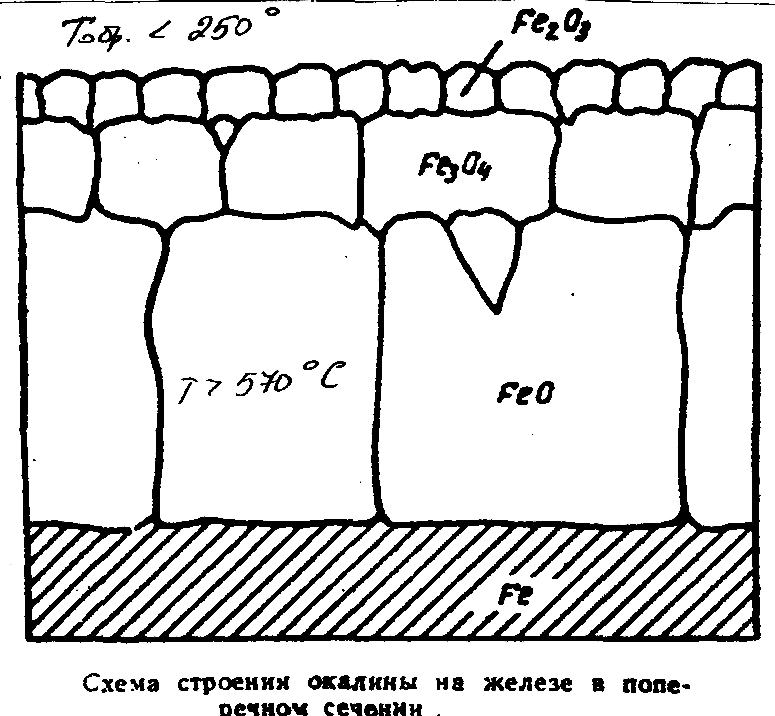

При высокотемпературном окислении Fe может образовывать неск. тв. фаз.
-тв р-р О2 в Fe (<0.001%)
-FeO вюстит
-Fe3O4 магнетит
-Fe2O3 гематит
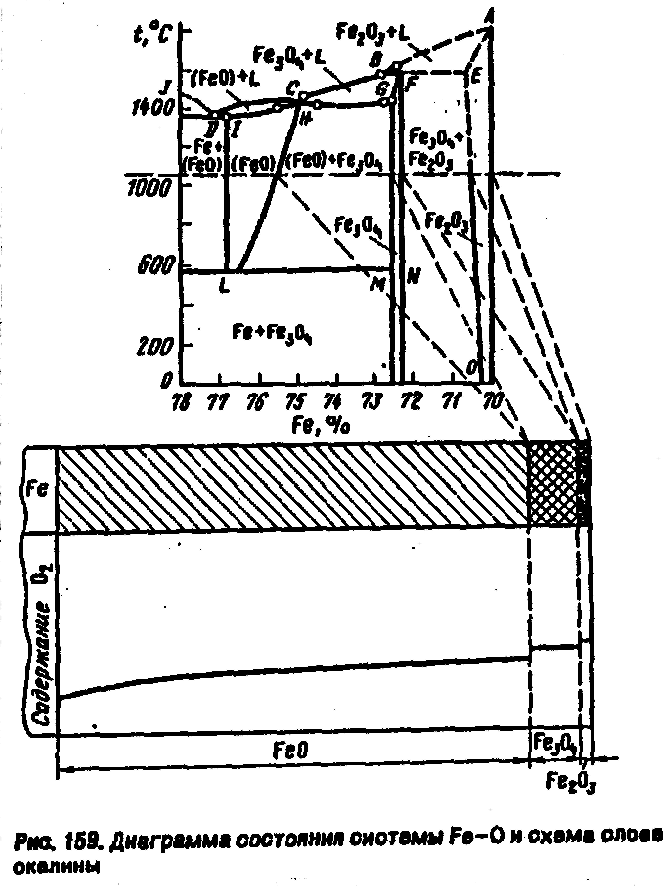
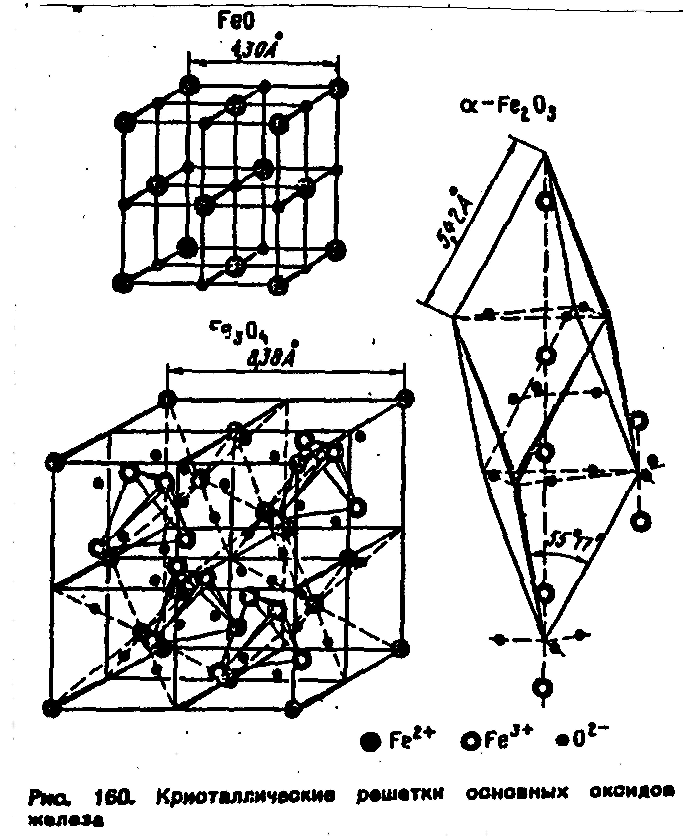
Вюстит
п/п р-типа ГЦК типа NaCl. Большая концентрация катионных дефектов, через которые диффундируют преимущественно катионы Fe.
Недостаток ионов Ме вызавает части
ионов Fe![]() до Fe
до Fe![]() .
При Т<570º С FeO неустойчив
и распадаеца по реакции
.
При Т<570º С FeO неустойчив
и распадаеца по реакции
4Fe --> Fe3O4 + Fe
Образование значительного кол-ва FeO
в защитн. пленках способствует
![]() их защитн. св-в и при нагреве даже в
течении короткого времени на пов-ти
обр. толстый слой окалины.
их защитн. св-в и при нагреве даже в
течении короткого времени на пов-ти
обр. толстый слой окалины.
Если О2 растворяется в сплаве при его окислении, то менее благородный компонет обр. окисл. внутри сплава. При этом под пов-тью раздела между сплавом и окалиной могут образоваться окислые прослойки (субокалина). Для такого внутр. окисления требуется, чтобы скор. диффузии О2 в сплаве >> скорости диффузии легирующего элемента.
Если один из компонентов сплава образует легкоплавкий оксид, то в процессе окисления может образоваться жидкая окислая фаза.
Тпл MoO3=1068 K ; Тпл V2O5=947K
Это может привести к быстрому разрушению сплава, наз. катастрофическое окисление
Двойные окислы в окалине
Часто образующиеся при окислении сплавов двойные окислы Ме2О4 бывают устойчивее простых окислов компонентов сплава и благодаря этому появляются в окалине. Так, при окислении
легированных сталей возникают двойные окислы типа шпинели : FeCr2O4, FeAl2O4, NiFe2O4, NiCr2O4 и др., что обычно повышает жаростойкость сплава и обусловлено слабой диффузией металлов и кислорода через решетку шпинели.
В элементарной ячейке шпинели с 32 ионами
О2- имеются 32 октаэдрические и 64
тетраэдрическне пустоты, причем
окта-эдрические пустоты больше
теграэдрических. В нормальных шпинелях
(рис. 67) 16 октаэдрнческих пустот замещены
ионами Me2+ и 8 тетраэдрических пустот -
ионами Ме2+. Эти ионы могут быть ионами
одного и того же металла с валентностью
2 и 3 (например, в магнетите Fe3O4 или
![]() )
и ионами двух разных металлов, образующих,
таким образом, двойной окисел.
)
и ионами двух разных металлов, образующих,
таким образом, двойной окисел.
Диффузия ионов, обусловливающая рост окалины при окислении сплава, осуществляется по вакантным окта- и тетраэдрическим междоузлиям.
Двойные окислы, по-видимому, появляются, когда потоки диффундирующих сквозь образующуюся окалину ионов металлов доставляют эти ионы в какую-либо зону (слой) окалины в количествах, соответствующих стехиометрическому составу данного двойного окисла.
Р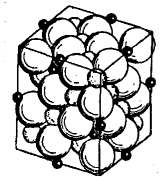 ис.
67, Структура решетки шпинели:
ис.
67, Структура решетки шпинели:
большие белые шары -ионы О2-, шары меньших размеров - ноны металла в окта-эдрических узлах; маленькие черные шарики - ноны металла в тетраэдрических узлах
9. Жаростойкость и теории жаростойкого легирования металлов. Жаростойкие защитные покрытия
Теории жаростойкого легирования
1 Ионы легир. компонента входят в решетку окисла осн. Ме, уменьшая его деффектность и, соотв, скорость диффузии в решетке.
2 Легир. компонент обр. на пов-ти сплава свой защитный оксид, препятств. окислению осн. Ме.
3 Легир. компонент с осн. Ме обр. двойные оксиды типа шпинелей, обл. повышенными защитными св-ми
1 Т Вагнера и Хауффе
По этой th малая добавка легир. элем. окисляется с образованием ионов опред. валентности и растворяясь в оксиде осн. Ме в нем конц. дефектов решетки
Это: приводит к скор. окисления, контролируемой диффузией катионов. Скор диф-ии зависит от конц. деф. решетки оксида - межуз. катионов в оксидах с избытком Ме. или катионных V в оксидах с недостатком Ме
Требование к легир. элементу :
- необходимость большего сродства к О2, чем у осн. Ме: (∆G)Ме*О<(∆G)МеО
- необходимость раств-ти его окида в оксиде осн. Ме
- при легир-ии Ме, обр-щих оксиды с избытком Ме валентность ионов легир. элемента должна удов. нер-ву n*>n
- при легир-ии Ме, обр-щих оксиды с недостатком Ме валентность ионов легир. элемента должна удов. нер-ву n*<n
- при ву n*=n необходимо, чтобы r*u<ru
2 Т Смирнова и Томашова
Требования к легир эл-ту
- оксид легир. эл-та должен удов. усл-ию сплошности, т.е. Vок/Vме>1
- легир элем должен иметь большее сродство к О2, чем осн. Ме
- размер ионов легир элемента должен быть меньше, чем у осн. Ме (r*u<ru)
- легир элем. должен обр-ть оксид с высоким
эл-сопр затруд. движение в нем i![]() и
e
и
e![]()
- оксид легир. элем. должен иметь высокие tºвозгонки (испарения) и не образовывать низкоплавких эвтектик в смеси с др. оксидами
- легир и осн. комп. должны обр. тв. р-р, что обеспечит образование сплощной и ровной пленки оксида на всей пов-ти сплава
3 Т образования высокозащитных оксидов Данкова, Архарова и Корнилова
Оптимальными по этой th явл. такие легир. элем., кот возм-ть образования малозащитной вюститной фазы и благоприятствуют образованию двойных окислов шпинельной стр-ры с малым. парам. решетки FeCl2O4; FeAl2O4; NiFeO4; NiClO4
