
- •1. Основные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •2. Классификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •Толщина окисных пленок на железе и меди
- •3. Стадии окисления металла. Физическая и химическая адсорбция.
- •4. Эпитаксильный рост оксидной пленки. Псевдоморфный слой.
- •5. Законы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •Кинетика окисления
- •Образование очень тонких пленок
- •6. Виды напряжений и разрушений в оксидных пленках. Причины вызывающие их.
- •Причины разрушения оксидных пленок в процессе их роста.
- •7. Ионно-электронный механизм окисления Ме (т. Вагнера)
- •8. Оксидные пленки на железе и стали (состав, структура, свойства)
- •9. Жаростойкость и теории жаростойкого легирования металлов. Жаростойкие защитные покрытия
- •10. Коррозия металлов в диссоциирующих газах
- •11. Электролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •12. Работа микрогальванического элемента. Процессы, происходящие на электродах.
- •13. Причины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •14. Положение элементов в ряду стандартных потенциалов.
- •15.Явление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •16. Пассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •17. Анодная поляризационная диаграмма, ее характеристика и применение.
- •18. Электрохимическая защита металлов. Протекторная защита. Катодная защита.
- •19. Влияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры
- •Влияние скорости движения электролита
- •20. Коррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •21. Термический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •Термический перенос массы
- •22. Влияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Процессы, обусловленные наличием неметаллических компонентов.
- •23. Способы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •24. Совместимость как один из критериев при выборе конструкционных материалов для яэу.
19. Влияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры
К основным внешним факторам относятся:
-Состав коррозионной среды(РН, ингибиторы ,стимуляторы)
-Условия коррозии
-температура
-давление
-скорость движения среды
-внешняя поляризация
-ультразвуковое облучение
Влияние состава и свойств среды.
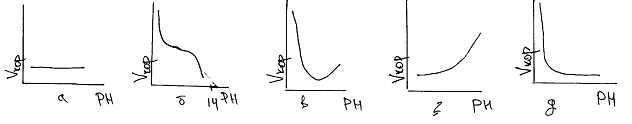
Примеры зависимостей К=f(РН) приведены на рисунках. Для благородных Ме характерна высокая коррозионная стойкость в кислых, нейтральных, и щелочных средах, т.е. скорость коррозии для этих Ме не зависит от РН (рис а). К металлам малостойким в кислых средах, относятся железо, магний, медь , марганец (рис б). При невысоких РН скорость их разрушения велика: легко выделяется водород, продукты выделяющиеся в результате коррозии, растворимы. при РН 4,0-8,5 скорость коррозии этих Ме постоянна, так как в этих условиях не меняется растворимость кислорода, основного катодного деполяризатора
Цинк , алюминий олово , свинец, устойчивы в нейтральных средах, но разрушаются в щелочных и кислых средах(рис 3). Неустойчивость этих Ме в щелочных и кислых средах объясняется их амфотерностью, т.е. растворимостью оксидов этих металлов в кислотах и щелочах. к Ме устойчивым в кислых но неустойчивым в щелочных средах, относятся молибден , тантал, вольфрам (рис 4). К Ме мало стойким в кислых средах относится никель, кадмий(рис 5)
 Влияние
давления на скорость коррозии
Влияние
давления на скорость коррозии
основная причина влияния давления на скорость электрохимической реакции изменение растворимости газа, участвующего в этом процессе. Поэтому при увеличении давления увеличивается скорость , процессов идущих с кислородной деполяризацией, и давление не влияет на процессы идущие с водородной деполяризацией. Другой возможной причиной влияния давления- возникновение механических напряжений в Ме, ускоряющих коррозиюю
Влияние скорости движения электролита
Коррозионный процесс при кислородной деполяризации в значительной степени зависит от скорости движения теплоносителя сначала при увеличение скорости движения , скорость коррозии резко растет так как увеличивается подвод кислорода к микрокактодам поверхности. при увеличении скорости движения теплоносителя концентрация кислорода у поверхности Ме увеличивается, до значений при которых происходит пассивация анодов, из за образования на них оксидных пленок, что уменьшает скорость коррозии.
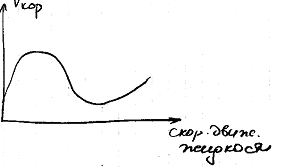
дальнейшее увеличение скорости движения теплоносителя приводит к омыванию оксидной пленки, что приводит к увеличению скорости коррозии
20. Коррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
На характер протекания коррозионных процессов в пароводяных теплоносителях оказывают влияния следующие факторы:
1.Влияние состава теплоносителя для металлов , окислы которых растворимы как в кислой так и в щелочной среде
2.Зависимость скорости коррозии от PH среды
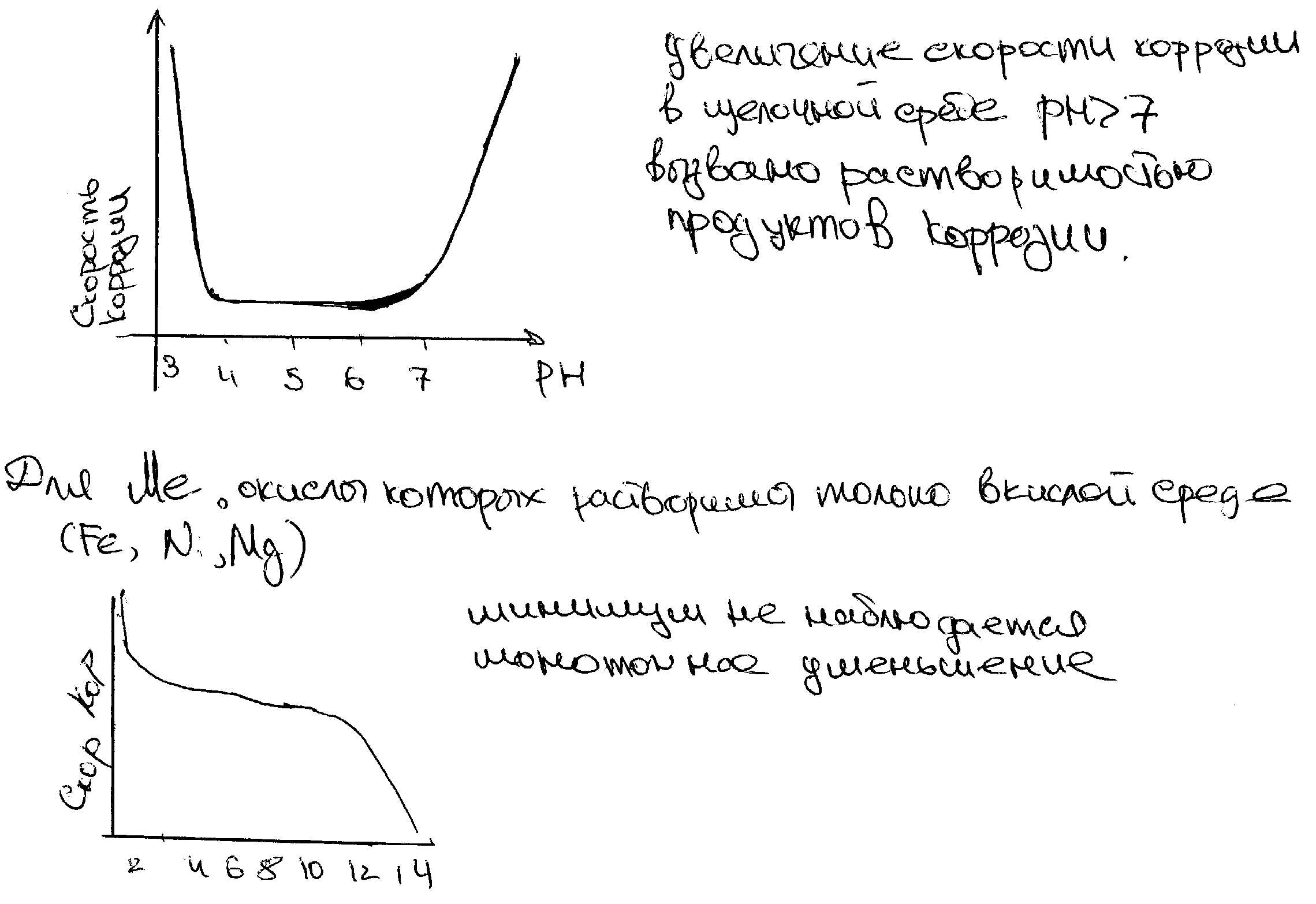
кислород с одной стороны , играет роль деполяризатора, ускоряя коррозию, с другоой может окислять материал анода , создавая анодную поляризацию, что резко снижает скорость коррозии . таким образом ,необходимо либо понизить концентрацию кислорода в теплоносителе, либо повысить ее до величины соответствующей пассивному состоянию анода. Но так как кислород усиливает межкристаллитную коррозию и коррозионное растрескивание, то снижают его концентрацию в воде до 0,01 мг/л с помощью добавок водорода , присутствие в воде ионов Cl вызывает диппасиввацию пов-ти металла и приводит к появлению местной коррозии (питтинг), что ведет к разгермитизации оболечек твэлов . Допустимое содержание хлора меньше 0,1 мг/л так как механические соединения элементов конструкции не всегда достаточно плотные , то в образующихся щелях и зазорах состав водного теплоносителя может существенно отличаться от остальной части системы. В щели среда быстрее насыщается продуктами коррозии и в ее полость затрудненно поступление кислорода. это создает концентрационный коррозионный элемент , приводящий к коррозии внутри щели. В зазоре может возникнуть концентрация ионов в металле более высокая , чем в окружающей среде , например вращающаяся втулка и вал.

возникающие разности потенциалов вызывают коррозионный ток , направление которого определяет место появления , и осаждения коррозии. Коррозия начинается в устье щели. Скорость воды в зазоре должна быть достаточно высокой, чтобы предотвратить возможность появления разности концентрации ионов. В узких зазорах и щелях затруднен доступ коррозионных агентов и пассиваторов из обьема электролита в зазор и
