
- •1. Основные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •2. Классификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •Толщина окисных пленок на железе и меди
- •3. Стадии окисления металла. Физическая и химическая адсорбция.
- •4. Эпитаксильный рост оксидной пленки. Псевдоморфный слой.
- •5. Законы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •Кинетика окисления
- •Образование очень тонких пленок
- •6. Виды напряжений и разрушений в оксидных пленках. Причины вызывающие их.
- •Причины разрушения оксидных пленок в процессе их роста.
- •7. Ионно-электронный механизм окисления Ме (т. Вагнера)
- •8. Оксидные пленки на железе и стали (состав, структура, свойства)
- •9. Жаростойкость и теории жаростойкого легирования металлов. Жаростойкие защитные покрытия
- •10. Коррозия металлов в диссоциирующих газах
- •11. Электролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •12. Работа микрогальванического элемента. Процессы, происходящие на электродах.
- •13. Причины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •14. Положение элементов в ряду стандартных потенциалов.
- •15.Явление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •16. Пассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •17. Анодная поляризационная диаграмма, ее характеристика и применение.
- •18. Электрохимическая защита металлов. Протекторная защита. Катодная защита.
- •19. Влияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры
- •Влияние скорости движения электролита
- •20. Коррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •21. Термический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •Термический перенос массы
- •22. Влияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Процессы, обусловленные наличием неметаллических компонентов.
- •23. Способы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •24. Совместимость как один из критериев при выборе конструкционных материалов для яэу.
18. Электрохимическая защита металлов. Протекторная защита. Катодная защита.
Сущность методов защиты состоит в их катодной поляризации, которая осуществляется одним из двух способов:
- при помощи протекторов
- при помощи внешнего тока
С помощью протекторов, играющих роль активнх анодов создается гальваническая цепь, в которой защищаемый Ме становиться катодом. Защита Fe достигается соединением его с менее благородным электродом т.е. с более отрицательным потенциалом (Al, Mg, Zn) для защиты Cu и Cu- сплавов м.б. использовать Fe как более электроотрицательный.
Роль протекторной защиты сводиться к тому, чтобы все анодные участки на поверхности Ме, превратились в катодные.
Ее применяют для крупных сооружений, нефтехранилищ, танкеров, эл. кабелей, водопроводных труб, кораблей и вся конструкция становиться катодной. Эффективность протекторной защиты и радиус действия протектора зависит от электропроводности среды и общей разности потенциалов между протектором и защищаемым Ме. (при использовании Zn – протектора, радиус действия в дистиллированной воды r=10 см р-р 0.01% NaCl r=10 см , р-р 3% NaCl r= 60 см)
Чем больше разность начального потенциалов протектора и Ме, тем больше радиус действия протектора.
На S=1000м2 защищаемых в морской воде поверхности площадь пов-ти протектора равна 1 м2.
На Zn и на Al образуется со временем слой нерастворимых в воде продуктов коррозии, которая понижает эффективность протектора. Против этого вокруг протектора создают среду, в которой раствориться эта пленка, для Zn это глина или гипс, для Al – гидрат оксид Ca.
Из поляризационной диаграммы (Zn и Al) можно увидеть, что используя внешний ток, можно заполяризовать катод до потенциала анода, который он имеет в разомкнутой цепи, то оба электрода достигнут одинакового потенциала и коррозия Zn (анода) не будет. Это утверждение является основой катодной защиты Ме, как одного из наиболее хороших способов понижения скорости коррозии до нуля.
Защита осуществляется с помощью подачи анодного тока коррозируемому Ме, на поверхности которого действуют.
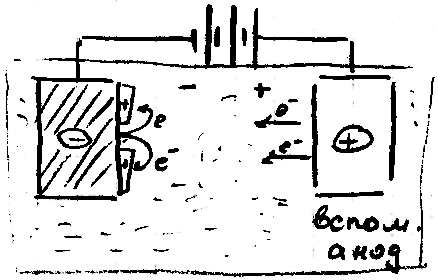
Катодная защита возможна только , если защита возможна только, если защищаемая конструкция и вспомогательный анод находятся в электронном и электролитическом контакте. Электроны, потребляемые в катодном процессе, поставляются на коррозию Ме, с внешним источником тока. Ток направляется от вспомогательного анода в катодные и анодные участки коррозируемых элементов и возвращаются к источникам поступающего тока. Когда катодные участки заполиризовываются внешним током до потенциала анода, то вся металлическая поверхность находиться под одним и тем же потенциалом, локальный ток больше не протекает и Ме не коррозирует.
Если Ме заполяризовать чуть выше потенциала анода, то скорость коррозии так же равна нулю. Но в то же время, это может приносить вред, т.к. может начаться растворение анода.
На практике приложенный ток поддерживают
близко теоретическому минимуму. Если
приложенный ток будет меньше, чем это
необходимо для полной защиты, происходит
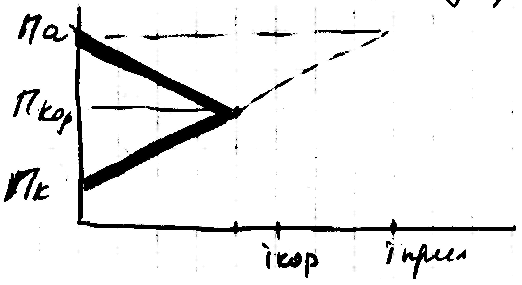
частичная защита. Если Пк сместить от
с до е наложением тока ве, ток коррозии
уменьшиться от
![]() до
до
![]() .
Общий ток = Iкор+Iприл=ае
.
Общий ток = Iкор+Iприл=ае
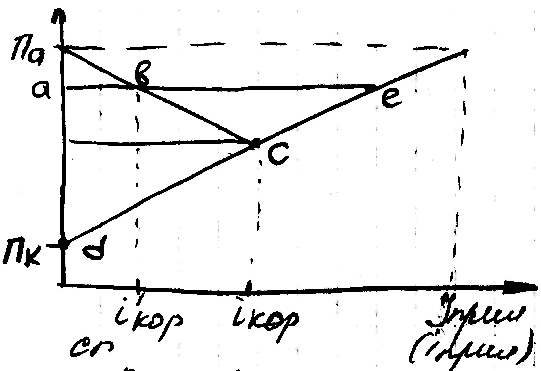
По мере повышения внешнего тока ве
смещается к более отрицательным значениям
и ток коррозии ав становиться меньше.
В пределе, когда Па=а ток коррозии ав
становиться =0, а ток полной катодной
защиты =
![]() .
.
Степень поляризации зависит не только от природы Ме и электролита, но и от площади коррозирующего эл-да. Если анодная площадь коррозирующего Ме очень мала, например в порах пленки, покрывающей поверхность, то может произойти значительная
