
- •1. Основные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •2. Классификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •Толщина окисных пленок на железе и меди
- •3. Стадии окисления металла. Физическая и химическая адсорбция.
- •4. Эпитаксильный рост оксидной пленки. Псевдоморфный слой.
- •5. Законы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •Кинетика окисления
- •Образование очень тонких пленок
- •6. Виды напряжений и разрушений в оксидных пленках. Причины вызывающие их.
- •Причины разрушения оксидных пленок в процессе их роста.
- •7. Ионно-электронный механизм окисления Ме (т. Вагнера)
- •8. Оксидные пленки на железе и стали (состав, структура, свойства)
- •9. Жаростойкость и теории жаростойкого легирования металлов. Жаростойкие защитные покрытия
- •10. Коррозия металлов в диссоциирующих газах
- •11. Электролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •12. Работа микрогальванического элемента. Процессы, происходящие на электродах.
- •13. Причины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •14. Положение элементов в ряду стандартных потенциалов.
- •15.Явление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •16. Пассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •17. Анодная поляризационная диаграмма, ее характеристика и применение.
- •18. Электрохимическая защита металлов. Протекторная защита. Катодная защита.
- •19. Влияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры
- •Влияние скорости движения электролита
- •20. Коррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •21. Термический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •Термический перенос массы
- •22. Влияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Процессы, обусловленные наличием неметаллических компонентов.
- •23. Способы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •24. Совместимость как один из критериев при выборе конструкционных материалов для яэу.
16. Пассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
Пассивность Ме.
- это состояние относительно высокой коррозионной стойкости, вызванное торможением анодного процесса электрохимической коррозии.
- Ме является пассивным, если при высокой концентрации окисла в растворе или газовой фазе окисление (при отсутствие внешнего тока) становиться медленнее, чем при несколько меньших концентрациях окисла (Cr, Ni, Mo, Ti, Zr, нержавеющие стали и др. пассивные на воздухе).
Ме и сплавы этой категории обладают значительной анодной поляризацией.
- Ме и сплавы считаются пассивными, если он стоек к коррозии в среде, в которой термодинамически должно произойти большее понижение свободной энергии при переходе его из металлического состояния в соответствующие продукты коррозии.
Pb в H2SO4 или Mg в H2O коррозируют очень слабо. Потенциал коррозии этих Ме относительно активны и анодно они поляризуются слабо.
С одной стороны они могут восстанавливаться и этим ускорять коррозию, а с другой вызывать пассивацию Ме и резкое торможение процесса коррозии
Пассиваторы и депассиваторы.
Вещества или процессы, вызывающие в определенных условиях (нейтральных растворах воды или водных растворах солей) пассивное состояние называются пассивирующими факторами или пассиваторами.
Неорганические окислители HNO3, NaNO3, K2CrO4, NaNO3, O2, Na2CO3
Эти пассиваторы непосредственно или в виде продуктов реакции блокируют анодные и катодные участки поверхности Ме, повышая ее потенциал.
Их большое сродство к Ме сочетается с высокой Еа образования новых веществ с новой решеткой (хемосорбция). О2 при хемосорбции пассивирует поверхность в то время, как ионы Cl- из-за очень низких Еа образуют хлориды Ме, вытесняя адсорбированные на поверхности Ме5 атомы пассиватора, способствуя растворению пассивирующих пленок и переходу ионов Ме в раствор.
2. Анодная поляризация ( окисление, соприкосающихся с электролитом поверхности Ме постоянным электрическим током или при обработке Ме – анодом в паре с другим Ме-катодом)
При достижении определенных значений эффективного потенциала Ме и соответствующего ему анодной плотности тока анодной поляризации может вызвать пассивное состояние Ме. Это состояние может сохраняться и после изменения внешних пассивных условий.
Fe запассивированный в HNO3 (канц.) длительное время сохраняет пассивность в сухом воздухе.
Обычно при изменении внешних условий пассивность Ме может быть вновь перейти в активное состояние – активация.
Вещества или процессы, нарушающие пассивное состояние Ме или затрудняющие наступления пассивации – активаторы.
Восстановители (H2 Na2SO4, NaS2O3 )
Катодная поляризация
Некоторые ионы (H+, галоидные ионы: Cl-, Br-, I-)
Повышение температуры
Механическое нарушения пассивной поверхности (царапание)
17. Анодная поляризационная диаграмма, ее характеристика и применение.
Ме, растворившийся под действием анодной поляризации может при изменении условий потерять эту способность и превратиться в нерастворимый анод.
Переход в пассивное состояние достигается не только при действии соответствующих окислителей, но и анодной поляризацией. Это явление обнаруживается на потенциало –статических кривых : потенциал анода – плотность тока (анодная кривая для Ме, способного пассивировать, поляризационная диаграмма).
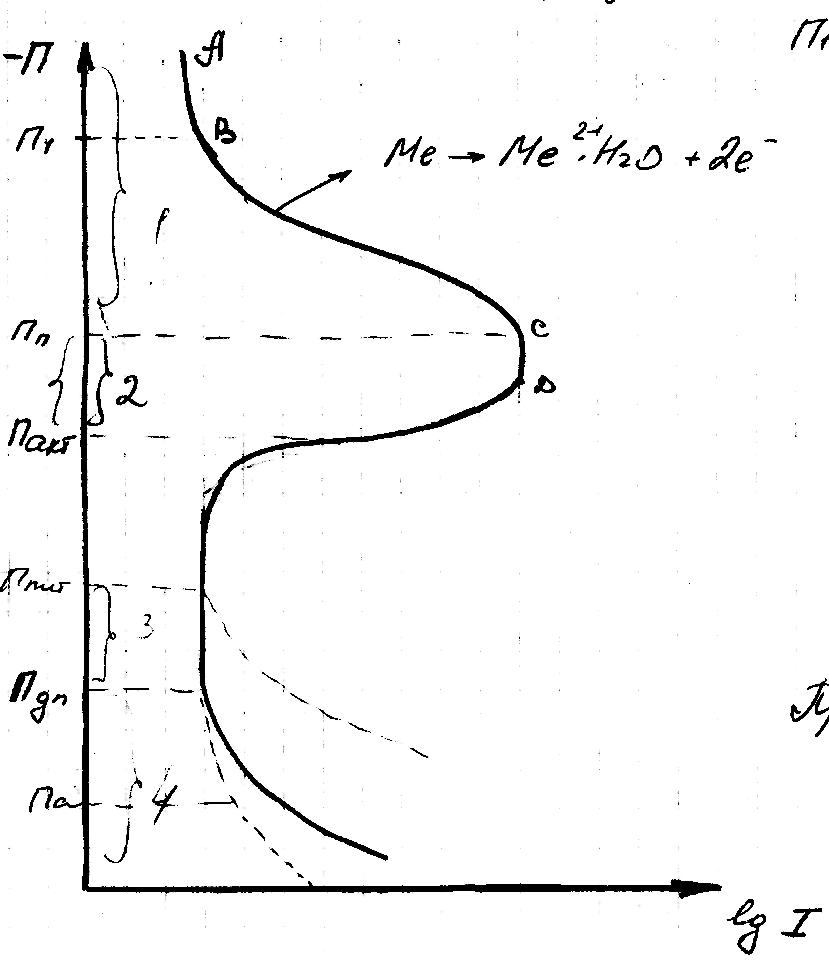
П1-Пп – активное состояние Ме, когда он ведет себя как растворимый анод. Этот участок соответствует max растворимости или max коррозии.
Пп , при которой начинается переход Ме из активного состояния в пассивное, называется потенциалом пассивации.
При Пакт. Ме становиться пассивным (потенциал активации).
Иногда Пп называют Флоде- потенциал.
Пакт.=Ппп (потенциал полной пассивности)
Пдп –потенциал депассивации (пленка уже не выдерживает потенциал и начинает растворяться)
При Пдп :
![]()
(переход защитной пленки трех валентного Ме в ион с шестью валентным Ме, что ведет к ее растворению)
Ппит – потенциал питтинга (пробоя), при котором наблюдается резкое увеличение тока, обусловленное локализационным процессом растворения, при котором почти вся поверхность Ме остается пассивной, а переход его ионов в раствор происходит при очень высоких плотностях тока в отдельных питтингах – это «пробой пассивной пленки».
Обычно это происходит в растворах Cl-, Br-, I- на сплавах Fe, Ni, Al.
В средах не содержащих активаторов, скорость анодного процесса не зависит от потенциала и мала.
Па – потенциал анодирования
1.- область активного состояния
2.- область активно-пассивного
3.- область пассивного состояния
4.- область перепассивации
