
- •1. Основные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •2. Классификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •Толщина окисных пленок на железе и меди
- •3. Стадии окисления металла. Физическая и химическая адсорбция.
- •4. Эпитаксильный рост оксидной пленки. Псевдоморфный слой.
- •5. Законы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •Кинетика окисления
- •Образование очень тонких пленок
- •6. Виды напряжений и разрушений в оксидных пленках. Причины вызывающие их.
- •Причины разрушения оксидных пленок в процессе их роста.
- •7. Ионно-электронный механизм окисления Ме (т. Вагнера)
- •8. Оксидные пленки на железе и стали (состав, структура, свойства)
- •9. Жаростойкость и теории жаростойкого легирования металлов. Жаростойкие защитные покрытия
- •10. Коррозия металлов в диссоциирующих газах
- •11. Электролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •12. Работа микрогальванического элемента. Процессы, происходящие на электродах.
- •13. Причины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •14. Положение элементов в ряду стандартных потенциалов.
- •15.Явление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •16. Пассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •17. Анодная поляризационная диаграмма, ее характеристика и применение.
- •18. Электрохимическая защита металлов. Протекторная защита. Катодная защита.
- •19. Влияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры
- •Влияние скорости движения электролита
- •20. Коррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •21. Термический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •Термический перенос массы
- •22. Влияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Процессы, обусловленные наличием неметаллических компонентов.
- •23. Способы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •24. Совместимость как один из критериев при выборе конструкционных материалов для яэу.
14. Положение элементов в ряду стандартных потенциалов.
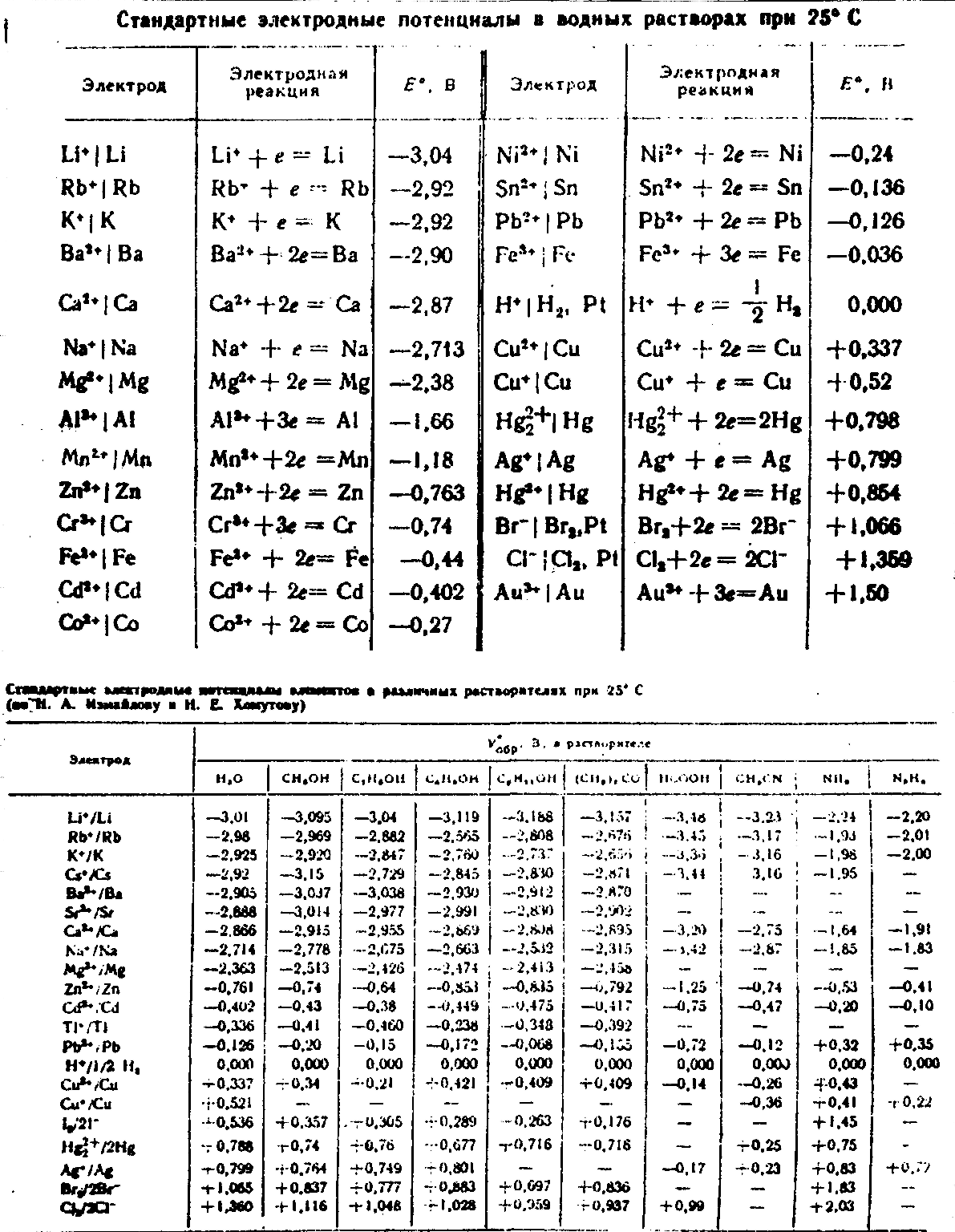
Таблица стандартных потенциалов- это
таблица ЭДС элементов, состоящих из
данного электрода в растворе его соли
с активностью
![]() и стандартного водородного электрода,
т.е. такого у которого
и стандартного водородного электрода,
т.е. такого у которого![]() и
и
![]() .
.
Таблица эквивалентна таблице свободных
энергий ионов, следовательно она может
быть использована для расчетов равновесий,
а значит и для определения направления
реакции в растворах. Таблица характеризует
тенденции ме и металлоидов переходить
в раствор в виде ионов. Ме, стоящие в
таблице выше
![]() заряжаются отрицательно по отношению
к водородному электроду, а ниже –
положительно, при условии равенства
единице активности всех ионов, участвующих
в реакции. Ме, стоящие в таблице выше,
являются менее благородными по сравнению
с расположенными ниже и вытесняют из
раствора ме или металлоиды с меньшими
значениями нормального потенциала.
заряжаются отрицательно по отношению
к водородному электроду, а ниже –
положительно, при условии равенства
единице активности всех ионов, участвующих
в реакции. Ме, стоящие в таблице выше,
являются менее благородными по сравнению
с расположенными ниже и вытесняют из
раствора ме или металлоиды с меньшими
значениями нормального потенциала.
Электродный потенциал – относительная разность потенциалов в электрохимическом мет. электроде между металлич. фазой и фазой раствора.
15.Явление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
Если электроды гальванического элемента
с потенциалами в разомкнутом состоянии
![]() и
и
![]() и сопротивлением электролита в цепи
замкнуть и измерить установившееся
значение силы тока, то оказывается, что
эта сила тока значительно меньше,
рассчитанной по закону Ома, т.е. потенциалы
электродов, через которые проходит при
замыкании электрический ток, отличаются
от потенциалов не нагруженных током.
и сопротивлением электролита в цепи
замкнуть и измерить установившееся
значение силы тока, то оказывается, что
эта сила тока значительно меньше,
рассчитанной по закону Ома, т.е. потенциалы
электродов, через которые проходит при
замыкании электрический ток, отличаются
от потенциалов не нагруженных током.

![]() -
смещение потенциалов анода и катода.
-
смещение потенциалов анода и катода.

Это изменение (сближение) потенциалов и их разности, приводящее к уменьшению силы тока, наз. поляризацией.
Поляризация является слетствием отсутствия электродных процессов от перетока электронов в гальваническом элементе. Анодный процесс выхода ионов ме в электролит отстает от перетока электронов от анода к катоду, что приводит к уменьшению отрицательного заряда на поверхности электрода и делает потенциал анода более положительным.
Катодный процесс ассимеляции электронов отстает от поступления на катод электронов, что приводит к увеличению отрицательного заряда на поверхности электрода и делает потенциал катода более отрицательным.
Процесс электрохимической коррозии
аналогичен работе коротко замкнутого
гальванического элемента. Измеряемый
потенциал корродирующего ме представляет
общий потенциал заполяризованных анодов
и катодов, известный как потенциал
коррозии. Силу тока
![]() наз. током коррозии
наз. током коррозии
![]()
Мерой поляризации является величина
изменения потенциалов. Стеепнь поляризации
зависит от материалов электродов, от
pH и состава электролита.
При уменьшении pH раствора,
коррозия возрастает, т.к. ионы
![]() уменьшают
поляризацию катода. Если в раствор
добавить огкислитель (
уменьшают
поляризацию катода. Если в раствор
добавить огкислитель (![]() ),
то ток I возрастет, и
возрастет коррозия. Наименьшее значение
электродных потенциалов не определяют
ток и скорость коррозии.
),
то ток I возрастет, и
возрастет коррозия. Наименьшее значение
электродных потенциалов не определяют
ток и скорость коррозии.
Анодная поляризация это сдвиг потенциала ме в положительную сторону, т.е. отставание процесса выхода ионов ме в электролит от перетока электронов с анодных участков на катодные. Катодная поляризация это сдвиг потенциала ме в отрицательную сторону.
Электродные процессы уменьшают поляризацию на аноде и на катоде наз. деполяризацией (пеермешивание уменьшает концентрационную поляризацию).
Вещества, прибавление которых меняет
поляризацию на аноде и катоде являются
деполяризаторами, например
комплексообразователи
![]() ,
сильно понижают простых ионов ме в
растворе из-за их связывания в трудно
диссоциирующие комплексы, или ионы
,
сильно понижают простых ионов ме в
растворе из-за их связывания в трудно
диссоциирующие комплексы, или ионы
![]() , затрудняющие наступление анодной
пассивности ме. Окислители способствующие
протеканию катодной реакции, наз.
деполяризаторами, а катодный процесс
деполяризацией.
, затрудняющие наступление анодной
пассивности ме. Окислители способствующие
протеканию катодной реакции, наз.
деполяризаторами, а катодный процесс
деполяризацией.
Влияние поляризации на скорость коррозии.
Сопротивление электролита и поляризуемость электродов ограничивают величину тока, вырабатываемого гальваническим элементом. В локальных элементах на поверхности ме электроды находятся очень близко один от другого, поэтому сопротивление электролита обычно второстепенный фактор по сравнению с поляризацией когда поляризация происходит в основном на анодах, говорят что коррозия протекает с анодным контролем. Потенциал коррозии в таком случае близок к равновесному потенциалу катода.

Шероховатость поверхности(имеет большую истинную поверхность) и более высокую каталитичную активность, что уменьшает перераспределение .
уменьшение плотности тока. Чем больше Еа процесса, т.е. чем медленнее процесс протекает в прямом и обратном направлении при равновесии, тем большая поляризация требуется для обеспечения определенной скорости электрохимического процесса, выражаемой через плотность тока. Связь электрохим. Перенапряжением и плотностью тока выражается уравнением Тафеля:
 .
Знак «+» относится к анодному
перенапряжению, а «-» к катодному.
Постоянная «2»-зависит от природы
реакции и температуры и при Т=298К:
b=0,12-0,1. Постоянная «а»-
зависит от природы реакции, материала
электрода, состава ме и т.д. Из уравнения
следует, что
.
Знак «+» относится к анодному
перенапряжению, а «-» к катодному.
Постоянная «2»-зависит от природы
реакции и температуры и при Т=298К:
b=0,12-0,1. Постоянная «а»-
зависит от природы реакции, материала
электрода, состава ме и т.д. Из уравнения
следует, что
 при i=1.
при i=1.
Скорость образования
![]() из
адсорбированных атомов зависит от
каталитических свойств поверхности
электрода. На хорошем катализаторе
(Fe,Pt) низкие
перенапряжения
,
а на плохом (Pt,Hg)-высокое.
Если если в электрод добавить каталитические
яды (
S)
или некоторые соединения мышьяка или
фосфора, то они будут замедлять скорость
роста
и увеличивать скопление адсорбированных
атомов
на поверхности электрода. Увеличение
концетрации
снижает скорость коррозии. Присутствие
серы или фосфора способствует внедрению
атомов
в ме, что вызывает водородную хрупкость
и создает в некоторых сплавах Fe
высокие внутренние напряжения, вызывающие
растрескивание(водородное растрескивание)
из
адсорбированных атомов зависит от
каталитических свойств поверхности
электрода. На хорошем катализаторе
(Fe,Pt) низкие
перенапряжения
,
а на плохом (Pt,Hg)-высокое.
Если если в электрод добавить каталитические
яды (
S)
или некоторые соединения мышьяка или
фосфора, то они будут замедлять скорость
роста
и увеличивать скопление адсорбированных
атомов
на поверхности электрода. Увеличение
концетрации
снижает скорость коррозии. Присутствие
серы или фосфора способствует внедрению
атомов
в ме, что вызывает водородную хрупкость
и создает в некоторых сплавах Fe
высокие внутренние напряжения, вызывающие
растрескивание(водородное растрескивание)
Перенапряжение
![]() .
.
Значительная активационная поляризация
имеет место и при разряде ионов
![]() на аноде и выделении Перенапряжение
.
на аноде и выделении Перенапряжение
.
![]()
Эта поляризация наз. перенапряжением
.
Активационная поляризация также
возникает при разряде ионов
![]() и при растворении и осаждении ме, но их
значения при данной силе тока
много
меньше чем при выделении
и при растворении и осаждении ме, но их
значения при данной силе тока
много
меньше чем при выделении
![]() или
или
![]()
