
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Химические источники электрической энергии (хиээ)
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
Тогда в полученном растворе
w2(X)
=
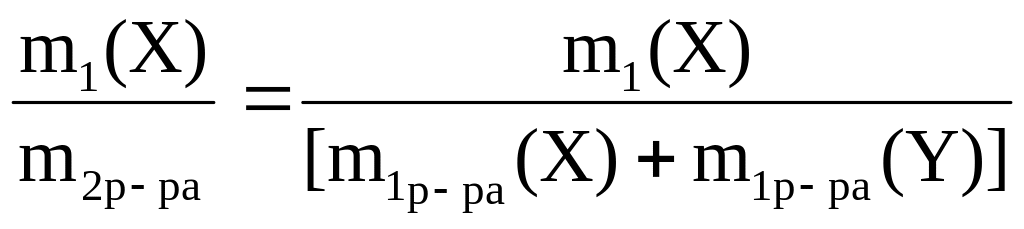 и
и
w2(Y)
=
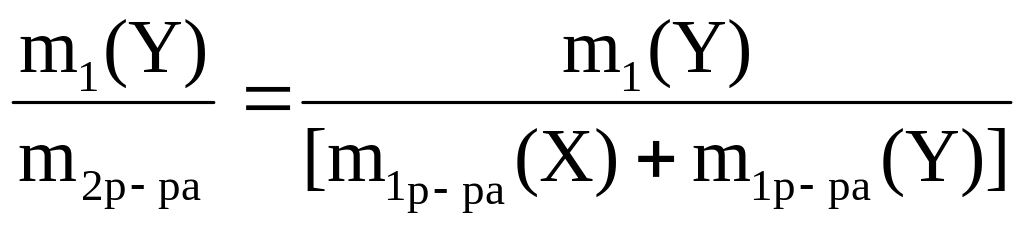
а) из w1(X) = m1(X)/ m1 р–ра(Х) = 0,3 рассчитаем m1(X) = 200·0,3 = 60 г;
из w1(Y) = m1(Y)/m1 р–ра(Y) = 0,5 рассчитаем m1(Y) = 300·0,5 = 150 г;
б) рассчитаем массу полученного раствора
m2р–ра = m1 р–ра(Х) + m1 р–ра(Y) = 200 + 300 = 500 г;
в) рассчитаем w2(X) = m1(X)/m2р–ра = 60/500 = 0,12;
w2 (Y) = w1(Y)/m2р–ра = 150/500 = 0,3
Ответ: w2(X) = 0,12; w2(Y) = 0,3.
7) Рассчитать массовую долю растворенного вещества в растворе, полученном при смешивании растворов разных концентраций одного и того же вещества: 200 мл раствора w1(X) = 0,2; ρ1 = 1,2 г/мл и 300 г раствора w2(X) = 0,6.
Решение: в данном случае масса полученного раствора равна сумме масс исходных растворов, и масса растворенного вещества в полученном растворе – сумме масс его в исходных растворах.
Обозначим:
m1р–ра(Х) – масса первого раствора вещества Х;
m1(Х) – масса вещества X в первом растворе;
m2р–ра(Х) – масса второго раствора вещества Х;
m2(Х) – масса вещества Х во втором растворе;
m3р–ра(Х) – масса раствора, полученного после смешения;
m3(Х) – масса вещества Х в полученном растворе;
w3(Х) – массовая доля вещества X в полученном растворе.
Тогда для полученного раствора можем записать:
w3(X)
=
![]()
а) из w1р–ра(X) = m1(Х)/m2р–ра(Х) = 0,2
рассчитаем m1(Х) = 0,2·200·1,2 = 48 г;
б) из w2(X) = m2(X)/m2р–ра(Х) = 0,6 рассчитаем m3 = 0,6·300 = 180 г.
в) рассчитаем массу вещества X в полученном растворе
m3(Х) = m1(Х) + m2(Х) = 48 + 180 = 228 г
г) рассчитаем массу полученного раствора
m3р–ра(Х) = m1р–ра(Х) + m2р-ра(Х) = 200·1,2 + 300 = 540 г
д) рассчитаем w3(X) = m3(Х) /m3р–ра(Х) = 228/540 = 0,42
Ответ: w3(X) = 0,42.
8) Для растворов, полученных из кристаллогидратов типа X·yH2O, расчеты отличаются тем, что масса раствора складывается из массы кристаллогидрата m(X·yH2O) и массы растворителя (т.е. так же, как в примерах, рассмотренных выше), но при этом масса растворенного вещества m(X) оказывается меньше массы кристаллогидрата.
Соотношение масс кристаллогидрата m(X·yH2O) и соответствующей безводной соли, m(X), определяется соотношением их молярных масс:
m(X·yH2O)/m(X) = M(X·yH2O)/ M(X).
Например, M(ZnSO4·7H2O) = 287 г/моль и M(ZnSO4) = 161 г/моль. Если требуется рассчитать массу кристаллогидрата, в которой содержится заданная масса безводной соли, m(ZnSO4), то
m(ZnSO4·7H2O)
=
![]() =
=
= 287· m(ZnSO4)/161 = 1,78 ·m(ZnSO4);
соответственно m(ZnSO4) = m(ZnSO4·7H2O)/1,78.
8.1) Рассчитать массовую долю сульфата цинка, w(ZnSO4), в растворе, полученном при растворении кристаллогидрата ZnSO4·7H2O массой 300 г в воде объемом 2 л.
Решение: w(ZnSO4)
= m(ZnSO4)/mр–ра
=
![]() .
.
M(ZnSO4·7H2O) = 287 г/моль, M(ZnSO4) = 161 г/моль
а) рассчитаем массу ZnSO4, которая содержится в 300 г ZnSO4·7H2O
(см. пример выше): m(ZnSO4) = 300·161/287 = 168,3 г
б) рассчитаем массу полученного раствора:
mр–ра = m(ZnSO4·7H2O) + m(H2O) = 300 + 2000 = 2300 г
в) w(ZnSO4) = 168,3/2300 = 0,073 или 7,3%
Ответ: w(ZnSO4) = 0,073 или 7,3%.
8.2) Рассчитать массовую долю сульфата цинка в растворе, полученном из раствора сульфата цинка массой 200 г и w(ZnSO4) = 0,3 после выделения из него 10 г кристаллогидрата ZnSO4·7H2O.
Решение: w(ZnSO4) = m(ZnSO4)/mр–ра
Обозначим:
m1р–ра – масса исходного раствора;
w1(ZnSO4) – массовая доля ZnSO4 в исходном растворе;
m1(ZnSO4) – масса ZnSO4 в исходном растворе;
w2(ZnSO4) – массовая доля ZnSO4 в полученном растворе;
m(ZnSO4·7H2O) – масса выделившегося кристаллогидрата;
m2(ZnSO4) – масса ZnSO4 в выделившемся кристаллогидрате;
m3(ZnSO4) – масса ZnSO4 в полученном растворе.
Преобразуем расчетное уравнение с учетом условия задачи в следующее:
w2(ZnSO4)
=
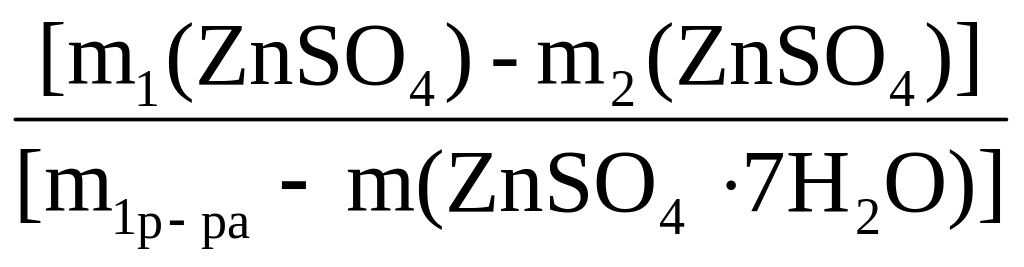
а) из w1(ZnSO4) = m1(ZnSO4)/m1р–ра = 0,3 рассчитаем массу ZnSO4 в исходном растворе: w1(ZnSO4) = 200×0,3 = 60 г;
б) рассчитаем массу соли, ZnSO4, которая выделилась из раствора с 10 г ZnSO4·7H2O:
m2(ZnSO4)
=
![]() =
=
![]() = 5,6 г;
= 5,6 г;
в) рассчитаем массу ZnSO4 в конечном растворе:
m3(ZnSO4) = m1(ZnSO4) – m2(ZnSO4) = 60 – 5,6 = 54,4 г;
г) w2(ZnSO4)
=
 =
=
![]() = 0,29
= 0,29
Ответ: w2(ZnSO4) = 0,29.
9) Расчет массы (или объема) компонентов для приготовления раствора с заданной массовой долей растворенного вещества, w(X):
9.1) Рассчитать массу KOH и массу воды для приготовления 200 г раствора w(KOH) = 0,3.
Решение: w(KOH)
= m(KOH)/mр–ра
=
![]() =
0,3
=
0,3
а) рассчитаем массу KOH для приготовления раствора:
m(KOH) = w(KOH)×mр–ра = 0,3·200 = 60 г
б) рассчитаем массу растворителя:
m(H2O) = mр–ра – m(KOH) = 200 – 60 = 140 г
Ответ: m(KOH) = 60 г, m(H2O) = 140 г.
9.2) Рассчитать объем хлороводорода (н. у.) и воды для приготовления 0,5 л 30 % соляной кислоты, ρ= 1,1 г/мл.
Решение: w(HCl)
= m(HCl)/mр–ра
=
![]() = 0,3
= 0,3
а) рассчитаем mр–ра = Vр–ра × р–ра = 500×1,1 = 550 г;
б) рассчитаем массу и объем хлороводорода:
m(HCl) = w(HCl) ·mр–ра = 0,3×550 = 165 г
V(HCl)
= n(HCl)
·VM
=
![]() =
165·22,4/36,5 = 101,3 л;
=
165·22,4/36,5 = 101,3 л;
в) рассчитаем массу и объем воды
m(H2O) = mр–ра – m(HCl) = 550 – 165 = 385 г, V(H2O) = 385 мл
Ответ: V(HCl) =101,3 л; V(H2O) = 385 мл.
9.3) Рассчитать объем раствора серной кислоты w1(H2S04) = 0,8; 1 = 1,75 г/мл и объем воды, необходимые для приготовления 5 литров раствора w2(H2S04) = 0,2; 2 =1,2 г/мл.
Решение: если заданный раствор готовят разбавлением исходного раствора чистым растворителем, то масса растворенного вещества не меняется (она такая же, что и в исходном растворе), а масса полученного раствора равна сумме масс исходного раствора и добавленного растворителя.
С учетом этого запишем исходное расчетное уравнение:
w2(H2S04)
= m2(H2S04)/
m2р–ра
=
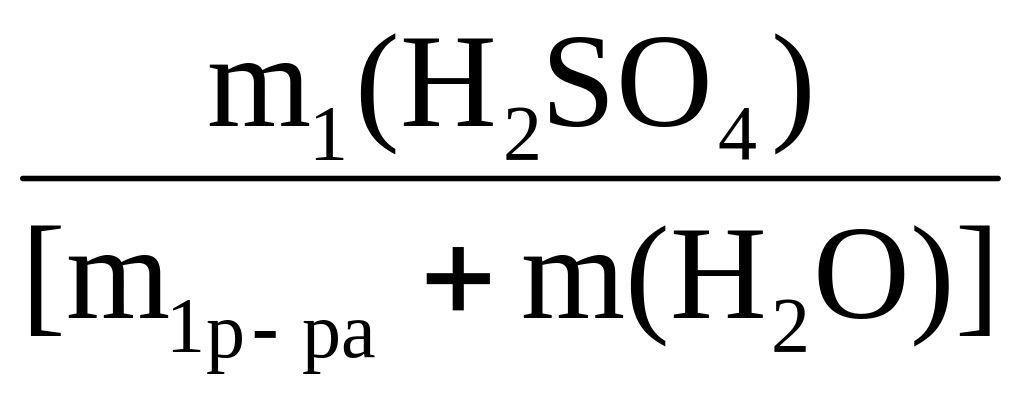 = 0,2
= 0,2
а) рассчитаем массу серной кислоты для приготовления заданного раствора:
m2(H2S04) = w2(H2S04)·m2р–ра = 0,2·5·1,2 = 1,2 кг;
б) рассчитаем массу исходного раствора, в котором содержится 1,2 кг H2S04:
из w1(H2S04) = m1(H2S04)/m1р–ра = 0,8 получим m1р–ра = 1,2:0,8 = 1,5 кг;
в) рассчитаем объем исходного раствора:
V1р–ра = m1р–ра/1 = 1,5/1,75 = 0,86 л;
г) рассчитаем массу и затем объем воды:
m(H2O) = m2р–ра – m1р–ра = 5·1,2 – 1,5 = 4,5 кг; V(H2O) = 4,5 л
Ответ: V1р–ра = 0,86 л, V(H2O) = 4,5 л.
9.4) Рассчитать объемное соотношение хлороводорода (н. у.) и воды для приготовления 10 % раствора кислоты.
Решение: w(HCl) = m(HCl)/mр–ра = = 0,1
а) выразим массу хлороводорода и массу воды через их объемы:
m(HCl)
=
![]() = 36,5·V(HCl)/22,4
= 1,63×V(HCl)
= 36,5·V(HCl)/22,4
= 1,63×V(HCl)
m(H2O) = V(H2O) ·(H2O) = V(H2O);
б) подставив полученные выражения в
исходное уравнение, получим следующее:
![]() = 0,1; V(HCl)/
V(H2O)
= 68/1.
= 0,1; V(HCl)/
V(H2O)
= 68/1.
Обратите внимание, что в конечном расчетном уравнении необходимо согласовать размерности величин: вследствие того, что объем хлороводорода выражен в литрах, плотность воды – (H2O) = 1000 г/л.
Ответ: V(HCl)/V(H2O) = 68/1.
9.5) Рассчитать массу ZnSO4·7H2O и объем воды, необходимые для приготовления 2 кг раствора w(ZnSO4) = 0,2.
Решение: w(ZnSO4) = m(ZnSO4)/mр–ра = 0,2
а) рассчитаем массу ZnSO4 для приготовления заданного раствора:
m(ZnSO4) = w(ZnSO4)·mр–ра = 2·0,2 = 0,4 кг;
б) рассчитаем массу кристаллогидрата, содержащую 0,4 кг ZnSO4:
m(ZnSO4·7H2O) = 0,4×287/161 = 0,71 кг;
в) рассчитаем массу и объем воды для приготовления раствора:
m(H2O) = mр–ра– m(ZnSO4 ·7H2O) = 2 – 0,71 = 1,29 кг, V(H2O) = 1,29 л
Ответ: m(ZnSO4 ·7H2O) = 0,71 кг, V(H2O) = 1,29 л.
9.6) Имеется соляная кислота объемом 10 л, с массовой долей w1(HCl) = 0,2 и с плотностью = 1,1 г/мл. Рассчитать массу и объем хлороводорода, который потребуется дополнительно в ней растворить, чтобы увеличить массовую долю хлороводорода до w2(HCl) = 0,36.
Решение: если заданный раствор готовят из менее концентрированного добавлением чистого вещества Х, то масса полученного раствора и масса растворенного вещества увеличиваются на одну и ту же величину – массу добавленного вещества. (Однако, если добавляемое вещество – кристаллогидрат, то увеличение массы растворенного вещества будет меньше массы кристаллогидрата – см. предыдущий пример).
Обозначим:
m1(HCl) – масса HCl в исходном растворе;
m1р–ра(HCl) – масса исходного раствора;
w1(HCl) – массовая доля HCl в исходном растворе;
m1(HCl) – масса HCl в исходном растворе;
m(HCl) – масса добавленного HCl;
w2(HCl) – массовая доля HCl в полученном растворе.
Тогда w2(HCl)
=
![]() ,
откуда
,
откуда
m(HCl) =
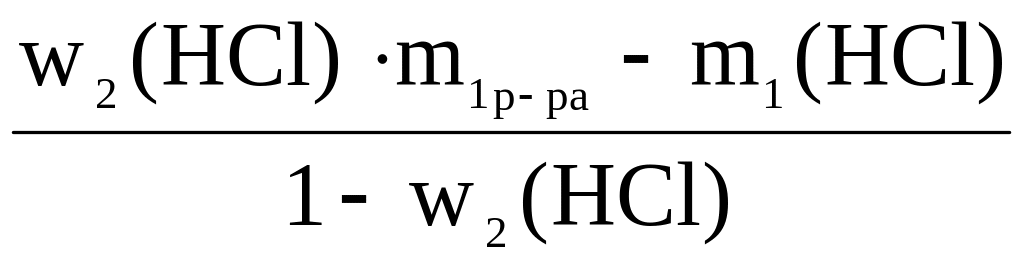 , V(HCl)
=
, V(HCl)
=
![]()
а) рассчитаем массу исходного раствора:
m1р–ра(HCl) = V1р–ра × р–ра = 10×1,1 = 11 кг;
б) рассчитаем массу хлороводорода в исходном растворе:
m1(HCl) = m1р–ра(HCl) ×w1(HCl) = 11×0,2 = 2,2 кг;
в) рассчитаем массу и объем добавленного HCl:
m(HCl) =
=
![]()
V(HCl) = 2,75×1000×22,4/36,5 = 1688 л
Ответ: m(HCl) = 2,75 кг; V(HCl) = 1688 л.
9.7) В каком массовом соотношении необходимо взять растворы серной кислоты w1(H2S04) = 0,8 и w2(H2S04) = 0,2 для получения раствора с массовой долей w3(H2S04) = 0,4?
Решение: из уравнения
w3(H2S04)
= m3(H2S04)/m3р–ра
=
![]() можно рассчитать m1р–ра/m2р–ра.
можно рассчитать m1р–ра/m2р–ра.
Покажем, как можно решить эту задачу, применив «правило смешения» – оно легко выводится из уравнения, приведенного выше:
![]() =
=
![]() =
2:1
=
2:1
Ответ: m1р–ра/m2 р–ра = 2:1.
Очевидно, что правило смешения можно применять для решения любых задач типа (I), приведенных ранее.
II. Растворы – продукты химических реакций
II.1 Все продукты реакции остаются в полученном растворе
Как отмечено на с. 8, в этих случаях масса полученного раствора равна сумме масс исходных компонентов (веществ или растворов) и не зависит от того, какие продукты и в каком количестве получатся в результате химической реакции.
Типичная задача этого типа – расчет концентрации веществ в растворе, полученном при смешении растворов кислоты и щелочи (образование нового раствора сопровождается реакцией нейтрализации):
H2SO4 + 2KOH = K2SO4 + 2H2O
При этом возможны три варианта состава полученного раствора:
а) если кислота и щелочь взяты в эквивалентных количествах, то в полученном растворе будет только соль;
б) если в избытке взята кислота, то полученный раствор, содержит соль и избыток кислоты;
в) если в избытке взята щелочь, то полученный раствор содержит соль и избыток щелочи.
Варианты (б) и (в) рассчитываются однотипно: сначала определяют реагент, взятый в недостатке, а затем по его количеству рассчитывают (с помощью уравнения реакции) количество образовавшейся соли и количество оставшегося в избытке реагента.
Пример 1. Рассчитать состав и w(X) в растворе, полученном при смешении 200 г раствора w(KOH) = 0,15 и 150 г раствора w(H2SO4) = 0,3.
Решение: H2SO4 + 2KOH = K2SO4 + 2H2O
Обозначим:
m1 – масса исходного раствора KOH;
m2 – масса исходного раствора H2SO4;
m3 – масса полученного раствора.
Для определения состава раствора:
а) определим массу кислоты и щелочи в исходных растворах
m(KOH) = w(KOH)× m1 = 0,15×200 = 30 г
m(H2SO4) = w(H2SO4)×m2 = 0,3×150 = 45 г
б) определим количество кислоты и щелочи в исходных растворах:
n(KOH) = m(KOH)/M(KOH) = 30/56 = 0,54 моль
n(H2SO4) = m(H2SO4)/M(H2SO4) = 45/98 = 0,46 моль
в) определим, какой реагент в недостатке:
– из уравнения реакции видно, что на 1 моль кислоты расходуется 2 моль щелочи; тогда на 0,46 моль H2SO4 требуется 0,92 моль KOH, а прилили только 0,54 моль. Следовательно, в недостатке щелочь, поэтому она прореагирует полностью, и материальный баланс считаем далее по ее количеству;
г) из уравнения реакции видно, что количество прореагировавшей кислоты вдвое меньше количества прореагировавшей щелочи и равно количеству образовавшейся соли.
Тогда состав полученного раствора:
n(K2SO4) = n(KOH)/2 = 0,54/2 = 0,27 моль,
nизб.(H2SO4)
= n(KOH)/2 =
![]() = 0,92 – 0,27 = 0,65 моль
= 0,92 – 0,27 = 0,65 моль
д) рассчитаем w(K2SO4) и w(H2SO4): w(X) = m(X)/mр–ра;
т.к. все реагенты остались в растворе, то масса полученного раствора
m3= m1 + m2 = 200 + 150 = 350 г;
тогда w(H2SO4)
=
![]() = 0,65×98/350=
0,182 (18,2 %);
= 0,65×98/350=
0,182 (18,2 %);
w(K2SO4)
=
![]() =
=![]() = 0,16 (16 %)
= 0,16 (16 %)
Ответ: w(H2SO4) = 0,182; w(K2SO4) = 0,16.
Пример 2. Рассчитать объем раствора серной кислоты w(H2SO4) = 0,25 плотностью 1,2 г/мл, который необходимо добавить к 200 мл щелочи w1(KOH) = 0,2 плотностью 1,1 г/мл для уменьшения концентрации щелочи до w2(KOH) = 0,15.
Решение: уравнение реакции 2KOH + H2SO4 = K2SO4 + 2H2O
Обозначим:
m1 – масса исходного раствора KOH;
m2 – масса KOH в исходном растворе;
m3 – масса добавленного раствора H2SO4;
m4 – масса H2SO4 в добавленном растворе;
m5 – масса KOH, вступившего в реакцию.
Преобразуем расчетное уравнение под условие задачи:
w2(KOH)
= m(KOH)/mр–ра
=
![]() = 0,15
= 0,15
Очевидно, что решение задачи сводится к тому, чтобы из полученного уравнения рассчитать массу раствора серной кислоты (m3), а затем и его объем.
а) рассчитаем массу исходного раствора щелочи (m1) и массу KOH в нем (m2): m1 = Vр–ра р–ра = 200 × 1,1 = 220 г;
из w(KOH) = m(KOH)/mр–ра = m2/m1 = 0,2 рассчитаем массу КОН:
m2 = 0,2 m1 = 0,2 × 220 = 44 г;
б) с учетом уравнения реакции выразим массу прореагировавшего KOH, (m5) через массу добавленного раствора кислоты (m3), для этого:
– с помощью уравнения реакции выразим количество прореагировавшей щелочи через количество добавленной кислоты: n(KOH) = 2∙n(H2SO4);
– выразим количество H2SO4 через ее массу:
n(H2SO4) = m(H2SO4)/M(H2SO4) = m4/98;
– выразим массу серной кислоты через массу ее раствора (m3):
из w(H2SO4) = m(H2SO4)/mр–ра = m4/m3 = 0,25 получим
m4 = 0,25 × m3;
в) с учетом (а) и (б) получим: n(H2SO4) = 0,25m3/98 = 0,00255∙m3;
г) с учетом (а) и (г) получим: n(KOH) = 2∙n(H2SO4) = 0,0051∙m3;
д) выразив в последнем уравнении n(KOH) через его массу (m5), получим:
n(KOH) = m(KOH)/M(KOH) = m5/56 = 0,0051∙m3, откуда
m5 = 56×0,0051∙ m3 = 0,286∙m3
е) подставив результаты, полученные в
(1) и выражение m5
в исходное расчетное уравнение, получим:
w2(KOH)
=
![]() =
0,15;
=
0,15;
откуда m3 = 25,3 г; тогда объем раствора кислоты V р–ра = 25,3/1,2 = 21 мл
Ответ: Vр–ра = 21 мл.
Пример 3. Рассчитать w(H2SO3) в растворе, полученном из 15 л SO2 (н. у.) и 1 л воды (превращение ангидрида в кислоту считать полным).
Решение: напишем схему превращения: SO2 + H2O → H2SO3
w(H2SO3)
= m(H2SO3)/mр–ра
=
![]()
а) рассчитаем m(SO2)
= n(SO2)×M(SO2)
=
![]() = 15×64/22,4 = = 42,86 г
= 15×64/22,4 = = 42,86 г
б) рассчитаем m(H2SO3) с учетом того, что n(H2SO3) = n(SO2):
m(H2SO3) = n(H2SO3)×M(H2SO3) = n(SO2)×M(H2SO3) = 15×82/22,4 = 54,91г
в) w(H2SO3)
=
=
![]() =
0,053
=
0,053
Ответ: w(H2SO3) = 0,053.
II.2 Продукты реакции выделяются из раствора (частично или полностью) в виде осадков или газов
В этом случае масса полученного раствора меньше суммы масс исходных компонентов на массу выделившихся из раствора веществ (осадков или газов); изменение массы раствора и масса «растворенного вещества» рассчитываются с помощью уравнения реакции (или с применением закона эквивалентов).
Пример 1. В 200 г воды «растворили» 4,6 г металлического натрия. Рассчитать массовую долю NaOH в полученном растворе.
Решение: уравнение реакции, протекающей при «растворении» натрия:
2Na + 2H2O = 2NaOH + H2
w(NaOH)
= m(NaOH)/mр–ра
=
![]()
а) поскольку натрий «растворили», можно считать, что он прореагировал полностью и по его количеству можно рассчитать количество образовавшегося NaOH: n(NaOH) = n(Na) = m(Na)/M(Na) = 4,6/23 = 0,2 моль, тогда m(NaOH) = = n(NaOH)×M(NaOH) = 0,2×40 = 8 г;
б) с учетом уравнения реакции можно рассчитать количество и массу водорода, выделившегося в результате реакции:
n(H2) = 0,5× n(Na) = 0,2×0,5 = 0,1 моль;
m(H2)] = n(H2)× M(H2) = 0,1×2 = 0,2 г;
в) подставим полученные величины в исходное уравнение:
w(NaOH) =
m(NaOH)/mр–ра
=
=
![]() =
0,04 или 4 %.
=
0,04 или 4 %.
Ответ: w(NaOH) = 0,04.
Пример 2. К 200 г раствора хлорида аммония w(NH4Cl) = 0,2 прилили 50 мл щелочи, w(KOH) = 0,2 ( = 1,18 г/мл), и полученную смесь прокипятили с обратным холодильником до прекращения выделения аммиака. Определить состав полученного раствора и массовую долю растворенных веществ.
Решение: NH4Cl + KOH = NH3 + KCl + H2O
Для определения состава раствора:
а) определим количество NH4Cl и KOH в исходных растворах:
n(NH4Cl)
=
![]() = 200×0,2/53,5 = 0,75 моль,
= 200×0,2/53,5 = 0,75 моль,
n(KOH) =
![]() =
0,18 моль;
=
0,18 моль;
б) определим, какой реагент в недостатке:
из уравнения реакции видно, что на 1 моль NH4Cl расходуется 1 моль щелочи; следовательно, в недостатке KOH, который прореагирует полностью, и материальный баланс считаем по нему: n(KCl) = n(KOH) = 0,18 моль. Столько же аммиака выделилось из раствора, т.е. n(NH3) = 0,18 моль; хлорида аммония прореагирует также 0,18 моль, и в избытке останется:
n(NH4Cl) = 0,75 – 0,18 = 0,57 моль;
в) рассчитаем массу образовавшегося раствора:
mр–ра = mр–ра(NH4Cl) + mр–ра(KOH) – m(NH3) = 200 + 50×1,18 –0,18×17= 256 г;
в) рассчитаем массовые доли NH4Cl и KCl в полученном растворе:
w(NH4Cl)
= m(NH4Cl)/mр–ра
=
![]() =
0,12
=
0,12
w(KCl) = m(KCl)/mр–ра
=
![]() =
0,05
=
0,05
Ответ: w(NH4Cl) = 0,12, w(KCl) = 0,05.
III. Расчет массы (или объема) компонентов для приготовления раствора с заданной молярностью, С(X)
Растворы заданной молярной концентрации обычно готовят в так называемой мерной посуде (мерных колбах соответствующего объема: 100 мл, 0,5 л, 1 л и т. д.). При этом рассчитывают навеску растворяемого вещества или объем раствора этого вещества с большей концентрацией, и после переноса их в мерную колбу доливают растворитель до метки соответствующего объема. (Если в задаче все же предусмотрен расчет объема растворителя, то в этом случае удобнее предварительно перевести молярность раствора в концентрацию в процентах и далее применить подходящий метод решения, из приведенных ранее).
Если заданный раствор готовится разбавлением более концентрированного раствора, то количество растворенного вещества не меняется, и для расчета объема раствора с известной молярностью можно использовать уравнение:
С1(X)×V1р–ра = С2(X)×V2р–ра
Если заданный раствор готовится разбавлением более концентрированного раствора с известной w(X), то объем последнего можно определить двумя способами:
1–й способ – рассчитать количество вещества, необходимое для приготовления заданного раствора, а затем массу и объем исходного раствора;
2–й способ – перевести w(X) исходного раствора в его молярность и затем использовать уравнение: С1(X)×V1р–ра = С2(X)×V2р–ра
Пример 1. Рассчитать массу хлорида бария для приготовления 0,5 л децимолярного раствора BaCl2.
Решение: а) из С(X) = n(X)/Vр–ра = n(BaCl2)/ Vр–ра = 0,1 моль/л рассчитаем
количество BaCl2, необходимое для приготовления заданного раствора:
n(BaCl2) = С(BaCl2)×Vр–ра = 0,1×0,5 = 0,05 моль;
б) из n(BaCl2) = m(BaCl2)/M(BaCl2) рассчитаем
m(BaCl2) = n(BaCl2)∙M(BaCl2) = 0,05×208 = 10,4 г
Ответ: m(BaCl2) = 10,4 г.
Пример 2. Рассчитать объем соляной кислоты с массовой долей w(HCl) = = 0,36; = 1,17, для приготовления 2 л раствора с концентрацией C(HCl) = 0,1 M.
Решение
1способ: а) из С(X) = n(X)/Vр–ра = n(HCl)/ Vр–ра = 0,1 моль/л рассчитаем количество HCl, необходимое для приготовления заданного раствора: n(HCl) = = С(HCl)×Vр–ра = 0,1×2 = 0,2 моль – такое же количество HCl должно содержаться в исходном (концентрированном) растворе;
б) рассчитаем массу HCl количеством 0,2 моль: m(HCl) = n(HCl)×M(HCl) =
= 0,2×36,5 = 7,3 г;
в) рассчитаем массу и объем исходного раствора, в котором содержится
7,3 г HCl: из w(HCl) =m(HCl)/mр–ра получим mр–ра = m(HCl)/w(HCl) = 7,3/0,36 = = 20,3 г; тогда объем этого раствора Vр–ра = mр–ра/ = 20,3/1,17 = 17,3 мл
Ответ: Vр–ра = 17,3 мл.
2 способ: а) из С(X) = n(X)/Vр–ра = n(HCl)/ Vр–ра = 0,1 моль/л
рассчитаем количество HCl, необходимое для приготовления заданного раствора: n(HCl) = С(HCl)×Vр–ра = 0,1×2 = 0,2 моль – такое же количество HCl должно содержаться в исходном (концентрированном) растворе;
б) переведем w(HCl) = 0,36 в молярность этого раствора:
С(HCl =
![]() =
11,54 M
=
11,54 M
в) из С1(HCl)×V1р–ра = С2(HCl)×V2р–ра рассчитаем объем исходного раствора
V1р–ра =
![]() =
0,0173 л = 17,3 мл
=
0,0173 л = 17,3 мл
Ответ: Vр–ра = 17,3 мл.
Пример 3. Какая масса (кг) кристаллогидрата CuSO4·5H2O потребуется для приготовления раствора сульфата меди объемом 5 м3, С(CuSO4) = 0,3 M?
Решение
а) из С(X) = n(X)/Vр–ра = n(CuSO4)/ Vр–ра = 0,3 моль/л рассчитаем количество CuSO4, необходимое для приготовления заданного раствора:
n(CuSO4) = С(CuSO4)×Vр–ра = 0,3×5000 = 1500 моль – такое же количество CuSO4 должно содержаться в кристаллогидрате CuSO4·5H2O;
б) m(CuSO4·5H2O) = n(CuSO4×5H2O)×M(CuSO4×5H2O) = 1500×250 = 375000 г
или 375 кг
Ответ: m(CuSO4·5H2O) = 375 кг.
