
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Химические источники электрической энергии (хиээ)
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
4.3 Химическое равновесие
В состоянии химического равновесия прямая и обратные реакции термодинамически равновероятны ( рG0 = 0). При этом параметры системы (температура, давление, концентрации) остаются неизменными во времени, т.к. скорости прямой и обратной реакций равны.
Следует различать истинное и «заторможенное» (ложное) равновесие.
Если равновесие «заторможенное», то параметры системы (давление, температура, концентрации) при некоторых условиях не меняются во времени, хотя равновесия при этом может и не быть. Например, смесь газообразного водорода с хлором (или с кислородом) при обычных условиях может существовать без каких-либо изменений весьма продолжительное время. Однако стоит только ввести в смесь подходящий катализатор (платиновую чернь, например), смесь взорвется и в исходное состояние самопроизвольно не вернется.
Признаки истинного равновесия:
– термодинамическая устойчивость, т.е. в отсутствие внешних воздействий оно характеризуется постоянством равновесного состава системы;
– подвижность, т.е. при изменении условий соотношение компонентов в системе меняется (за счет преимущественного протекания одной из реакций), но при восстановлении первоначальных условий восстанавливается исходное соотношение веществ (вследствие преимущественного протекания обратной реакции, до наступления равновесия);
В состоянии равновесия понятия «исходные вещества» и «продукты реакции» в общем-то, неразличимы, т.к. одновременно все вещества, образующие систему, оказываются реагентами (протекают и прямая, и обратная реакции). В то же время, для удобства, вещества левой части уравнения реакции обычно называют «исходными», а те, что справа, за знаком равновесия (), – «продуктами». В качестве истинно равновесной системы можно рассматривать, например, смесь CO2, H2, CO и H2O, полученную в результате реакции
CO2(г) + H2(г) CO(г) + H2O(г).
При Т = 8100С (над катализатором) эта смесь будет существовать в эквимолярном соотношении сколь угодно долго. Если температуру смеси увеличить, то будет протекать преимущественно прямая реакция, но если восстановить Т = 8100С, соотношение реагентов вновь станет первоначальным.
– возможность достижения равновесного состояния различными способами.
Например, рассмотренную выше равновесную смесь CO2, H2, CO и H2O можно получить в результате реакции:
а) CO2 и H2; б) CO2, H2, CO; в) CO и H2O
При этом независимо от исходных мольных соотношений реагентов при достижении равновесия соотношение CO2, H2, CO и H2O будет одинаковым, соответствующим закону действующих масс.
Закон действующих масс: в состоянии химического равновесия отношение произведения равновесных молярных концентраций продуктов реакции к произведению равновесных молярных концентраций исходных веществ (в степенях, соответствующих стехиометрическим коэффициентам) есть величина постоянная при постоянстве температуры и называется константой химического равновесия (К).
Например, для условной гомогенной равновесной системы
aA + bB dD + qQ закон действующих масс выражается следующим уравнением:
|
(4.3.1) |
В уравнении (4.3.1) [A], [B], [D], [Q], – равновесные концентрации (моль/л) всех веществ – участников реакции, т.е. концентрации, которые устанавливаются в системе в момент химического равновесия; степеней a, b, d, q – стехиометрические коэффициенты в уравнении реакции.
Константа равновесия зависит только от природы реагирующих веществ и температуры и не зависит от того, из какого исходного состояния равновесие достигнуто.
Как отмечалось ранее, термодинамическим условием химического равновесия является равенство нулю изменения энергии Гиббса: рGТ = 0.
Связь константы равновесия с энергией Гиббса описывается уравнениями:
рGТ0 = – RTlnK
K = exp(– рGТ0/RT) |
(4.3.2) |
Из уравнения (4.3.2) следует, что чем отрицательнее величина рGТ0, тем больше величина константы равновесия, и (см. уравнение 4.3.1) тем большей будет концентрация продуктов по сравнению с исходными веществами.
Например, рассчитаем константу для равновесия N2+3H2 2NH3 при Т = 500 К: Gf0298 = – 16,5 кДж/моль, и при Т = 500 К
K = exp(16500)/8,31 · 500) = 3,97
Если K >> 1, то прямое превращение протекает в большей мере, чем обратное.
Если K << 1, то в прямом направлении реакция протекает незначительно; в большей мере протекает обратная реакция.
Если К
![]() 1, то равновероятны как прямое, так и
обратное превращение веществ.
1, то равновероятны как прямое, так и
обратное превращение веществ.
Очевидно, что при выборе варианта получения (превращения) заданного вещества предпочтительнее тот, для которого константа больше.
Примеры применения закона действующих масс (з.д.м.)
1) Константа равновесия для гомогенной равновесной системы
а) N2+3H2 2NH3 имеет следующий вид:
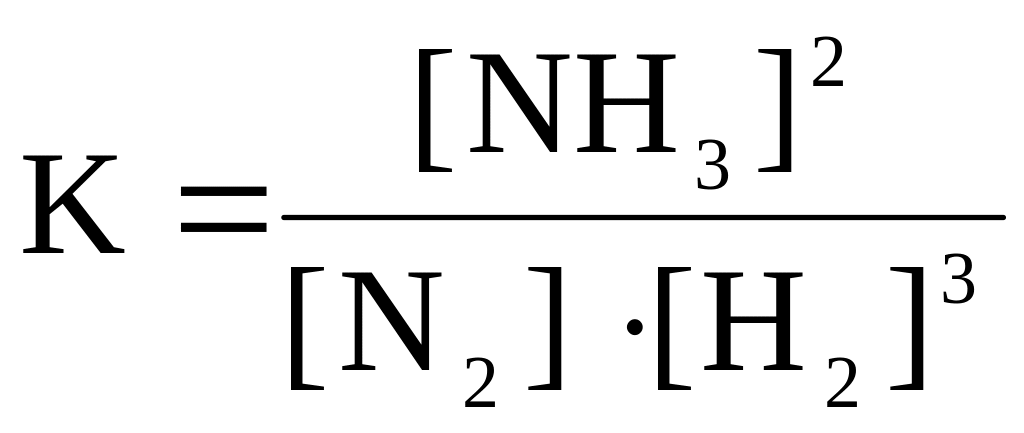
б) Константа равновесия диссоциации слабого электролита, например фтороводородной кислоты: HF H+ + F– имеет вид:
![]() – такие константы называют константами
диссоциации (Кдис.) и
они приводятся в справочниках. Чем
слабее электролит, тем меньше Кдис.
– такие константы называют константами
диссоциации (Кдис.) и
они приводятся в справочниках. Чем
слабее электролит, тем меньше Кдис.
2) Если в гомогенной равновесной системе какой-либо реагент в большом избытке по сравнению с остальными, то его не включают в выражение константы.
Пример: равновесие гидролиза F– + H2O HF + OH–, в котором H2O не только реагент, но и растворитель, следовательно, в большом избытке. С учетом последнего запишем выражение константы гидролиза:
![]()
3) Если система гетерогенная, то реакция протекает на границе раздела фаз, и поэтому реагент более упорядоченной фазы в выражение константы не включают.
Пример: в насыщенном растворе фосфата кальция устанавливается гетерогенное равновесие между осадком и раствором:
Ca3(PO4)2(тв.) 3Ca2+(р-р)+2PO43–(р-р)
при этом два реагента (Ca2+ и PO43–) находятся в жидкой фазе (растворе), а третий, Ca3(PO4)2, – в осадке; последний не включается в выражение константы равновесия: K = [Ca2+]3[PO43–]2
Для насыщенных растворов малорастворимых солей такие константы называют произведением растворимости (ПР) и они приводятся в справочниках.
4) Если в равновесии участвуют газообразные вещества, то в выражении константы их молярные концентрации можно заменить парциальными давлениями (px).
Пример: для равновесия 2SO2 + O2 2SO3 выражение константы можно записать в двух вариантах:
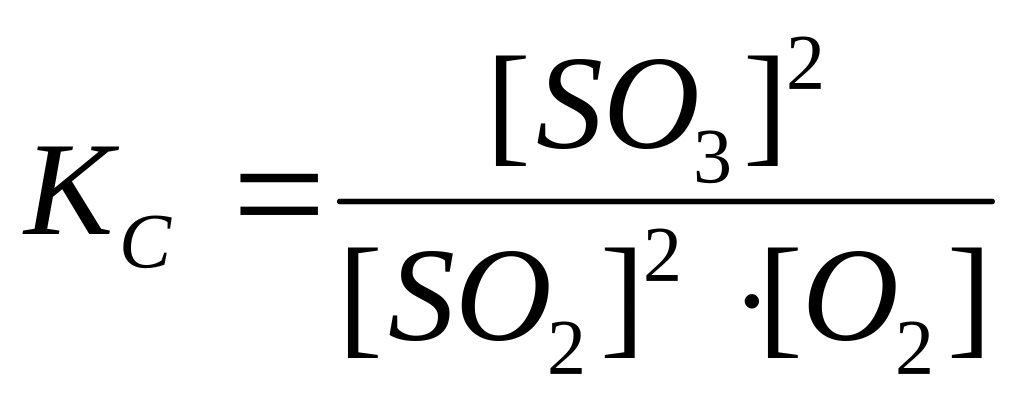 Кр
=
Кр
=
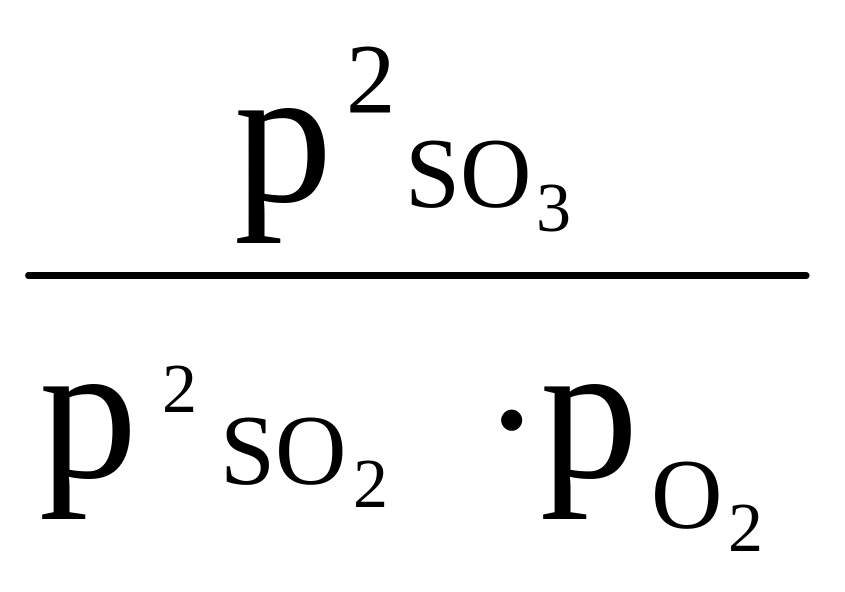
Смещение химического равновесия. Принцип Ле Шателье
Если не меняются условия, при которых установилось химическое равновесие, то соотношение реагентов в системе не меняется во времени. При внешнем воздействии (нагревании или охлаждении системы, повышении или понижении давления, добавлении или удалении какого-либо реагента, участвующего в реакции) равновесие нарушается (смещается). Нарушение равновесия проявляется в том, что одна из реакций (прямая или обратная) начинает идти с большей скоростью.
Если в результате воздействия увеличивается скорость прямой реакции, то говорят, что равновесие смещается вправо. Если увеличивается скорость обратной реакции – смещается влево.
Через некоторое время, по мере расхода одних реагентов и увеличения концентрации других, скорости прямой и обратной реакций сравняются, и установится новое равновесие. Если в первоначальном и в конечном состояниях температура одинакова, то константа нового равновесия будет прежней, но соотношение реагентов будет другим.
Принцип Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывается какое-либо внешнее воздействие, то равновесие в результате протекающих в системе процессов сместится таким образом, что оказанное воздействие уменьшится.
Влияние изменения концентраций на равновесие
При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расходования этого вещества, а при её уменьшении – в сторону образования этого вещества.
Пример 1. Если в смесь SO2, O2, SO3, находящуюся в равновесии,
2SO2 + O2 2SO3, добавить O2, то в соответствии с принципом Ле Шателье добавленный кислород будет расходоваться, т.е. преимущественно будет протекать прямая реакция окисления SO2, равновесие сместится вправо, выход SO3 увеличится.
К аналогичному выводу можно прийти,
анализируя закон действующих масс
(з.д.м.) для этого равновесия: 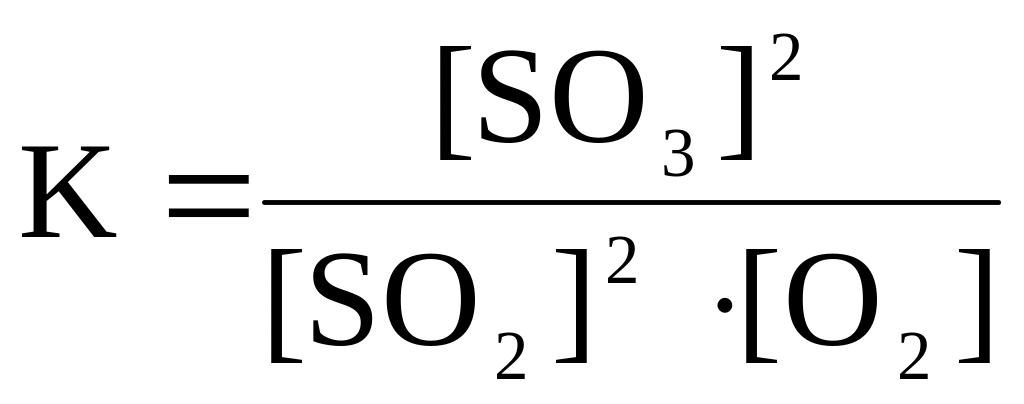
При добавлении O2 знаменатель дроби увеличится, равновесие нарушится, и для того, чтобы соотношение реагентов соответствовало з.д.м. (т.е. константа осталась прежней), концентрации SO2 и O2 должны уменьшаться, а концентрация SO3 – увеличиваться, а для этого должна преимущественно протекать прямая реакция.
Через некоторое время установится новое состояние равновесия. Как изменятся концентрации реагентов в сравнении с исходными? Очевидно, что концентрация SO2 уменьшится, а концентрация SO3 увеличится. А как изменится концентрация O2? Она будет меньшей, чем в момент его добавления, но большей, чем в исходном равновесии, т.к. добавка расходуется не полностью.
Пример 2. Изменением концентраций каких реагентов можно сместить влево равновесие? Ca3(PO4)2(тв.) 3Ca2+(р-р)+2PO43–(р-р)
Решение: в соответствии с принципом Ле Шателье сместить равновесие влево можно либо уменьшая концентрацию исходных веществ, либо увеличивая концентрации продуктов.
В данном примере к изменению концентрации твердого Ca3(PO4)2 равновесие не чувствительно (см. ранее особенности з.д.м. для гетерогенных равновесий). Следовательно, сместить равновесие влево можно, увеличив концентрацию либо Ca2+, либо PO43–. Первый вариант можно осуществить, добавив в раствор хорошо растворимую соль кальция, например, Ca(NO3)2. Увеличить концентрацию PO43– можно добавлением хорошо растворимого Na3PO4.
Одинаковым ли будет эффект смещения равновесия, если в одном случае увеличить вдвое концентрацию Ca2+, а в другом, также вдвое, увеличить концентрацию PO43–? Ответ на этот вопрос можно получить из выражения константы равновесия K = [Ca2+]3·[PO43–]2 .
Из этого уравнения видно, что поскольку показатели степеней при концентрациях реагентов разные, то и эффект от изменения концентраций будет разным.
Химическое равновесие более чувствительно к изменению концентрации того реагента, для которого в выражении константы показатель степени при концентрации больше (т.е. больший коэффициент в уравнении реакции).
Таким образом, при увеличении в равное число раз концентраций Ca2+ или PO43– эффект от изменения концентрации Ca2+ будет большим.
Пример 3. Как влияет разбавление раствора на равновесие диссоциации
HF H+ + F–
Напишем выражение з.д.м. для этого равновесия:
На первый взгляд добавление H2O не должно изменить равновесия, т.к. в уравнении реакции вода не фигурирует и в выражение константы она не входит. Однако разбавление раствора проявляется в другом: в изменении (уменьшении) концентраций реагентов, участвующих в равновесии и включенных в з.д.м. Действительно, если раствор разбавить вдвое, то (см. выражение К) знаменатель дроби уменьшится в два раза, а числитель – в четыре (22).
Для того чтобы соотношение реагентов соответствовало з.д.м. (т.е. константа осталась прежней), необходимо, чтобы знаменатель дроби уменьшился, а числитель – увеличился. Очевидно, что это реализуется в случае, если продиссоциирует дополнительное количество HF. Следовательно, при разбавлении данного раствора равновесие смещается вправо (степень диссоциации кислоты увеличится).
