
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Химические источники электрической энергии (хиээ)
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
Межмолекулярное взаимодействие
Природа межмолекулярного взаимодействия электромагнитная. Различают следующие варианты связывания молекул друг с другом:
– с образованием ковалентной связи (по донорно-акцепторному или обменному механизму; последний реализуется между молекулами–радикалами);
– связывание без обобществления электронов, за счет так называемых сил Ван-дер-Ваальса: ориентационного, индукционного и дисперсионного взаимодействий;
– образование водородных связей.
Ориентационное взаимодействие (рисунок 3.13) возможно между полярными молекулами, например галогеноводородов, аммиака, оксида серы(IV) и др.: при ориентации диполей относительно друг друга противоположно заряженными концами они связываются за счет электростатического притяжения. Чем полярнее молекулы, тем больше диполь-дипольное взаимодействие между ними.
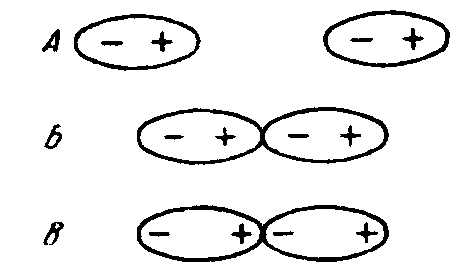
Рисунок 3.13 – Схема взаимодействия двух полярных молекул
Индукционное взаимодействие (рисунок 3.14) реализуется между полярной и неполярной молекулой, по механизму диполь-наведенный (индуцированный) диполь. Под действием полярной молекулы симметричная вначале электронная оболочка неполярной молекулы деформируется, и индуцированный диполь притягивается к диполю полярной молекулы. Примером такого взаимодействия может быть растворение в воде, молекулы которой полярные, неполярных молекул углекислого газа. Индукционное взаимодействие тем больше, чем более полярна одна из молекул и чем легче деформируется электронная оболочка неполярной молекулы.
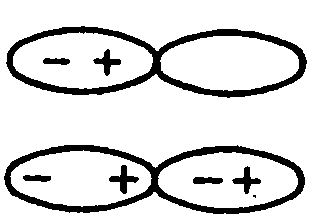
Рисунок 3.14 – Схема взаимодействия между полярной и неполярной молекулами
Дисперсионное взаимодействие возникает между неполярными молекулами за счет того, что в результате колебательного теплового движения электронной оболочки относительно ядер на короткое время образуются «мгновенные» диполи, взаимодействующие друг с другом. Из всех электростатических межмолекулярных взаимодействий дисперсионные – самые слабые; однако благодаря им оказывается возможным (при очень низких температурах) сжижение водорода, кислорода, азота, инертных газов. Дисперсионное взаимодействие тем больше, чем подвижнее электронная оболочка молекул. Так, в молекулярном азоте при тройной ковалентной связи между атомами электронная оболочка более «жесткая» по сравнению с молекулярным кислородом (связь двойная). Вследствие этого дисперсионное взаимодействие между молекулами N2 более слабое, и поэтому жидкий азот кипит при более низкой температуре, чем жидкий кислород. Эту особенность следует иметь в виду при работе с жидким азотом, т.к. в нем может конденсироваться кислород из воздуха.
Особенность водородной связи (рисунок 3.15) обусловлена уникальностью атома водорода – единственного атома, имеющего только один электрон. При связывании водорода с сильно электроотрицательными атомами его очень малый по размерам положительно поляризованный ион способен глубоко внедряться в электронные оболочки других атомов. Водородная связь весьма распространена и играет важную роль в процессах ассоциации, растворения, образования кристаллогидратов и др. Именно водородной связью обусловлены «аномальные» свойства воды (температура кипения, структура жидкой и кристаллической воды). Ассоциацией молекул HF за счет водородных связей объясняется наличие кислых солей «одноосновной» плавиковой кислоты, например KHF2.
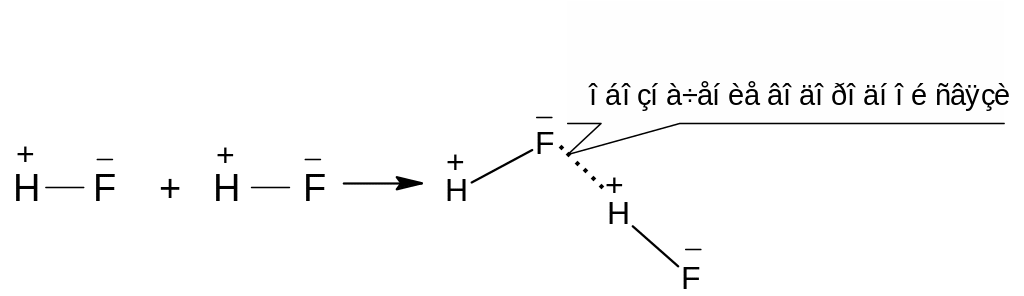
Рисунок 3.15 – Схема образования водородной связи между молекулами фтороводорода
Межмолекулярная ковалентная связь по донорно-акцепторному механизму образуется в случае, если атомы одной молекулы имеют неподеленные электронные пары, а атомы другой – вакантные валентные орбитали. Примером таких соединений могут быть AlCl3.NH3, BF3.NH3 и др. Межмолекулярные связи в этих соединениях образуются за счет донорных свойств азота в молекуле аммиака и акцепторных свойств атомов алюминия или бора в молекулах их галогенидов.
Образование ковалентной межмолекулярной связи по обменному механизму встречается редко, т.к. молекулярные радикалы, как правило, нестабильны. Примерами относительно стабильных молекулярных радикалов могут быть оксиды азота, NO и NO2. Наличием у них неспаренных электронов объясняется возможность их димеризации (и, как следствие – особенностями кинетики реакций с их участием, см. тему 5).
Энергия ван-дер-ваальсова взаимодействия в сравнении с ковалентной связью гораздо слабее. Так, если для разрыва связи между атомами в молекуле I–I требуется 148,8 кДж/моль, то энергия разрыва межмолекулярных связей при сублимации (возгонке) кристаллического иода равна 62,4 кДж/моль.
