
- •Первый закон термодинамики. Внутренняя энергия-функция состояния системы.
- •Энтальпия.
- •4. Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процессы).
- •5. Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процессы).
- •6. Теплоемкость и ее зависимость от температуры.
- •7. Закон Гесса – основной закон термохимии.
- •8.Уравнение Кирхгоффа в дифференциальной форме.
- •9.Уравнение Киргоффа в интегральной форме.
- •10.Второй з-н термодинамики. Понятие и определение.
- •11. Работа обратимого и необратимого процесса.
- •12. Цикл Карно.
- •13. Энтропия обратимых процессов.
- •14. Энтропия необратимых процессов.
- •15. Смысл энтропии:
- •16.Вычисление энтропий в различных условиях.
- •17. Свободная энергия Гельмгольца.
- •18. Свободная энергия Гиббса.
- •19. Уравнения Гиббса- Гельмгольца.
- •20. Химический потенциал.
- •21. Химический потенциал идеального и реального газа. Летучесть(или фугетивность).
- •22. Закон действующих масс. Константа равновесия.
- •23. Изотерма химической реакции Вант-Гофа.
- •24. Уравнение изобары.
- •25. Уравнение изохоры.
- •1Первый закон термодинамики. Внутренняя энергия-функция состояния системы.
21. Химический потенциал идеального и реального газа. Летучесть(или фугетивность).
Любые равновесные
св-ва газов можно выразить через величину
химического потенциала, если известна
зависимость химического потенциала от
температуры или давления. dG=-SdT+Vdp
если Т=const,
то dT=0 dG=Vdp pV=RT
n=1
моль V=RT/p
dG=RT*(dp/p)
dμi=RT(dp/p).
Проинтегрируем
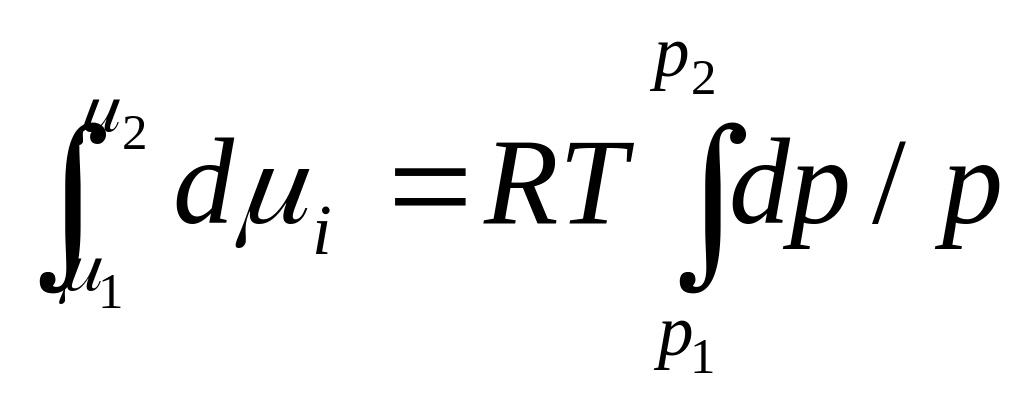 данная
формула связывает величину химического
потенциала с термодинамическими
параметрами. Если величина химического
потенциала зависит от температуры, то
необходимо брать неопределённый интеграл
и ввести при этом постоянную интегрирования.
В качестве постоянной интегрирования
используют стандартное состояние в-ва.
данная
формула связывает величину химического
потенциала с термодинамическими
параметрами. Если величина химического
потенциала зависит от температуры, то
необходимо брать неопределённый интеграл
и ввести при этом постоянную интегрирования.
В качестве постоянной интегрирования
используют стандартное состояние в-ва.
![]() (298
К) G0(298
К) F0(298
К). ∆μ=μ0(298
К)+RTln(p) Полученные ур-ния справедливы
только для идеальных газов, где изменение
их параметров подчиняется прямопропорциальной
зависимости ур-ния Менделеева Клапейрона.
(298
К) G0(298
К) F0(298
К). ∆μ=μ0(298
К)+RTln(p) Полученные ур-ния справедливы
только для идеальных газов, где изменение
их параметров подчиняется прямопропорциальной
зависимости ур-ния Менделеева Клапейрона.
Для реальных газов наблюдается отклонение от идеальности, так как их состояние нельзя описать (особенно при высоких р) ур-нием Менделеева Клапейрона. Для сохранения простых зависимостей Льюис ввёл новую ф-цию – фугитивность или термодинамическую летучесть. Эта ф-ция связывает св-ва реальных газов с их термодинамическими параметрами, так же как давление в идеальных газах.
Летучесть – это то давление при котором реальный газ занимает тот же объём, что и идеальный ∆μ=RTln(f2/f1) f=γp – коэффициент летучести, величина безразмерная.
![]() limp
limp![]() 0(f/p)=1
U=γc
U
– активность, γ – коэф. активности.
0(f/p)=1
U=γc
U
– активность, γ – коэф. активности.
22. Закон действующих масс. Константа равновесия.
H2(г)+J2(г)← →2HJ(г) Kc=K1/K2=CHI/(CH2CI2) Kc – константа равновесия выражения через концентрацию. Данное выр-ние – закон действующих масс. Математически закон действующих масс явл. выр-нием законов термодинамики для равновесия химических процессов. Отношение концентраций продуктов реакции к концентрации исх. в-в в степенях равных стехиометрическим коэф. при данной температуре есть величина постоянная. 3H2(г)+N2(г)← →2NH3(г)
![]()
![]()
![]()
В момент наступления равновесия наблюдаем следующее равенство: + =
μ=μ0+RTlnP применим эту формулу для каждого участника реакции
3
0+3RTln![]() +
+
0+RTln
+
+
0+RTln![]() =2
0+2RTln
=2
0+2RTln![]()
ln /( 3 )=(3 0+ 0-2 0)/RT=lnKp данное выр-ние при Р,Т=const есть величина постоянная Кр= 2/( 3 ) Кр – константа равновесия выр-ния через порциальное давление.
23. Изотерма химической реакции Вант-Гофа.
Закон действующих масс устанавливает функциональную зависимость изменения количества вещества реагентов в равновесных условиях. Исходя из уравнения, можно определить равновесные концентрации всех компонентов реакции. Однако данный закон не позволяет изменить соотношение концентраций при изменении внешних условий. Эту зависимость устанавливает уравнение изохоры, изотермы, изобары Вант-Гофа. Для определения зависимости константы равновесия от давления и температуры необходимо определить константой равновесия и термодинамическими потенциалами.
Пусть при T, P=const, протекает реакция N2+H2=2NH3
Даны два резервуара А и В, в А при постоянной температуре поместили равновесную смесь N2 , H2, NH3, с равновесными парциальными давлениями.
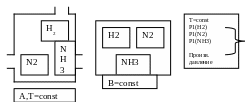
Проведем синтез аммиака. Из емкость В отберем 1 моль N2 и 3 моль H2.
А1=p1H2*∆VH2+p1N2*∆VN2=3RT+RT=4RT
Заменяем ∆V на V, т.к объемы достаточно велики, а затем воспользуемся уравнением Менделеева-Клаперона.
Изотермический: сожмем азот и водород в ящике В до парциального давления в ящике А.
A2=3RT*lnP1H2/PH2+RT*lnP1N2/PN2
Подсоеденим цилиндры с газами к третьему отверстию И введем в цилиндр 1 моль N2 и 3 моль H2, одновременно отберем 2 моль NH3 .
3. Давление NH3 равно равновесному. Таким образом, мы провели реакцию получения NH3.
А3=-PH2*∆VH2-PN2*∆VN2+PNH3*∆VNH3= –3RT-RT+2RT=-2RT
Изотермическое сжатие NH3 в цилиндре.
A4=2RT*lnPNH3/P1NH3
5. Введем NH3 в резервуар В.
А5=-P1NH3*VNH3= – 2RT
Определим общую работу, сложив работы по 5 пунктам. Получаем следующее уравнение: A=RT*ln(P2NH3/P3H2*PN2) – RT*ln(P12NH3/P21H2*PN2)
Установим смысл работы в данном направлении, т.к. мы приняли, что изменением объема можно пренебречь, следовательно, пренебрегаем и работой и внешних сил, А max полезная работа, равная убыли энергии Гибсса данной реакции.
А= – ∆rG ∆rG=RT∑1i nilnPi – RTlnKp (1а)
При постоянном температуре и объеме А= – ∆F
∆F= RT∑1i nilnCi – RTlnKc (1б)
(1б) – уравнение изотермы Вант-Гофа . Если Pi и Ci =1, при стандартных условиях
∆rG0= – RTlnKp
∆rF0= – RTlnKc
1а и 1б – уравнения химического сродства, они характеризуют способность веществ вступать в химическое взаимоотношение между друг другом, т.е. реакция между веществами возможна, если при данных условиях ∆G0 и ∆F0 <0. Из этих уравнений можно рассчитать условия, при которых возможно протекание в нужных направлениях. Под химическим сродством понимают совокупность физических и химических условий, которыми в данной системе создается возможность протекания физико-химических процессов связанных с изменением свойства вещества.
