
- •Неравенство Клаузиуса
- •Термодинамическое определение энтропии
- •[Править] Статистическое определение энтропии: принцип Больцмана
- •[Править] Понимание энтропии как меры беспорядка
- •[Править] Границы применимости понимания энтропии как меры беспорядка
- •[Править] Энтропия в открытых системах
- •[Править] Измерение энтропии
- •[Править] Построение графика изменения энтропии
Формулировки
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло Q1 у нагревателя, отдав Q2 холодильнику и совершив при этом работу A = Q1 − Q2. После этого воспользуемся процессом Клаузиуса и вернем тепло Q2 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид[2]:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S(T,x,N), называемая энтропией, такая, что ее полный дифференциал dS = δQ / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
[править] Ограничения
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала. Смотри также Демон Максвелла.
[править] Второе начало термодинамики и «тепловая смерть Вселенной»
Клаузиус, рассматривая второе начало термодинамики, пришёл к выводу, что энтропия Вселенной как замкнутой системы стремится к максимуму, и в конце концов во Вселенной закончатся все макроскопические процессы. Это состояние Вселенной получило название «тепловой смерти». С другой стороны, Больцман высказал мнение, что нынешнее состояние Вселенной — это гигантская флуктуация, из чего следует, что большую часть времени Вселенная все равно пребывает в состоянии термодинамического равновесия («тепловой смерти»)[3].
По мнению Ландау, ключ к разрешению этого противоречия лежит в области общей теории относительности: поскольку Вселенная является системой, находящейся в переменном гравитационном поле, закон возрастания энтропии к ней неприменим[4].
Поскольку второе начало термодинамики (в формулировке Клаузиуса) основано на предположении о том, что вселенная является замкнутой системой, возможны и другие виды критики этого закона. В соответствии с современными физическими представлениями мы можем говорить лишь о наблюдаемой части вселенной. На данном этапе человечество не имеет возможности доказать ни то, что вселенная есть замкнутая система, ни обратное.
[править] Энтропия и критика эволюционизма
Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно.[5][6]. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. с диссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
Переходя ко второму началу термодинамики, Клаузиус рассматривает круговые обратимые процессы и указывает, что в простом круговом процессе типа цикла Карно совершаются два вида превращений: переход теплоты в работу и переход теплоты более высокой температуры в теплоту более низкой температуры. Второе начало «должно выражать отношение между этими двумя превращениями». Оба эти превращения — «явления одинаковой природы» и в обратимом процессе могут замещать друг друга. Клаузиус формулирует второе начало как принцип эквивалентности превращения следующим образом:
«Если мы назовем эквивалентными два превращения, которые могут замещать друг друга, не требуя для этого никакого другого длительного измене- , ния, то возникновение из работы количества теплоты Q, имеющего температуру Т, обладает эквивалентом Q/τ, а переход количества теплоты Q от температуры T1, к температуре Т2 имеет эквивалент Q (1/τ 2-1/τ 1), где τ есть некоторая функция температуры, независимая от рода процесса, с помощью которого совершаются превращения». Клаузиус показывает, что для обратимого кругового процесса сумма эквивалента равна нулю:

Это, по Клаузиусу, является математическим выражением второго начала. «Стоящее под знаком интеграла выражение dQ/τ, — пишет Клаузиус, —является дифференциалом некоторой связанной с состоянием тела величины, которая полностью определена, если известно состояние тела в рассматриваемый момент, хотя бы ничего не было известно о пути, по которому тело в рассматриваемое состояние пришло». Эту функцию Клаузиус ввел в 1865 г. и назвал энтропией (от греческого слова «тропэ»— превращение). Дифференциал энтропии
dS=dQ/τ.
Для определения функции температуры τ Клаузиус рассматривает обратимый процесс с идеальным газом. В этом случае отношение отданной и поглощенной теплоты Q и Q, будет равно отношению температур:
Q/Q1=T/T1. С другой стороны,
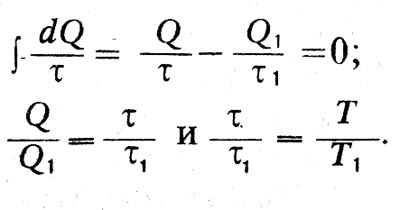
Следовательно,
<τ/T = const.
Постоянная не имеет существенного значения. Принимая ее равной 1, получим τ=T и dS=dQ/T.
Для необратимых процессов
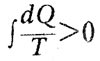
и энергия, способная к превращениям, уменьшается, а энтропия соответственно растет. Клаузиус формулирует второе начало термодинамики в виде положения: «Энтропия Вселенной стремится к максимуму». Так через 20 лет после Томсона Клаузиус также пришел к концепции «тепловой смерти». Постулат Клаузиуса и концепция тепловой смерти вызвали большое количество возражений. Были придуманы многочисленные эксперименты, казалось, противоречащие принципу Карно -Клаузиуса. Очень тонкий мысленный эксперимент выдвинул Максвелл в своей «Теории тепла» (1870). Максвелл сначала считал, что второе начало имеет ограниченную область применения. «Это положение, — писал Максвелл о втором начале, — несомненно верно, пока мы имеем дело с телами большой массы и не имеем возможности ни различать отдельных молекул в этих массах, ни работать с ними. Но если представить себе существо со столь изощренными способностями, что оно было бы в состоянии следить за каждой отдельной молекулой во всех ее движениях, то подобное существо было бы способно сделать то, что для нас в настоящее время невозможно... Представим себе..., что какой-нибудь сосуд разделен на две части А и В перегородкой с маленьким отверстием в ней. Пусть существо, способное различать отдельные молекулы, попеременно то открывает, то закрывает отверстие, и притом таким образом, чтобы только быстро движущиеся могли переходить из Л в Б, и только медленнее движущиеся, наоборот, из В в А: Следовательно, такое существо без затраты работы повысит температуру в В и понизит ее в А — вопреки второму началу термодинамики ».
Основные части теплового двигателя
В современной технике механическую энергию получают главным образом за счет внутренней энергии топлива. Устройства, в которых происходит преобразование внутренней энергии в механическую, называют тепловыми двигателями. <Приложение 2>
Для совершения работы за счет сжигания топлива в устройстве, называемом нагревателем, можно воспользоваться цилиндром, в котором нагревается и расширяется газ и перемещает поршень. <Приложение 3> Газ, расширение которого вызывает перемещение поршня, называют рабочим телом. Расширяется же газ потому, что его давление выше внешнего давления. Но при расширении газа его давление падает, и рано или поздно оно станет равным внешнему давлению. Тогда расширение газа закончится, и он перестанет совершать работу.
Как же следует поступить, чтобы работа теплового двигателя не прекращалась? Для того чтобы двигатель работал непрерывно, необходимо, чтобы поршень после расширения газа возвращался каждый раз в исходное положение, сжимая газ до первоначального состояния. Сжатие же газа может происходить только под действием внешней силы, которая при этом совершает работу (сила давления газа в этом случае совершает отрицательную работу). После этого вновь могут происходить процессы расширения и сжатия газа. Значит, работа теплового двигателя должна состоять из периодически повторяющихся процессов (циклов) расширения и сжатия.
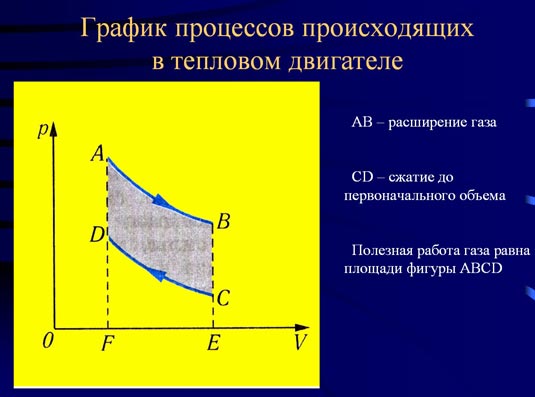
Рисунок 1
На Рисунке 1 изображены графически процессы расширения газа (линия АВ) и сжатия до первоначального объема (линия CD). Работа газа в процессе расширения положительна (AF > 0) и численно равна площади фигуры ABEF. Работа газа при сжатии отрицательна (так как AF < 0) и численно равна площади фигуры CDEF. Полезная работа за этот цикл численно равна разности площадей под кривыми АВ и CD (закрашена на рисунке). Наличие нагревателя, рабочего тела и холодильника принципиально необходимое условие для непрерывной циклической работы любого теплового двигателя.
Коэффициент полезного действия тепловой машины
Рабочее
тело, получая некоторое количество
теплоты Q1от
нагревателя, часть этого количества
теплоты, по модулю равную |Q2|,отдает
холодильнику. Поэтому совершаемая
работа не может быть больше A
= Q1
— |Q2|.
Отношение
этой работы к количеству теплоты,
полученному расширяющимся газом от
нагревателя, называется коэффициентом
полезного действия
![]() тепловой
машины:
тепловой
машины:
![]()
Коэффициент полезного действия тепловой машины, работающей по замкнутому циклу, всегда меньше единицы. Задача теплоэнергетики состоит в том, чтобы сделать КПД как можно более высоким, т. е. использовать для получения работы как можно большую часть теплоты, полученной от нагревателя. Как этого можно достигнуть? Впервые наиболее совершенный циклический процесс, состоящий из изотерм и адиабат, был предложен французским физиком и инженером С. Карно в 1824 г.
Принцип действия машины Карно |
|
|
|
Принципы действия устройств - Тепловые машины |
|
Рейтинг 4.0/5 (60 голосов)
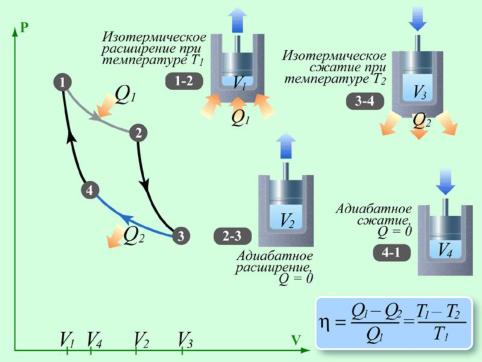
Н.Л.С. Карно (1796-1832) - французский физик, инженер, показал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами, иначе это противоречило бы второму началу термодинамики. В Принцип действия теплового двигателя приведём на примере (рис.1): от термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передаётся количество теплоты Q2, при этом совершается работа A = Q1 - Q2. Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине, принцип действия которой представим на примере (рис.2): системой за цикл от термостата с более низкой температурой T2 отнимается количество теплоты Q2 и отдаётся термостату с более высокой температурой T1 количество теплоты Q1. Для кругового процесса Q=A, но по условию, Q=Q2-Q1<0, поэтому A<0 и Q2-Q1=-A или Q1=Q2+A, т. е. количество теплоты Q1, отданное системой источнику теплоты при более высокой температуре T1, больше количества теплоты Q2 полученного от источника теплоты при более низкой температуре T2, на величину работы, совершенной над системой. Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать её более нагретому. Это утверждение есть не что иное, как второе начало термодинамики в формулировке Клаузиуса. О Основываясь на втором начале термодинамики, Карно вывел теорему, носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (T1) и холодильников(T2), наибольшим к.п.д. обладают обратимые машины; при этом к.п.д. обратимых машин, работающих при одинаковых температурах нагревателей (T1) и холодильников (T2) равны друг другу и не зависят от природы рабочего тела (тела, совершающего круговой процесс и обменивающегося энергией с другими телами), а определяются только температурами нагревателя и холодильника. Карно теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно. Рассмотрим принцип действия изотермического и адиабатического процессов. При изобарическом расширении только часть получаемого телом тепла тратится на работу. Остальная часть переходит во внутреннюю энергию. Если работа, совершенная газом, точно равна поглощенному теплу, то внутренняя энергия газа остаётся без изменения. Температура при этом тоже не будет меняться. Такой процесс называется изотермическим. Теплоотдача - не единственный способ увеличения внутренней энергии газа. Её можно увеличить, сжимая газ. Если такое сжатие или расширение не сопровождается передачей тепла каким-либо телам, то процесс называется адиабатным. При адиабатном процессе работа сжатия целиком переходит во внутреннюю энергию тела. Полностью устранить теплообмен газа с окружающими телами невозможно. Но можно вести сжатие в условиях, когда этим теплообменом можно пренебречь. Так, если быстро сжать газ в каком-либо объеме, то теплоотдачей через стенки объема можно пренебречь, а процесс можно считать адиабатным.
Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем. Цикл Карно можно изобразить на графике (рис.3), где изотермические расширение и сжатие заданы соответственно кривыми 1-2 и 3-4, а адиабатические расширение сжатие - кривыми 2-3 и 4-1 . При изотермическом процессе U=const, поэтому количество теплоты Q1, полученное газом от нагревателя, равно работе расширения A12, совершаемой газом при переходе из состояния 1 в состояние 2:
При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует, и работа расширения A23 совершается за счет изменения внутренней энергии и:
Количество теплоты Q2, отданное газом холодильнику при изотермическом, сжатии равно работе сжатия A34:
Работа адиабатического сжатия Работа, совершаемая в результате кругового процесса ,
и, как можно показать определяется площадью, заштрихованной на рис.3. Термический к.п.д. цикла Карно
Применив уравнение для диабад 2-3 и 4-1, получим
откуда Подставляя (1) и (3) в формулу (6) получаем т. е. для цикла Карно к.п.д. действительно определяется только температурами нагревателя и холодильника. Для его повышения необходимо увеличивать разность температур нагревателя и холодильника. К.п.д. всякого реального теплового двигателя из-за трения и неизбежных тепловых потерь гораздо меньше вычисленного для цикла Карно. Обратный цикл Карно положен в основу действия тепловых насосов. В отличие от холодильных машин тепловые насосы должны как можно больше тепловой энергии отдавать горячему телу, например, системе отопления. Часть этой энергии отбирается от окружающей среды с более низкой температурой, а часть - получается за счет механической работы, производимой, например, компрессором. Теорема Карно послужила основанием для установления термодинамической шкалы температур. Для сравнения температур двух тел необходимо осуществить обратимый цикл Карно, в котором одно тело используется в качестве нагревателя, другое - холодильника. Отношение температур тел равно отношению отданного в этом цикле количества теплоты к полученному. Согласно теореме Карно химический состав рабочего тела не влияет на результаты сравнения температур, поэтому такая термодинамическая шкала не связана со свойствами какого-то определённого термодинамического тела. Отметим, что практически таким образом сравнивать температуры трудно, так как реальные термодинамические процессы, как уже указывалось, являются необратимыми. |
|
Неравенство Клаузиуса
Совместное применение первой и второй теорем Карно позволяет получить следующее неравенство:
|
(3.41) |
Знак равенства в этой формуле соответствует случаю описания обратимой тепловой машины, а знак меньше - описанию необратимой тепловой машины.
Формулу (3.41) можно преобразовать в виду
|
(3.42) |
Выражение (3.42) в свою очередь дает
|
(3.43) |
или
|
(3.44) |
Если
полученное выражение записать через
количество теплоты, подводимой к рабочему
телу от нагревателя
![]() и
холодильника
и
холодильника
![]() ,
то оно примет окончательную форму
,
то оно примет окончательную форму
|
(3.45) |
Формула (3.45) представляет собой частный случай неравенства Клаузиуса.
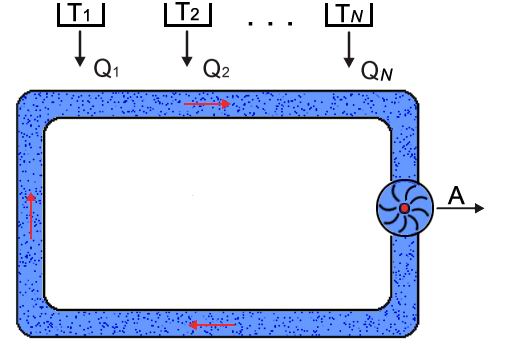
Для
получения неравенства Клаузиуса в общем
случае рассмотрим тепловую машину,
рабочее тело которой при совершении
кругового термодинамического процесса
обменивается теплотой с достаточно
большим числом тепловых резервуаров
(нагревателей и холодильников), имеющих
температуры
![]() ,
,
![]() ,...,
,...,
![]() (см.
рис. 3.11). При этих теплообменах рабочее
тело получает от тепловых резервуаров
теплоты
,
(см.
рис. 3.11). При этих теплообменах рабочее
тело получает от тепловых резервуаров
теплоты
,
![]() ,...,
,...,
![]() .
Работа такой тепловой машины будет
равна:
.
Работа такой тепловой машины будет
равна:
![]() .
При использовании этого выражения
необходимо учитывать, что теплоты
.
При использовании этого выражения
необходимо учитывать, что теплоты
![]() могут
иметь отрицательный знак в случае, если
в при теплообмене с
могут
иметь отрицательный знак в случае, если
в при теплообмене с
![]() -тым
резервуаром теплота отбирается от
рабочего тела.
-тым
резервуаром теплота отбирается от
рабочего тела.
|
Рис. 3.11. Схема тепловой машины с большим числом нагревателей и холодильников |
Применительно к рассматриваемой тепловой машине неравенство (3.45) может быть записано в виде
|
(3.46) |
или
|
(3.47) |
Величина
![]() называется
приведенным
количеством теплоты, которое
численно равно количеству теплоты,
полученной системой, при абсолютной
температуре
называется
приведенным
количеством теплоты, которое
численно равно количеству теплоты,
полученной системой, при абсолютной
температуре
![]() ,
деленной на эту температуру.
,
деленной на эту температуру.
При переходе к бесконечному числу тепловых резервуаров, с которыми рабочее тело тепловой машины обменивается теплотой, суммирование в формуле (3.47) может быть заменено интегрированием по замкнутому термодинамическому циклу:
|
(3.48) |
Из этой формулы следует, что сумма приведенных количеств теплоты на замкнутом цикле для любой термодинамической системы не может быть больше нуля. Неравенство (3.48) было получено в 1862 году Клаузиусом и носит его имя.
Неравенство Клаузиуса (3.48) позволяет отличать обратимые и необратимые круговые термодинамические процессы. В случае, если термодинамический цикл состоит только из обратимых процессов, неравенство (3.48) переходит в равенство Клаузиуса
|
(3.49) |
имеющее принципиальное значение для построения равновесной термодинамики.
Случай строгого неравенства в формуле (3.48) соответствует описанию необратимых круговых термодинамических процессов, и это выражение применяется в неравновесной термодинамике.

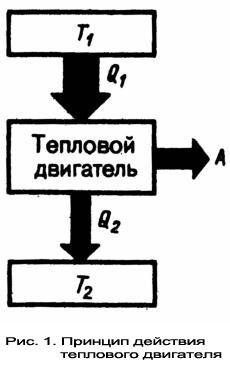 торое
начало термодинамики исторически
возникло из анализа работы тепловых
двигателей. Из формулировки второго
начала термодинамики по Кельвину
следует, что вечный двигатель второго
рода - периодически действующий
двигатель, совершающий работу
за счет охлаждения одного источника
теплоты, - невозможен.
торое
начало термодинамики исторически
возникло из анализа работы тепловых
двигателей. Из формулировки второго
начала термодинамики по Кельвину
следует, что вечный двигатель второго
рода - периодически действующий
двигатель, совершающий работу
за счет охлаждения одного источника
теплоты, - невозможен.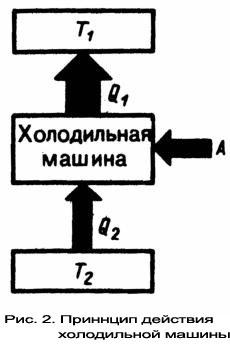 днако
вторе начало термодинамики не
следует представлять так, что оно
совсем запрещает переход теплоты
от менее нагретого тела к более
нагретому. Ведь именно такой переход
осуществляется в холодильной машине.
Но при этом надо помнить, что внешние
силы совершают работу над системой,
т. е. этот переход не является
единственным результатом процесса.
днако
вторе начало термодинамики не
следует представлять так, что оно
совсем запрещает переход теплоты
от менее нагретого тела к более
нагретому. Ведь именно такой переход
осуществляется в холодильной машине.
Но при этом надо помнить, что внешние
силы совершают работу над системой,
т. е. этот переход не является
единственным результатом процесса.
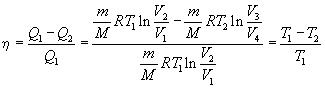
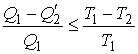 .
.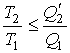 .
.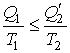 ,
, .
.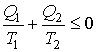 .
.
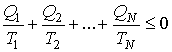 ,
,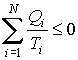 .
.