
- •Методы исследования в микробиологии
- •Техника безопасности при работе с биологическим материалом
- •Характеристика уровней биобезопасности
- •Забор, хранение и транспортировка материала для микробиологического исследования
- •Микроскопический (бактериоскопический) метод исследования (бсми)
- •1 Этап бсми. Забор, хранение и транспортировка материала.
- •2 Этап бсми. Приготовление микропрепаратов.
- •1) Препараты, позволяющие изучать микроорганизмы в убитом состоянии:
- •Препараты, позволяющие изучать микроорганизмы в живом состоянии:
- •Сложные методы окраски клеточных структур бактерий
- •Сравнение электронного и светового микроскопов
- •4 Этап бсми. Заключение.
- •Культивирование микроорганизмов на питательных средах
- •Классификации питательных сред
- •I. По происхождению:
- •II. По составу:
- •III. По консистенции:
- •IV. По назначению:
- •Наиболее часто используемые индикаторы рН в питательных средах
- •Среды для получения изолированных колоний.
- •Среды для накопления чистой культуры.
- •Среды для идентификации микроорганизмов.
- •Признаки колоний микроорганизмов
- •Методы выделения чистых культур аэробных и факультативно-анаэробных микроорганизмов
- •I. Методы механического разобщения бактерий.
- •Методы выделения чистых культур облигатно-анаэробных микроорганизмов
- •Культуральный (бактериологический) метод исследования
- •I. Этапы блми при выделении чистой культуры аэробов и факультативных анаэробов.
- •1 Этап.
- •2 Этап.
- •3 Этап.
- •Признаки, учитываемые при идентификации микроорганизмов (критерии вида)
- •4 Этап.
- •II. Этапы блми при выделении чистой культуры облигатных анаэробов.
- •1 Этап.
- •2 Этап.
- •Биохимическая идентификация микроорганизмов
- •Идентификация микроорганизмов без выделения чистой культуры
- •Принципы молекулярно-генетического анализа
- •Классификация молекулярно-генетических методов
- •Методы, основанные на изучении фрагментов днк.
- •Методы, основанные на гибридизации нуклеиновых кислот.
- •III. Методы, основанные на амплификации нуклеиновых кислот.
- •Характеристика стадий пцр
- •IV. Методы анализа амплифицированных фрагментов.
- •V. Методы, основанные на определении последовательности нуклеотидов в днк, рнк и аминокислот в белках.
- •VI. Методы, основанные на модификации генетической информации.
- •Характеристика штаммов e. Сoli, участсвующих в процессе конъюгации
- •Определение факторов патогенности бактерий
- •5. Капсула.
- •7. Изучение неизвестных токсинов и других факторов патогенности микроорганизмов, механизмы действия которых недостаточно изучены.
- •Методы изучения чувствительности бактерий к антибиотикам
- •Классификация методов определения
- •Основные понятия
- •Дискодиффузионный метод
- •Пропорционален антибиотикочувствитель-ности микроорганизма
- •Метод разведений в агаре
- •Метод разведений в жидких средах
- •Ускоренный метод
- •Автоматизированнный метод с использованием автоматических микробиологических анализаторов
- •Генетические методы
- •Состав питательной среды:
- •Величина посевной дозы и состояние тест-микроорганизмов (инокулюм-эффект):
- •Условия инкубации:
- •Биологический (экспериментальный) метод исследования
- •1 Этап эсми. Взятие и обработка материала.
- •2 Этап эсми. Выбор и заражение лабораторного животного.
- •3 Этап эсми.
- •Общие принципы серологического метода исследования
- •Определение активности гуморального поствакцинального индивидуального или коллективного иммунитета;
- •Определение титров диагностических, лечебных и профилактических сывороток;
- •I. Достоинства слми:
- •II. Недостатки слми:
- •Наличие ложных результатов:
- •Общие принципы аллергологического метода исследования
- •I этап алми. Сбор аллергологического анамнеза с целью:
- •Достоинства алми:
- •II. Недостатки алми:
- •Оглавление
7. Изучение неизвестных токсинов и других факторов патогенности микроорганизмов, механизмы действия которых недостаточно изучены.
Рис.
43.
Иммуноцитохимическое выявление амидазы
В. subtilis
с использованием
антител, меченных коллоидным золотом
и электронной микроскопии
Для выявления факторов вирулентности мало изученных возбудителей проводят 2D-электрофорез в геле разрушенных ультразвуком вирулентных и авирулентных форм микроорганизмов, относящихся к одному виду (рис. 44 а, б). Сравнивают электрофореграммы и определяют расхождения между ними. Белки, присутствующие только у вирулентных микроорганизмов, секвенируют. Прогнозируют ген, кодирующий секвенированный белок. Проводят поиск гена в геноме бактерии, клонируют его в Е.coli, выделяют белок с использованием жидкостной хроматографии или капиллярного электрофореза, изучают структуру методами масс-спектрометрии, рентгеноструктурной кристаллографии (рис. 44 в). Аналогичным образом можно изучать не только клеточные лизаты бактерий, но и секретируемые в культуральную жидкость белки и токсины, для чего проводят 2D-электрофорез безмикробной культуральной жидкости. Кроме того, можно не выделять отдельные белки, так как использование масс-спектрометрии позволяет идентифицировать множество пептидов, находящихся в смеси.
Для выявления эффектов, оказываемых токсинами на клетки или ткани, проводят эксперименты на культуре клеток и лабораторных животных.


а б в
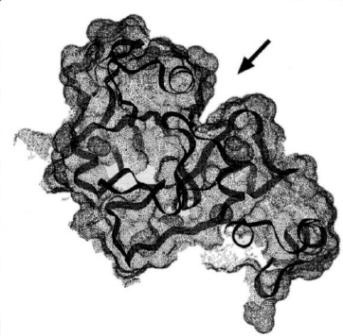
Рис. 44. Сравнительный 2D-электрофорез вирулентных (а) и авирулентных (б) форм одного вида микроорганизмов (стрелками обозначены белки, присутствующие только у вирулентных форм; 3D-структуру этих белков устанавливают рентгеноструктурным анализом (в))
8. Определение ферментов обмена веществ и ферментов-токсинов (см. определение биохомических свойств микробов – гемолизинов, лецитиназы, протеаз, липаз, плазмокоагулазы и др.).
9. Для выявления сенсибилизации к микробным аллергенам ставят кожно-аллергические пробы (например, пробу Манту).
10. Для выявления протективных антигенов (пептидов, приводящих к формированию противоинфекционного иммунитета) проводят сравнительный анализ геномов микроорганизмов и определяют спектр генов, которые потенциально могут кодировать протективные антигены. Эти гены клонируют в Е. coli, клонированные белки выделяют и изучают их иммуногенные свойства на лабораторных животных, проводят селекцию наиболее иммуногенных пептидов, которые могут стать компонентом вакцин.
Однако следует помнить, что не всегда патогенность возбудителя, выявляемая in vitro, соответствует реакциям, реализуемым возбудителем in vivo. Это связано с различием экспрессии генов в разных условия микроокружения. Молекулярно-генетические методы открыли новые возможности в изучении основных клеточных молекул. Зная геномы и протеомы возбудителей, человек получил возможность проникнуть еще глубже в понимание организации живого. Несмотря на это, пока не были сделаны глобальные открытия, позволяющие контролировать вирулентные свойства микробов, предотвращая развитие заболеваний.
