
Теории катализа Теория активных ансамблей
Эта теория была создана (1939 г., Кобозев) для катализаторов, представляющих собой нанесенное на инертный носитель активное вещество –собственно катализатор, который находится в микрогетерогенном состоянии в виде коллоидных частиц на поверхности кристалла. Обмен атомами катализатора между отдельными частицами затруднен, т.к. последние зафиксированы на носителе.
Теория основана на двух предположениях:
1. Активный центр катализатора представляет собой ассоциат Меn (n= 1,2,3…), называемый активным ансамблем (АА).
2. Поверхность инертного носителя состоит из областей, которые отделены друг от друга геометрическими или энергетическими барьерами (области миграции). Атомы катализатора свободно мигрируют внутри каждой из этих областей, образуя ансамбли с различными n, но не могут перейти в другую область.
Активный ансамбль состоит из определенного числа атомов металла (na) внутри области миграции, хотя ансамбли могут содержать разное количество атомов.
Эта теория позволяет на основе экспериментальной зависимости активности катализатора от степени покрытия носителя рассчитать число атомов в активном ансамбле, число областей миграции и активность одного отдельного активного ансамбля. Поскольку активность катализатора максимальна при количестве атомов Ме в ансамбле na , то na можно определить из зависимости активности катализатора от числа атомов (ν) Ме в одной области миграции.
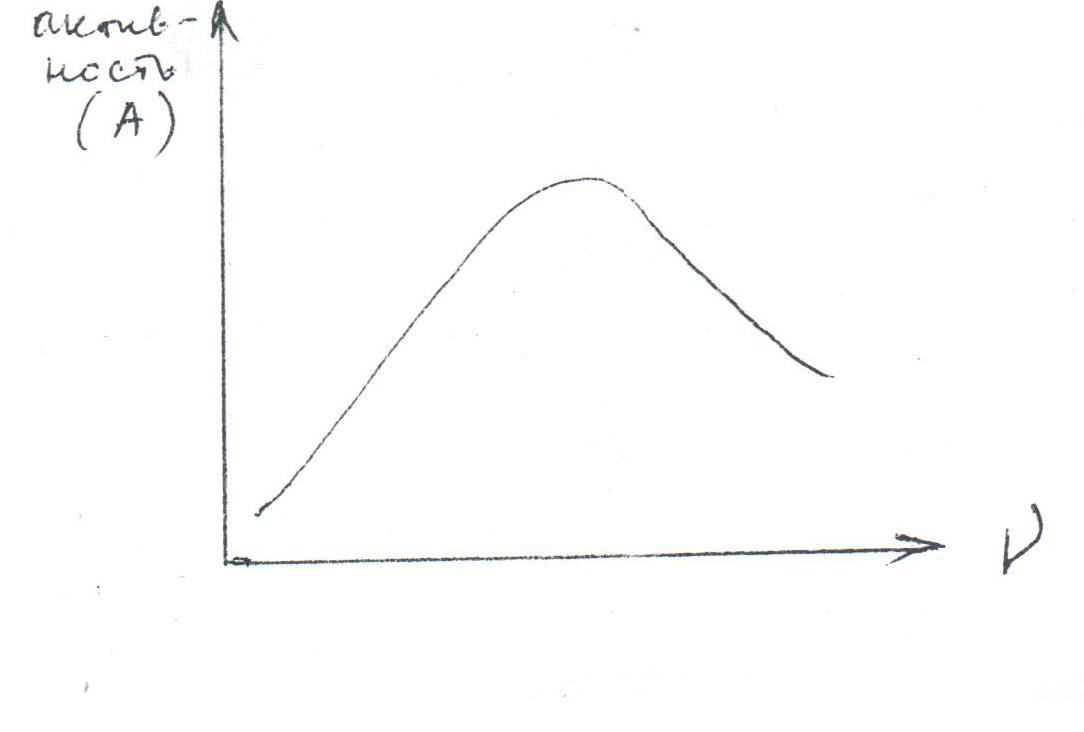
Активность адсорбционного катализатора (это количество вещества, которое прореагировало на 1 г адсорбированного катализатора) равна:
А = Zn r n , где
Zn – число активных ансамблей на поверхности 1 г катализатора,
r n - активность одного ансамбля.
Число активных ансамблей Zn можно определить следующим образом:
Zn = Zо Wn , где
Wn - вероятность образования активного ансамбля,
Zо – число областей миграции на поверхности 1 г катализатора.
Zо = S/Δ, где
S-поверхность 1 г носителя, Δ– средняя поверхность области миграции.
Вероятность образования разных ансамблей зависит от степени покрытия катализатором поверхности носителя, т.е. при любой степени покрытия есть вероятность возникновения любого ансамбля, но наиболее вероятно возникновение какого-то одного.

Эта вероятность описывается законом Пуассона:
Wn = (νna/ na!)e-ν , где
ν – среднее число атомов катализатора в одной области миграции
ν = N/ Zо ( N – число атомов Ме, нанесенных на 1 г носителя), также ν = Р ·Θ, где
Р – наибольшее число атомов Ме в области миграции, имеющей среднюю поверхность Δ: Р= Δ/σм (σм – поверхность 1 атома Ме),
Θ = N · σм / S.
Используя все приведенные уравнения, получим, что активность катализатора равна:
А= К ·Θna ℮-РΘ (2), где К= r n ·S· Рna / Δ·na!
Введя понятие удельной активности адсорбционного катализатора – это активность адс-го кат-ра при данной степени заполнения Θ, пересчитанная на Θ=1, получим:
а = А/ Θ, подставляя в это уравнение выражение (2):
а = К ·Θna-1 ·℮-РΘ.
Чтобы определить степень заполнения (Θ(А)max и Θ(а)max), при которой А и а достигают максимального значения, приравняем первые производные к нулю:
dА/dΘ = 0 и dа/dΘ = 0
и получим: na = Р ·Θ(А)max и na -1 = Р ·Θ(а)max. Отсюда:
na = Р ·Θ(А)max = Θ(А)max / (Θ(А)max - Θ(а)max ).
Используя приведенные выше уравнения можно также вычислить активность одного ансамбля:
r n = na! (℮/na) na А max ·na/ N
Т.о., зная зависимость активности и удельной активности катализатора от степени покрытия Θ можно вычислить основные параметры теории активных ансамблей r n и na.
Теория неплохо зарекомендовала себя на практике, но неприменима к кристаллическим катализаторам.
