
5 quants / labN1 (H2)
.docx
ИНСТИТУТ ТОНКИХ ХИМИЧЕСКИХ ТЕХНОЛОГИЙ им. М.В.Ломоносова
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
ОТЧЕТ О ЛАБОРАТОРНОЙ РАБОТЕ ПО ФИЗИЧЕСКОЙ ХИМИИ
«Квантово химический расчет молекулы водорода с использованием программы HyperChem»
Выполнил:
Проверил:
Москва, МИТХТ
2018
Цель работы:
-
Ознакомление с программой для квантово-химических расчетов HyperChem;
-
Расчет молекулярных характеристик молекулы H2 полуэмпирическим методом MNDO
Объект исследования: молекула водорода
Расчетный метод: полуэмпирический метод MNDO
Теоретическая часть
Молекулярная орбиталь (МО)- одноэлектронная многоцентровая волновая функция, описывающая состояние электрона в молекуле , задаваемая набором трех квантовых чисел.
Метод молекулярных орбиталей .
1. Молекула рассматривается как целое. Каждый электрон принадлежит молекуле в целом и движется в поле всех ее ядер и электронов. 2. Используется одноэлектронное (орбитальное) приближение. 3. Каждой МО соответствует определенная энергия электрона, приближенно характеризуемая потенциалом ионизации с данной орбитали (теорема Купменса). Энергия электрона на МО слагается из его кинетической энергии, потенциальной энергии притяжения электрона ко всем ядрам и отталкивания от всех остальных электронов. 4. Совокупность МО молекул, занятых электронами, будем называть ее электронной конфигурацией. Электронная конфигурация молекулы строится на основе принципа наименьшей энергии (электрон занимает в молекуле свободную орбиталь с наименьшей энергией) и принципа Паули (на одной МО не может находиться более двух электронов, при этом спины электронов должны быть антипараллельны). При размещении электронов на вырожденных МО соблюдается правило Гунда. 5. ВФ основного состояния молекулы в нулевом приближении задается как произведение одноэлектронных ВФ занятых молекулярных орбиталей: Ψмол =Ψ1(1)Ψ2(2)Ψ3(3)…Ψn(n). 6. Полная ВФ с учетом спина строится с помощью определителя Слейтера. 7. Полная энергия молекулы слагается из электронной энергии и энергии отталкивания ядер: Eполн = E + Eотт. ядер. 8. Если хотя бы 1 электрон переходит на более высокую МО, молекула переходит в возбужденное состояние. 9. Для молекулы существует строго определенный набор дискретных состояний, которым отвечает строгое значение энергии. Переходы межу этими состояниями с поглощением или испусканием энергии рождает электронный спектр молекулы.
В данной лабораторной работе используется способ приближенного описания волновой функции электрона в молекуле методом МО как линейной комбинации атомных орбиталей (МО ЛКАО)
Рассмотрим электрон е в поле двух ядер А и В. В положении а на него действует поле, создаваемое обоими ядрами, но основной вклад вносит ядро А, поэтому состояние электрона близко к тому, которое существует в атоме А.Его можно приближенно описать атомной орбиталью χ₁ атома А; аналогично в положении б состояние электрона приближенно описывается АО χ2 атома. Каждая из этих атомных функций может рассматриваться как весьма приближенное частное решение УШ для электрона в молекуле АВ. Более общим решением согласно свойству собственных функций УШ должна быть МО, являющейся линейной комбинацией частных решений:
Ψ = с₁χ1 + с2χ2
где с₁ и с2 находятся вариационным методом; {χ1,χ2} – базис молекулярной орибитали Ψ.

При построении МО по методу ЛКАО должны соблюдаться следующие условия наиболее эффективного перекрывания АО: 1. Комбинируемые АО должны быть близкими по энергии. 2. Граничные поверхности АО, образующих МО, должны эффективно перекрываться
S = v ∫ χ1 χ2dv. 3. АО, образующие МО, должны обладать одинаковыми свойствами симметрии относительно межъядерной оси образующейся молекулы.
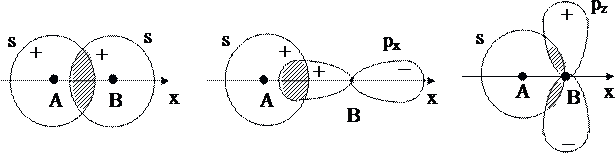
Влияние симметрии атомных орбиталей на возможность образования молекулярных орбиталей: МО образуются (а, б), не образуются (в)
При перекрывании s и рz-орбиталей направление наиболее вероятного нахождения pz-электрона совпадает с направлением межъядерной оси (ось z), перекрывание наиболее эффективно. Поэтому s и рz -АО комбинируют. Напротив s и px AO не могут комбинировать, ось px -АО перпендикулярна к межъядерной оси.
При наложении s- и рx-орбиталей возникают две области перекрывания, равные по величине и противоположные по знаку, и суммарное перекрывание оказывается равным нулю (рис. 7.4. в). Разрешенные комбинации АО в методе МО ЛКАО (ось z - межъядерная ось двухатомной молекулы) приведены ниже:
|
χA |
s |
pz |
py |
dyz |
|
|
|
χB |
s,
pz,
|
s,
pz,
|
py, dyz |
py, dyz |
s,
pz,
|
|
Ковалентная связь.
На
рис. представлено образование связывающей
и разрыхляющей МО молекулы

 из АО, а также диаграмма плотности
вероятности (плотности электронного
облака). В нижней части рис. а и б приведены
условные контурные диаграммы электронной
плотности, напоминающие топографические
карты. В пространстве между ядрами
значения Ψs и
из АО, а также диаграмма плотности
вероятности (плотности электронного
облака). В нижней части рис. а и б приведены
условные контурные диаграммы электронной
плотности, напоминающие топографические
карты. В пространстве между ядрами
значения Ψs и
 выше, чем были бы в изолированной атомной
орбитали. Соответственно выше здесь и
плотность электронного облака.
выше, чем были бы в изолированной атомной
орбитали. Соответственно выше здесь и
плотность электронного облака.

Это означает, что для Ψs молекулярной орбитали вероятность пребывания электрона в межъядерной области велика. Отрицательный заряд между ядрами притягивает к себе положительные заряды обоих ядер и в то же время экранирует их друг от друга, уменьшая их взаимное отталкивание. В результате наблюдается значительное понижение энергии электрона в поле двух ядер молекулы по сравнению с энергией электрона в атоме. Общее понижение энергии результат преобладающего понижения потенциальной энергии электрона.
Поэтому система из двух ядер и электрона оказывается более устойчивой, чем система разъединенных ядер, иными словами, вследствие понижения потенциальной и, тем самым, полной энергии электрона возникает химическая связь. Характерной ее особенностью является коллективизирование электрона всеми (в данном случае двумя) ядрами молекулы.
Такая связь называется ковалентной. В основе химической (ковалентной) связи лежат квантовомеханические свойства электронов. Если бы во взаимодействии электрона с ядрами отсутствовал квантовомеханический эффект обмена состояниями электрона и взаимодействие сводилось бы только к классическому кулоновскому взаимодействию, то обменный интеграл β был бы равен 0, откуда следовало бы De ≈ 0 и тем самым было бы невозможным образование из атомов устойчивой молекулы.
Орбиталь Ψs называют связывающей, так как энергия электрона на ней ниже, чем на атомной, что ведет к связыванию, а по свойствам симметрии σ - орбиталью (симметрия та же, цилиндрическая, что у самой молекулы).
Связь
в молекуле
 обусловлена коллективизированием
одного единственного электрона. Таким
образом, укоренившееся в химии
представление Льюиса о химической
связи, как образованной общей парой
электронов, не подтверждается опытом.
Роль играет не число общих электронов,
а в таком распределении их между ядрами,
чтобы переход от атомной системы к
молекулярной сопровождался понижением
полной энергии системы.
обусловлена коллективизированием
одного единственного электрона. Таким
образом, укоренившееся в химии
представление Льюиса о химической
связи, как образованной общей парой
электронов, не подтверждается опытом.
Роль играет не число общих электронов,
а в таком распределении их между ядрами,
чтобы переход от атомной системы к
молекулярной сопровождался понижением
полной энергии системы.
В центре межъядерной оси и в плоскости, проходящей через нее перпендикулярно оси rA = rB,откуда χ1 =χ2 и ΨA = 0. Здесь функция меняет знак (узловая точка, узловая плоскость).
Электронная плотность |Ψ|2 в узловой плоскости равна нулю. Это означает, что на МО типа ΨA электронная плотность в межъядерном пространстве понижена, в результате чего отталкивание ядер преобладает над притяжением к ним электрона и химическая связь не образуется. Поэтому молекулярная орбиталь ΨA называется антисвязывающей или разрыхляющей МО. Она также обладает осевой симметрией и относится к σ-типу.
МО гомонуклеарных молекул.
В
основу построения электронных конфигураций
многоэлектронных молекул с одинаковыми
ядрами положена система орбиталей
одноэлектронной молекулы
 .
Используя для построения двух МО
.
Используя для построения двух МО
 базис из двух ls-AO, мы получили Ψs и
ΨA-орбитали. Для получения большего
числа орбиталей, необходимых для
размещения многих электронов гомонуклеарных
молекул, необходимо использовать большее
число АО. Так, используя, по пять АО (1s,
2s, 2рх, 2py, 2pz) для каждого из двух атомов
Н, получается система из десяти МО
молекулы
базис из двух ls-AO, мы получили Ψs и
ΨA-орбитали. Для получения большего
числа орбиталей, необходимых для
размещения многих электронов гомонуклеарных
молекул, необходимо использовать большее
число АО. Так, используя, по пять АО (1s,
2s, 2рх, 2py, 2pz) для каждого из двух атомов
Н, получается система из десяти МО
молекулы
 .
Молекулярные орбитали систематизируются
по энергии, связывающим свойствам и
симметрии.
.
Молекулярные орбитали систематизируются
по энергии, связывающим свойствам и
симметрии.
Связывающие свойства.
На связывающей орбитали энергия электрона ниже, а на разрыхляющей выше, чем была в атоме на соответствующей АО.
Переход электрона с АО на связывающую МО укрепляет связь в молекуле, а переход на антисвязывающую МО ослабляет, "разрыхляет" связь. В гетеронуклеарных молекулах образуются и несвязывающие МО. Энергия электронов на несвязывающей МО практически не отличается от его энергии на соответствующей АО (Ei ≈α). Из закона сохранения энергии следует, что отрыв электрона с любой орбитали, в том числе c разрыхляющей, требует затраты энергии, а переход свободного электрона на внешнюю незаполненную орбиталь, в том числе и на разрыхляющую, должен сопровождаться выделением энергии (СЭ).
Поэтому электрон на разрыхляющей орбитали разрыхляет связь сильнее, чем укрепляет ее электрон на связывающей орбитали.
Симметрия. В двухатомной молекуле между ядрами возникает сильное электрическое поле, направленное вдоль оси молекулы. Это направление - (ось z) становится особым для молекулярного электрона и важнейшим из квантовых чисел становится магнитное квантовое число mℓ = 0, ±1, ±2, …,±ℓ, определяющее проекцию вектора орбитального момента на ось молекулы.
Взаимодействие
электрона с осевым электрическим полем
ядер зависит только от абсолютной
величины mℓ. Поэтому удобно ввести новое
квантовое число λ= .
Состояния (МО) с разными λ сильно
различаются по энергиям, представляя
собой, по сути, отдельные энергетические
уровни. В соответствии с квантовым
числом λ молекулярные орбитали двухатомных
и линейных молекул обозначаются строчными
греческими буквами:
.
Состояния (МО) с разными λ сильно
различаются по энергиям, представляя
собой, по сути, отдельные энергетические
уровни. В соответствии с квантовым
числом λ молекулярные орбитали двухатомных
и линейных молекул обозначаются строчными
греческими буквами:
|
Квантовое число λ |
0 |
1 |
2 |
3 |
|
Символ МО |
σ |
π |
δ |
γ |
Все орбитали, кроме σ, дважды вырождены, т.е. данному λ отвечают две орбитали равной энергии, отличающиеся знаком при mℓ.
МО гомонуклеарных молекул также классифицируются относительно операции отражения в центре молекулы (в центре инверсии) на четные (g), не изменяющие знак при инверсии, и нечетные (u), изменяющие знак. Символ МО состоит из строчной греческой буквы (σ, π, δ) и т.д. У разрыхляющих орбиталей справа вверху символа ставится звездочка, знак четности (нечетности) ставится внизу справа, затем указывается символ АО, из которых образована МО.
Рассмотрим
первые десять МО молекулы
 .
Две МО основного и первого возбужденного
состояния построены из ls-AO, для которых
mℓ = 0.
.
Две МО основного и первого возбужденного
состояния построены из ls-AO, для которых
mℓ = 0.
Поэтому
обе они типа σ, связывающая
 и разрыхляющая
и разрыхляющая
 .
Следующая пара МО
.
Следующая пара МО

 и
и
 образована из 2s-АО.
образована из 2s-АО.
Эти МО аналогичны рассмотренным выше орбиталям первого квантового слоя и отличаются только более высокой энергией.
Атомные
орбитали pz, с одной стороны, и рх и ру –
с другой, имеют разную симметрию
относительно межъядерной оси и
соответственно образуют МО разных
типов. Молекулярные орбитали
 и
и
 (рис. 7.2) принадлежат к σ-типу (для рz
электрона λ = 0). Они обозначаются символом
(рис. 7.2) принадлежат к σ-типу (для рz
электрона λ = 0). Они обозначаются символом
 ,
или сокращённо σz: связывающая
,
или сокращённо σz: связывающая
 и
разрыхляющая
и
разрыхляющая
 .
.
Как все σ - орбитали, они обладают осевой симметрией. Для 2рх- и 2ру-орбиталей mℓ соответственно равно +1 и -1, λ = 1, вследствие чего образованные ими МО относятся к π – типу.
Энергия.
Система
МО молекулы
 используется для построения электронных
конфигураций двухатомных гомонуклеарных
молекул.
используется для построения электронных
конфигураций двухатомных гомонуклеарных
молекул.
Заполнение молекулярных орбиталей происходит в соответствии с принципом наименьшей энергии и принципом Паули, по два электрона размещаются на σ- и по четыре на дважды вырожденных π- и δ-орбиталях. Порядок, в котором возрастают энергии МО, устанавливается при исследовании молекулярных спектров и другими экспериментальными методами, а также при помощи квантовомеханических расчетов. Для гомонуклеарных молекул, более тяжелых, чем N2, установлена последовательность заполнения орбиталей по энергии:
 <
<
 <
<
 <
<
 <
<
 <
<
 =
=
 <
<
 =
=
 <
<
 .
.
Совокупность молекулярных орбиталей, занятых электронами, определяет электронную конфигурацию молекулы. Молекулы, в которых каждая из орбиталей заполнена двумя электронами, называются системами с закрытыми оболочками. К ним относится подавляющее большинство молекул.
Электронные конфигурации и свойства гомонуклеарных молекул
Молекула H2
Электронная конфигурация молекулы Н2 в основном состоянии H2[(σgls)2]. В основном состоянии молекулы два ее электрона согласно принципу наименьшей энергии занимают наиболее низкую орбиталь σ1s и согласно запрету Паули имеют противоположные спины. Суммарный спин равен нулю, молекула является диамагнитной, мультиплетность 2s+1=1 - (синглет). Оба электрона занимают четную (g) орбиталь. По правилу произведения (g∙g = g) состояние системы четное. Схема заселенности МО молекулы Н2 и других молекул элементов первого периода приведена на рис.

В
многоэлектронных молекулах согласно
орбитальному приближению полная
электронная энергия = (сумма орбитальных
энергий) - (усредненная энергия отталкивания
электронов) + (энергия отталкивания
ядер). Можно принять (Хюккель, 1931), что
последние два члена компенсируют друг
друга. В таком приближении полная
электронная энергия равна сумме
орбитальных энергий:

Соответственно энергия диссоциации равна
De(H2) = 2Е(Е) - E(Н2) = 2α-2(α+β) =-2β
Связь
в Н2 прочнее, чем в ионе
 ,
вследствие того, что на
,
вследствие того, что на
 -связывающей
орбитали находятся два электрона вместо
одного.
-связывающей
орбитали находятся два электрона вместо
одного.
 =4,478
эВ и
=4,478
эВ и
 = 2,651 эВ, rе(Н2) = 0.7414Å и
= 2,651 эВ, rе(Н2) = 0.7414Å и
 =1,06
Å.
=1,06
Å.
Волновая функция. Координатная волновая функция основного состояния молекулы Н2 в нулевом приближении может быть представлена произведением одноэлектронных волновых функций
 ,
,
где χ1 и χ2 — атомные орбитали при ядрах А и В; (1) и (2) — координаты первого и второго электронов.
В соответствии с принципом Паули полная волновая функция с учетом спина должна быть антисимметричной по отношению к перестановке координат электронов. А так как координатная функция (7.2) симметрична, то антисимметричной будет спиновая функция. А это значит, что на σ1s-MO два электрона должны иметь антипараллельные спины.
Суть работы: В данной лабораторной работе производился расчет молекулярных характеристик молекулы H2 полуэмпирическим методом MNDO. При помощи программы HyperChem была собрана модель молекулы и скорректирована её геометрия. Приведен квантово-химический расчет с оптимизацией геометрии. Полученные в результате расчета значения: Межатомное расстояние: 0,663316 А.
(Выбрать в меню «Select» и щелкнуть по связи)
 Разность
энергий: 20,533 эВ = 3,29*10-18 Дж/моль = 2,204*10-8
а.е.м.
Полная
энергия: -652,6280321 ккал/моль.
Точечная
группа симметрии молекулы: D∞h.
Заряды
на атомах: -0,0. Были построены
энергетическая диаграмма МО, контурные
диаграммы связывающей и разрыхляющей
МО и контурные диаграммы распределения
электронной плотности орбиталей, схема
смещения ядер.
Разность
энергий: 20,533 эВ = 3,29*10-18 Дж/моль = 2,204*10-8
а.е.м.
Полная
энергия: -652,6280321 ккал/моль.
Точечная
группа симметрии молекулы: D∞h.
Заряды
на атомах: -0,0. Были построены
энергетическая диаграмма МО, контурные
диаграммы связывающей и разрыхляющей
МО и контурные диаграммы распределения
электронной плотности орбиталей, схема
смещения ядер.
Энергетическая диаграмма молекулярных орбиталей:
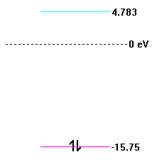
- вид симметрии -1Ϭu
-Вид симметрии - 1Ϭg
-
Расчет колебательного спектра моекулы водорода
(«Compute» -> «Vibrational Spectrum»)

Справочные значения частоты колебаний H2:
n(H2) = 4405 см-1
HyperChem log start -- Sun Nov 18 21:44:13 2018.
Geometry optimization, SemiEmpirical, molecule = 1.hin.
MNDO
PolakRibiere optimizer
Convergence limit = 0.0100000 Iteration limit = 50
Accelerate convergence = YES
Optimization algorithm = Polak-Ribiere
Criterion of RMS gradient = 0.1000 kcal/(A mol) Maximum cycles = 30
RHF Calculation:
Singlet state calculation
Number of electrons = 2
Number of Double Occupied Levels = 1
Charge on the System = 0
Total Orbitals = 2
Starting MNDO calculation with 2 orbitals
E=0.0000 kcal/mol Grad=0.000 Conv=NO(0 cycles 0 points) [Iter=1 Diff=324.78530]
E=0.0000 kcal/mol Grad=0.000 Conv=NO(0 cycles 0 points) [Iter=2 Diff=0.00000]
Eigenvalues (eV) and Eigenvectors
Mol. Orbital 1 2
Eigenvalue -15.74701 4.78246
S H 1 0.70711 -0.70711
S H 2 0.70711 0.70711
E=-103.4995 kcal/mol Grad=0.034 Conv=YES(1 cycles 3 points) [Iter=1 Diff=0.00000]
Eigenvalues (eV) and Eigenvectors
Mol. Orbital 1 2
Symmetry: 1 SIG 1 SIU
Eigenvalue -15.74701 4.78246
S H 1 0.70711 -0.70711
S H 2 0.70711 0.70711
ENERGIES AND GRADIENT
Total Energy = -652.6280300 (kcal/mol)
Total Energy = -1.040028838 (a.u.)
Binding Energy = -103.4994980 (kcal/mol)
Isolated Atomic Energy = -549.1285320 (kcal/mol)
Electronic Energy = -1001.9175975 (kcal/mol)
Core-Core Interaction = 349.2895675 (kcal/mol)
Heat of Formation = 0.7045020 (kcal/mol)
Gradient = 0.0338305 (kcal/mol/Ang)
MOLECULAR POINT GROUP
D*H
EIGENVALUES(eV)
Symmetry: 1 SIG 1 SIU
Eigenvalue: -15.747010 4.782458
ATOMIC ORBITAL ELECTRON POPULATIONS
AO: 1 S H 2 S H
1.000000 1.000000
NET CHARGES AND COORDINATES
Atom Z Charge Coordinates(Angstrom) Mass
x y z
1 1 -0.000000 -1.30000 0.01116 0.00000 1.00800
2 1 0.000000 -1.30000 0.67455 0.00000 1.00800
ATOMIC GRADIENTS
Atom Z Gradients(kcal/mol/Angstrom)
x y z
1 1 0.00000 -0.05860 0.00000
2 1 0.00000 0.05860 0.00000
Dipole (Debyes) x y z Total
Point-Chg. 0.000 0.000 0.000 0.000
sp Hybrid 0.000 0.000 0.000 0.000
pd Hybrid 0.000 0.000 0.000 0.000
Sum 0.000 0.000 0.000 0.000
HyperChem log stop -- Sun Nov 18 21:45:00 2018.












