
- •Лекция 8. Растворы и дисперсные системы. Растворы неэлектролитов.
- •Закон распределения
- •Закон Генри. (1803 г.)
- •Разбавленные растворы неэлектролитов. Осмотическое давление
- •Давление пара над раствором.
- •Замерзание и кипение раствора.
- •Изменение температур фазовых переходов
- •Лекция 9. Растворы и дисперсные системы. Растворы электролитов.
- •Теория электролитической диссоциации
- •Растворы слабых кислот и оснований
- •Вычисление степени и константы диссоциации слабого электролита на основании результатов измерения электрической проводимости.
- •Лекция 10 Вода. Водородная связь. Водородный показатель, его расчёт в растворах сильных и слабых электролитов. Водородный показатель
- •Расчёт рН в растворах сильных кислот и оснований
- •Равновесия в растворах сильных и слабых электролитов.
- •Теории кислот и оснований Протолитическая теория Брёнстеда и Лоури.
- •Теория Льюиса.
- •Теория Пирсона.
- •Буферные растворы.
- •Лекция 12. Равновесия в насыщенных растворах Расчёт растворимости веществ. Произведение растворимости
- •Электродные потенциалы и электродвижущие силы.
- •Электролиз
Давление пара над раствором.
Важной характеристикой раствора является давление его насыщенного пара, которое при данной температуре является постоянной величиной. В отличие от поверхности растворителя (1, см. рис.), поверхность раствора (2) частично занята молекулами нелетучего растворённого вещества.
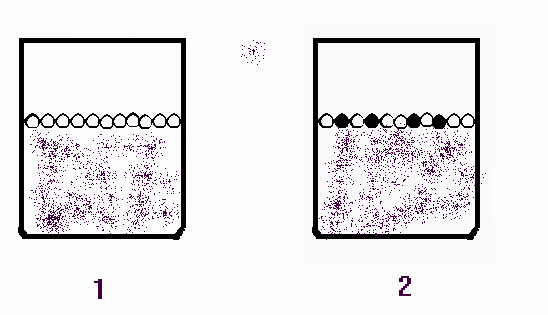
Поэтому, число молекул растворителя испаряющихся в единицу времени с единицы поверхности раствора (2) меньше, чем с единицы поверхности чистого растворителя (1). Следовательно, при одной и той же температуре, давление насыщенного пара над раствором всегда будет ниже, чем над чистым растворителем.
В 1887 г. французский учёный Франсуа Мари Рауль (1830-1901) сформулировал следующий закон:
Закон Рауля
В разбавленных растворах неэлектролитов при постоянной температуре величина относительного понижения давления пара растворителя равна мольной доле растворённого нелетучего вещества.
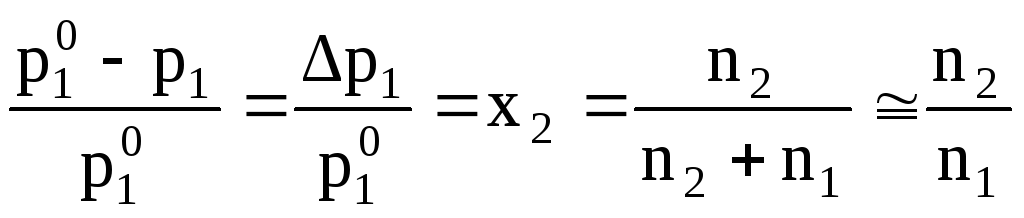 при
при
![]() n2
<<n1
n2
<<n1
где р0 – давление пара над чистым растворителем, р – давление пара над раствором, х2 – мольная доля растворённого вещества, n1 и n2 – числа молей растворителя и растворённого вещества, Δр = р0 – р - понижение упругости пара над раствором,
![]() - относительное понижение упругости
пара раствора (депрессия)
- относительное понижение упругости
пара раствора (депрессия)
Изменением понижения давления пара над раствором можно пользоваться для определения молярной массы растворённого вещества. Пусть nA – число молей растворителя, nВ – число молей растворённого вещества, nВ = mB/MB, где mB - масса растворённого вещества, MB - его молярная масса, nА = mА/MА , где mА - масса растворителя, MА - его молярная масса. подставляя nА и nВ в уравнение закона Рауля, получаем:
![]()
Последнее приближённое равенство записано с учётом того, что раствор разбавленный и nB<<nA. Итак,
![]()
или
ΔрМВmA = р0 МAmB,
отсюда
![]()
Замерзание и кипение раствора.
Все чистые жидкости характеризуются строго определёнными температурами или точками замерзания и кипения раствора. Любая жидкость закипает тогда, когда давление её пара становится равным атмосферному. Так как согласно закону Рауля, давление пара над раствором нелетучего вещества ниже давления пара над чистым растворителем, то для того, чтобы раствор закипел, надо нагреть его до более высокой температуры, чем растворитель.
Замерзает раствор тогда, когда давление пара над ним становится равным давлению пара над чистым твёрдым растворителем.
Повышение температуры замерзания и повышение температуры кипения находят своё отражение на диаграмме состояния которая выражает зависимость давления насыщенного пара над раствором и чистым растворителем от температуры.
Точка А диаграммы отвечает давлению пара воды и льда при 00С (р=0,613кПа), кривая АВ – изменению давления насыщенного пара в интервале 0 – 1000С, кривая А1В1 – изменению давления пара раствора при повышении температуры.
Диаграмма наглядно показывает, что давление пара раствора при температуре 1000 С (точка Д) продолжает оставаться меньше атмосферного , поэтому, раствор не закипает. Чтобы довести давление пара раствора до 101325Па его нужно нагреть выше 1000С. Для выпадения кристаллов льда из раствора необходимо, чтобы раствор и выкристаллизовавшийся лёд имели одинаковую упругость паров. Это достигается в точке А1, то есть при температуре ниже температуры замерзания чистой воды.
Таким образом, раствор кипит при более высокой температуре, а замерзает при более низкой, чем чистый растворитель. Разность между температурами кристаллизации чистого растворителя и раствора называется понижением температуры замерзания Δtз.
Раулем было установлено, что понижение температуры замерзания, и повышение температуры кипения раствора прямо пропорционально моляльной концентрации частиц растворённого вещества.
Δtкип. = Еcm, Δtзам. = Кcm,
где cm – моляльная концентрация раствора, Е- эбулиоскопическая постоянная, которая численно равна повышению температуры кипения одномоляльного раствора по сравнению с чистым растворителем, К – криоскопическая постоянная, численно равная понижению температуры замерзания одномоляльного раствора по сравнению с чистым растворителем.
Криоскопическая и эбулиоскопическая постоянные зависят только от природы растворителя. Их определяют экспериментально по величине Δtкип.
и Δtзам. для растворов с заранее известной моляльной концентрацией. Значения этих постоянных для ряда растворителей приведены ниже.
|
Ратворитель |
Е, град/моль |
К,град/моль |
|
вода |
0, 52 |
1,86 |
|
бензол |
2,57 |
5,12 |
|
уксусная кислота |
3,1 |
3,9 |
Законы Рауля для понижения температуры замерзания и повышения температуры кипения.
Понижение температуры замерзания пропорционально количеству вещества, растворённого в данном количестве растворителя.
Эквимолекулярные количества различных веществ, будучи растворёнными в одном и том же количестве растворителя, понижают точку замерзания на одно и то же число градусов.
Аналогичные законы сформулированы и в отношении температуры кипения растворов. Так при растворении в 1000 г Н2О 342 г сахара (С12Н22О11), 92 г глицерина (С3Н8О3) и 46 г спирта (С2Н5ОН), температура замерзания каждого из растворов понизится на 1,86 градуса.
Закон Рауля используется для определения молярной массы неэлектролитов. Наиболее часто применяется криоскопический метод, основанный на опытном определении понижения температуры замерзания раствора.
, Δtзам.
= Кcm,
,
![]() ,
,
где mА - масса растворителя, mВ - масса растворённого вещества, MВ - молярная масса растворённого вещества.
![]() ,
отсюда
,
отсюда
![]()
