
- •Процессы обратимые и необратимые. Равновесные и неравновесные
- •Энтальпия. Физические свойства
- •Теплоёмкость рабочего тела
- •Изохорный процесс газа
- •Изобарный процесс газа.
- •Изотермический процесс газа.
- •Адиабатный процесс газа.
- •Цикл Карно и его свойства.
- •Цикл газотурбинной установки с регенерацией
-
*Первый закон динамики.
-
Параметры рабочего тела p,V,T,U,i,S.
-
Внутренняя энергия рабочего тела
-
Внутренняя энергия рабочего тела. Физический смысл и размерность.
-
Процессы обратимые и необратимые. Равновесные и неравновесные.
-
Энтальпия. Физические свойства.
-
Теплоёмкость рабочего тела
-
Изохорный процесс газа
-
Изобарный процесс газа.
-
Изотермический процесс газа.
-
Адиабатный процесс газа.
-
Второй закон термодинамики
-
Формулировки второго закона термодинамики.
-
Цикл Карно и его свойства.
-
Таблицы водяного пара.
-
i – S диаграмма водяного пара.
-
Адиабатический процесс водяного пара. Изображение процесса в p – V , i – S и T –S диаграммах.
-
Многоступенчатое сжатие в компрессоре.
-
Цикл ДВС со сгоранием при V=const
-
Цикл ДВС со сгоранием при p=const
-
Цикл ДВС с подводом тепла при V и p =const
-
Цикл ДВС со смешанным подводом тепла.
-
Цикл газотурбинной установки
-
Цикл паросиловой установки. Цикл Ренкина.
-
Цикл воздушной компрессорной холодильной установки.
-
Цикл паровой компрессорной холодильной установки.
-
Процесс парообразования в p – V диаграмме.
-
Процесс p =const водяного пара. Изображение процесса в p – V , i – S и T –S диаграммах.
-
Повторный перегрев пара.
-
Процесс T=const водяного пара. Изображение процесса в p – V , i – S и T –S диаграммах.
-
Таблицы средних теплоёмкостей. Определение теплоты при помощи таблиц.
-
Удельные расходы пара и тепла в паросиловых установках
-
Цикл газотурбинной установки с регенерацией.
-
Уравнение состояния рабочего тела.
-
Формула Майера.
-
Понятие «Холодильный коэффициент».
ПЕРВЫЙ ЗАКОН ДИНАМИКИ.
Первый
закон термодинамики является частным
случаем общего закона сохранения и
превращение энергии применительно к
процессам взаимного превращения теплоты
и работы. Закон утверждает, что сумма
всех видов энергии изолированной
системы при любых происходящих в системе
процессах остается постоянной:
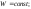

При осуществлении термодинамического процесса подводимая к телу теплота Q идет на изменение его внутренней энергии и совершение механической работы:

Для 1 кг рабочего тела
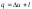 .
.
ПАРАМЕТРЫ РАБОЧЕГО ТЕЛА P,V,T,U,I,S.
Величины, характеризующие тело в данном состоянии, называют параметрами состояния. Чаще всего состояние тела определяется следующими параметрами: удельным объемом, давлением, энтальпией и температурой.
Удельный
объем
(v)
тела представляет собой объем единицы
его массы. В технической термодинамике
за единицу массы принимают килограмм
(кг), за единицу объема— кубический
метр (м3).
Если
V
— объем в м3,
занимаемый телом массой М
в
кг, то удельный объем
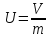
Плотность
– величина обратная удельному объему
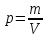
Давление р в Международной системе единиц (СИ) измеряют в паскалях. Паскаль (Па) — давление, вызываемое силой 1 ньютон (Н), равномерно распределенной по нормальной к ней поверхности площадью 1 м2. Таким образом, в единицах СИ паскаль измеряют в ньютонах на квадратный метр (Н/м2).
Температура характеризует степень нагретого тела. Ее измеряют или по термодинамической температурной шкале, или по международной практической температурной шкале. Единицей термодинамической температуры является кельвин (К), представляющий собой 1/273,16 часть термодинамической температуры тройной точки воды.
Энтальпия
Энтальпией термодинамического тела называют сумму внутренней энергии u и произведения pv.
где dlt - есть дифференциал технической работы (dlt = - vdp).
Полученное уравнение является также второй формулировкой первого закона термодинамики, используя понятия энтальпии и технической работы.
Величина i может также рассматриваться как параметр состояния термодинамического тела наряду с ранее введенными p, v, T, и. Физический смысл величины i может пояснен на основе уравнения dq = di - vdp, которое для процесса p = const запишется как:
dqp = di . (86)
Откуда следует, что di есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе постоянного давления.
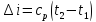
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Энтропия является функцией состояния, поэтому её изменение в термодинамическом процессе определяется только начальными и конечными значениями параметров состояния. Изменение энтропии в основных термодинамических процессах:
в
изохорном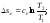
в
изобарном 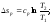
в
изотермическом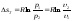
в
адиабатном
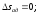
в политропном
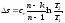
ВНУТРЕННЯЯ ЭНЕРГИЯ РАБОЧЕГО ТЕЛА, ФИЗИЧЕСКИЙ СМЫСЛ И РАЗМЕРНОСТЬ.
Внутренняя энергия – это вся энергия заключенная в теле или системе тел. Эту энергию можно представить в виде суммы отдельных видов энергий: кинетической энергии молекул, включающей энергию поступательного и вращательного движения молекул, а также колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии или энергии положения молекул в каком либо внешнем поле сил; энергии электромагнитного излучения.
Полную внутреннюю энергию тела принято обозначать U (Дж), а удельную внутреннюю энергию u (Дж/кг).
Внутренняя энергия равна:
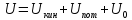
Где
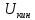 – внутренняя кинетическая энергия
молекул,
– внутренняя кинетическая энергия
молекул,
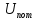 внутренняя потенциальная энергия
молекул,
внутренняя потенциальная энергия
молекул,
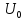 – постоянная интегрирования.
– постоянная интегрирования.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии.
Изменение
внутренней энергии идеального газа
для любого процесса при бесконечно
малом изменении состояния (для 1 кг)
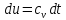
В
теплотехнических расчётах обычно
требуется знать изменение внутренней
энергии
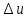 , а не её абсолютное значение; поэтому
начало отсчёта (0 К или 00
С) для конечного результата (
, а не её абсолютное значение; поэтому
начало отсчёта (0 К или 00
С) для конечного результата (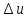 )
не имеет значения.
)
не имеет значения.
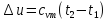
где
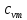 -
средняя
массовая теплоёмкость при постоянном
объёме в пределах
-
средняя
массовая теплоёмкость при постоянном
объёме в пределах
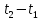
Таким образом, изменение внутренней энергии идеального газа для любого процесса равно произведению средней теплоёмкости при постоянном объёме на разность температур газа.
Процессы обратимые и необратимые. Равновесные и неравновесные
Термодинамический процесс – это последовательное изменение состояния тела, происходящее в результате энергетического взаимодействия рабочего тела с окружающей средой.
Понятия обратимый и необратимый термодинамический процесс тесно связаны с равновесием системы. Рассмотрим такую термодинамическую систему у которой отсутствует теплообмен с окружающей средой (адиабатная термодинамическая система). Происходящие в такой системе термодинамические процессы называют обратимыми, если система в ходе прямого и обратного процесса вернется в исходное состояние без какого-либо дополнительного теплового воздействия окружающей среды на систему. В случае если система в ходе обратного процесса не может возвратиться в исходное состояние или для этого требуется подвод тепла, то такой процесс называется необратимым.
Процесс при каждом изменении давления и температуры может быть обратимым только в том случае, когда на протяжении всего процесса от точки к точке термодинамической системы давление постоянно и температура в каждой точке равна температуре окружающей среды или их разность бесконечно мала.
обратимые термодинамические процессы являются идеальным или теоретическим случаем. Все реальные процессы являются необратимыми, так как на практике выполнение условия квазистатичности трудно выполнимо. Кроме того, необратимость процессов вызывается наличием внутреннего трения в рабочем теле и поверхностного трения в техническом оборудовании (течение в сопле, трение поверхности поршня о стенку цилиндра и т.д.). Для преодоления трения всегда необходимо затратить некоторое количество механической работы, которая в ходе процесса превращается в тепло.
Энтальпия. Физические свойства
Энтальпией термодинамического тела называют сумму внутренней энергии u и произведения p v.
где dlt - есть дифференциал технической работы (dlt = - vdp).
Полученное
уравнение является также второй
формулировкой первого закона
термодинамики, используя понятия
энтальпии и технической работы.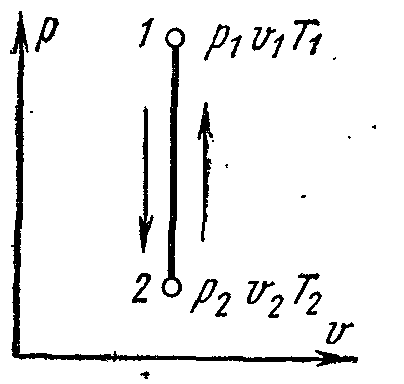
Величина i может также рассматриваться как параметр состояния термодинамического тела наряду с ранее введенными p, v, T, u. Физический смысл величины i может пояснен на основе уравнения (dq = di - vdp), которое для процесса p = const запишется как: dqp = di .
Откуда следует, что di есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе постоянного давления.

Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от промежуточных состояний и характера процесса.
Теплоёмкость рабочего тела
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо - из них. Удобнее, всего иметь величину мольной теплоемкости, тогда массовая теплоемкость:
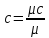
а
объемная теплоемкость: 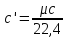
Объемная и массовая теплоемкости связаны между собой зависимостью:
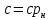
где
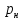 - плотность газа при нормальных
условиях.
- плотность газа при нормальных
условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоёмкость.
Если q- количество теплоты , сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 то
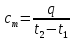
Представляет
собой
среднюю теплоёмкость
в пределах
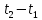 . Предел этого отношения, когда разность
температур стремиться к нулю, называют
истинной
теплоёмкостью.
. Предел этого отношения, когда разность
температур стремиться к нулю, называют
истинной
теплоёмкостью.
