
- •Кинетика физико-химических процессов. Химическое равновесие.
- •Экспериментальная часть
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •1.1. Ход опыта
- •1.2Данные опыта и расчёта.
- •1.3. Вывод
- •2. Зависимость скорости реакции от температуры
- •2.1. Ход опыта
- •2.2 Расчет и анализ экспериментальных данных
- •Ход опыта
- •4.2 Расчет и анализ экспериментальных данных
- •5.1. Ход опыта
- •Электролиты. Реакции в растворах электролитов
- •Экспериментальная часть
- •1.Зависимость степени диссоциации от природы электролита
- •1.1Ход и данные опыта
- •2.3 Ход опыта
- •3.3 Расчёт и анализ данных
- •4.2 Ход опыта
- •4.5 Вывод.
- •5. Гидролиз карбоната натрия
- •5.1 Ход опыта
- •5.2 Расчет и анализ экспериментальных данных.
4.2 Расчет и анализ экспериментальных данных
При изменении концетрации реагирующих веществ будет происходить смещение равновесия и интенсивность окрашивания раствора, обусловленного образованием родонида железа (FE(CNS)3), будет изменяться. Данное изменение вытекает из равновесия:
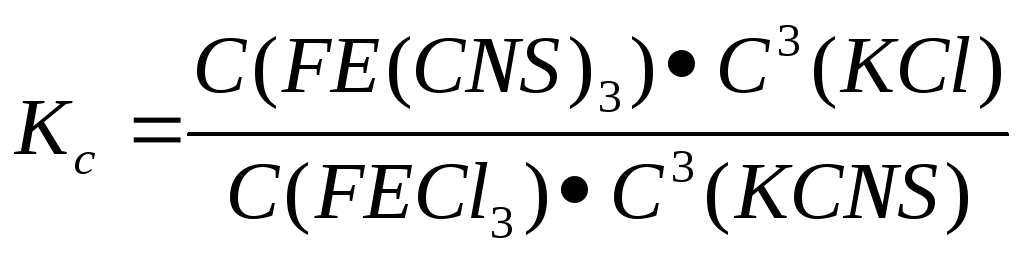
Из формулы видно, что при увеличении знаменателя, увеличивается и числитель(Константа равновесия не зависит от концетрации реагирующих веществ) и наоборот. Направления смещения химического равновесия при изменении условий определяется принципом Ле-Шателье.
4.3 Вывод
Опытом подтверждено, что с увеличением концентрации исходных веществ равновесие смещается в сторону продуктов реакции (при постоянной температуре и давлении).
5. Влияние температуры на состояние равновесия
5.1. Ход опыта
Представим реакцию йода с крахмалом в виде схемы:
йод + крахмал →← йодокрахмал (ΔH < 0)
В пробирку нальем 4-5 мл раствора крахмала и добавим несколько капель раствора I2 до появления синего окрашивания. Разделив содержимое пробирки на две, нагреем одну из них, а потом охладим и понаблюдаем за изменением окраски.
5.2. Расчет и анализ экспериментальных данных
Сравнивая опытную пробирку с контрольной, определим, что при повышении температуры окраска ослабевает, так как равновесие смещается в сторону исходных веществ (реакция эндотермическая). При понижении температуры равновесие смещается в обратную сторону.
5.3 Вывод
В результате опыта было установлено, что при повышении температуры равновесие в экзотермических реакциях смещается к исходным веществам, а эндотермических – к продуктам реакции. Аналогично при понижении температуры, но наоборот.
Электролиты. Реакции в растворах электролитов
Цель работы: изучить влияние различных факторов на степень диссоциации электролитов и характер гидролиза солей.
Экспериментальная часть
1.Зависимость степени диссоциации от природы электролита
1.1Ход и данные опыта
Для выполнения опыта используем прибор показанный на рисунке 1.
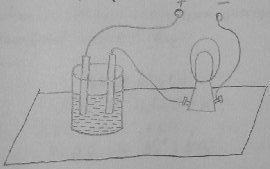
Рисунок 1 – Прибор для исследования электропроводимости растворов.
Поочерёдно пропускали через систему электрический ток, дистиллированной воды, растворов (1М) КОН, СН3, СООН3, сахара, NаNО3, промывая после каждого опыта электролиты и стакан дитилированной водой. Наблюдали за лампочкой.
При пропускании тока через дистиллированную воду и раствор сахара лампочка не загоралась.
При пропускании тока через раствор СН3СООН наблюдалось тусклое свечение лампочки.
При пропускании тока через раствор КОН и NаNО3 лампочка ярко светилась.
1.2Расчёт и анализ данных
По яркости свечения лампочки можно заметить что дистиллированная вода, растворы сахара и СН3СООН относятся к слабым электролитам, а раствор КОН и NаNО3 к сильным.
Уравнения электрической диссоциации исследуемых растворов имеет вид:
Н2О ↔ Н++ОН-
СН3СООН↔ СН3СОО - +Н+
КОН →К++ОН-
NaNO3→ Nа+ +NО3-
1.3 Вывод
Показано, что хорошо растворимая соль NaNO3 и основания щелочного металла KOH являютсясильными эсектролитами, а органическая кислота CH3COOH является слабым электолитам.
-
. Смещение равновесия диссоциации слабого электролита.
2.2 Влияние разбавления раствора на степень электролитической диссоциации.
