- •1. Отличительные особенности поведения полимеров
- •2. Строение полимеров
- •3. Классификация полимеров
- •1. Природные, искусственные и синтетические полимеры
- •2. Органические и неорганические полимеры
- •3. Термопласты и реактопласты
- •4. Пластики, эластомеры, волокна и смолы
- •4. Химия полимеризации
- •4.1. Цепная полимеризация
- •4.1.1. Свободнорадиакальная полимеризация
- •4.1.2. Ионная полимеризация
- •4.1.3. Координационная полимеризация
- •4.2. Ступенчатая полимеризация
- •4.2.1. Поликонденсация
- •4.2.2. Полиприсоединение
- •4.2.3. Полимеризация с раскрытием цикла
- •4.3. Особые типы полимеризационных реакций
- •4.3.1. Электрохимическая полимеризация
- •4.3.2. Полимеризация по механизму метатезиса
- •5. Способы проведения процессов полимеризации
- •6. Средняя молекулярная масса полимеров
- •6.1. Полидисперсность и кривые
- •7. Выделение и очистка полимеров
- •8. Фракционирование полимеров
- •9. Определение молекулярных масс полимеров
- •9.1. Криоскопия
- •9.2. Эбуллиоскопия
- •9.3. Мембранная осмометрия
- •9.4. Парофазная осмометрия
- •9.5. Вискозиметрия
- •9.6. Ультрацентрифугирование
- •9.7. Светорассеяние
- •10. Структура полимерных молекул
- •10.1. Микроструктуры, связанные с химическим строением полимеров
- •10.1.1. Гомоцепные и гетероцепные полимеры.
- •10.1.2. Гомополимеры и сополимеры.
- •10.2. Микроструктуры, связанные с геометрическим
- •10.3. Стереорегулярные полимеры
- •10.4. Геометрическая изомерия
- •11. Стеклообразное состояние полимеров
- •11.1 Агрегатные состояния веществ
- •11.2. Фазовые состояния веществ
- •11.3. Факторы, влияющие на температуру стеклования
- •11.4 Температура стеклования и молекулярная масса полимеров
- •11.5. Влияние пластификаторов на температуру стеклования
- •11.6. Значение температуры стеклования
- •12. Кристаллические полимеры
- •12.1. Полимерные монокристаллы
- •12.2. Влияние степени кристалличности на свойства полимеров
- •13. Химические превращения полимеров
- •14. Деструкция полимеров
- •14.1. Термическая деструкция
- •14.2. Механическая деструкция
- •14.3. Фотодеструкция
- •14.4. Радиационная деструкция
- •14.5. Окислительная деструкция
- •15. Переработка полимеров
14.1. Термическая деструкция
Термическая деструкция протекает при нагревании полимеров и в значительной степени зависит от их химического строения. Термодеструкция может протекать как по цепному, так и по случайному механизму. В первом случае образуется практически чистый мономер, во втором – самые разнообразные продукты.
Независимо от вида деструкции термический распад карбоцепных полимеров, очевидно, идет через разрыв связей С-С в полимерной цепи. Поэтому для термической деструкции важнейшим фактором является прочность углерод-углеродных связей.
Рассмотрим ряд полимеров:
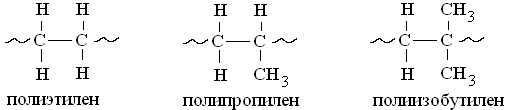
В этом ряду увеличивается число заместителей в элементарном звене полимера и соответственно уменьшается прочность связи С-С в основной цепи. Поэтому полиэтилен наиболее термостоек, а полиизобутилен наиболее подвержен термической деструкции.
Если метильный радикал заменить фенильным, то получим аналогичный ряд, в котором термическая стойкость падает еще быстрее.
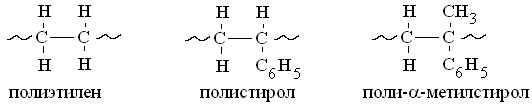
Влияние заместителей на легкость термодеструкции полимеров можно оценить по энергии диссоциации С-С связей в низкомолекулярных веществах аналогичной структуры:
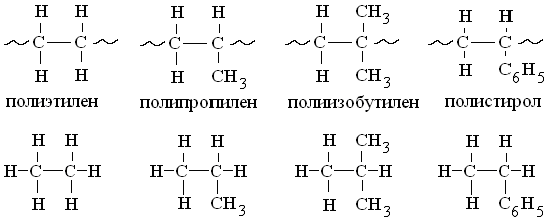
этан пропан изобутан этилбензол
![]() 397
357 336
294
397
357 336
294
Заметим, что не все заместители обязательно уменьшают термостабильность полимеров. Так, например, тефлон (политетрафторэтилен) устойчив вплоть до 4000С. Его высокая термостабильность объясняется большим значением энергии связи С-F, а высокая электроотрицательность фтора защищает связи С-С от внешней атаки.
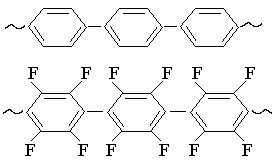
Увеличению термостабильности способствует наличие ароматических колец в основной цепи. Очень высокую термическую стойкость имеет поликарбонат. Этот прозрачный высокопрочный полимер получают конденсацией фосгена с дифенилолпропаном в присутствии щелочного катализатора:
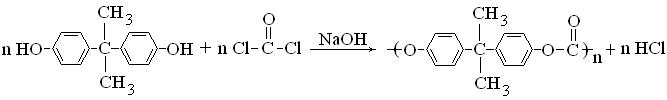
|
|
Соединения типа полифенилена построены только из ароматических колец и еще более термостойки. Они выдерживают нагрев до 5600. Политетрафторфенилен сочетает в себе достоинства тефлона и полифенилена и может длительно работать при температуре выше 5000. |
Напротив, введение атома кислорода в основную цепь значительно снижает термическую прочность полимеров и увеличивает их склонность к термодеструкции. Так полиэтиленоксид обладает термостабильностью намного более низкой, чем полиэтилен.
В некоторых случаях процесс деструкции полимеров заключается не в разрыве основной полимерной цепи, а в отщеплении боковых групп. Типичным примером такого процесса является термодеструкция поливинилхлорида, протекающая при 2000С с выделением НСl.
Механизм этого процесса довольно сложен. Считается, что он инициируется свободными радикалами, образующимися при термическом распаде примесей.
Свободный радикал атакует молекулу полимера, вырывая из нее атом водорода и превращая полимерную цепь в свободный радикал:
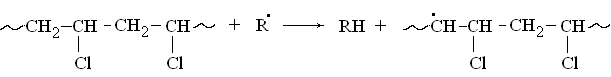
Атом хлора в β-положении по отношению к радикальному центру является подвижным. Он отщепляется в виде радикала, а цепь стабилизируется замыканием двойной связи:
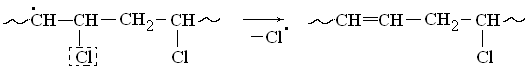
Радикал хлора атакует следующую метиленовую группу, вырывая атом водорода и образуя хлористый водород. Молекула полимера при этом вновь превращается в свободный радикал:

Подвижный атом хлора в β-положении по отношению к радикальному центру уходит в виде радикала, а в цепи замыкается очередная двойная связь:
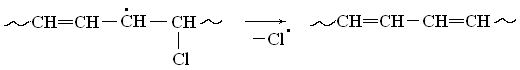
В ходе деструкции бесцветный поливинилхлорид становится желтым, оранжевым, коричневым и, наконец, четным, что связано с наличием свободных радикалов и ростом числа сопряженных двойных связей в его макромолекулах.
Выделяющийся хлористый водород катализирует процесс термической деструкции поливинилхлорида. Поэтому любые соединения, связывающие НСl, являются стабилизаторами ПВХ. Чаще всего для этой цели используют соли натрия, кальция, бария, амины и металлорганические соединения.