
- •Основы молекулярной иммунологии
- •1. Характеристика антигенов
- •2. Характеристика антител (иммуноглобулинов)
- •Геномная организация генов, кодирующих иммуноглобулины
- •3. Антигенраспознающие рецепторы иммуннокомпетентных клеток
- •Антигенраспознающие рецепторы в-лимфоцитов
- •Механизм распознавания антигенов т-лимфоцитами, структурная организация антигенраспознающих рецепторов т-лимфоцитов
- •Генетический контроль молекул антигенраспознающих рецепторов т-лимфоцитов
3. Антигенраспознающие рецепторы иммуннокомпетентных клеток
Для активации иммуннокомпетентных клеток необходимо «узнавание» ими определенных чужеродных субстанций, которое делает возможным взаимодействие иммуннокомпетентных клеток с антигенами и приводит к запуску специфических иммунных реакций (гуморальных и клеточных). «Узнавание» Т- и В-лимфоцитами антигенов осуществляется с помощью определенных антигенраспознающих рецепторов, расположенных на поверхности этих клеток и характеризующихся определенными особенностями строения для разных иммунокомпетентных клеток.
Антигенраспознающие рецепторы в-лимфоцитов
Антигенраспознающие рецепторы В-лимфоцитов представляют собой мономерные формы иммуноглобулина М, встроенные в плазматическую мембрану В-лимфоцита и окруженные специальными вспомогательными трансмембранными белками – Ig и Ig, которые принимают участие в передаче сигнала от IgМ, присоединившего антиген, внутрь клетки. Кроме того, эти белки необходимы для нормального выхода мембранной формы IgМ в плазматическую мембрану: в отсутствии этих белков молекулы мембранного IgМ остаются внутри клетки.
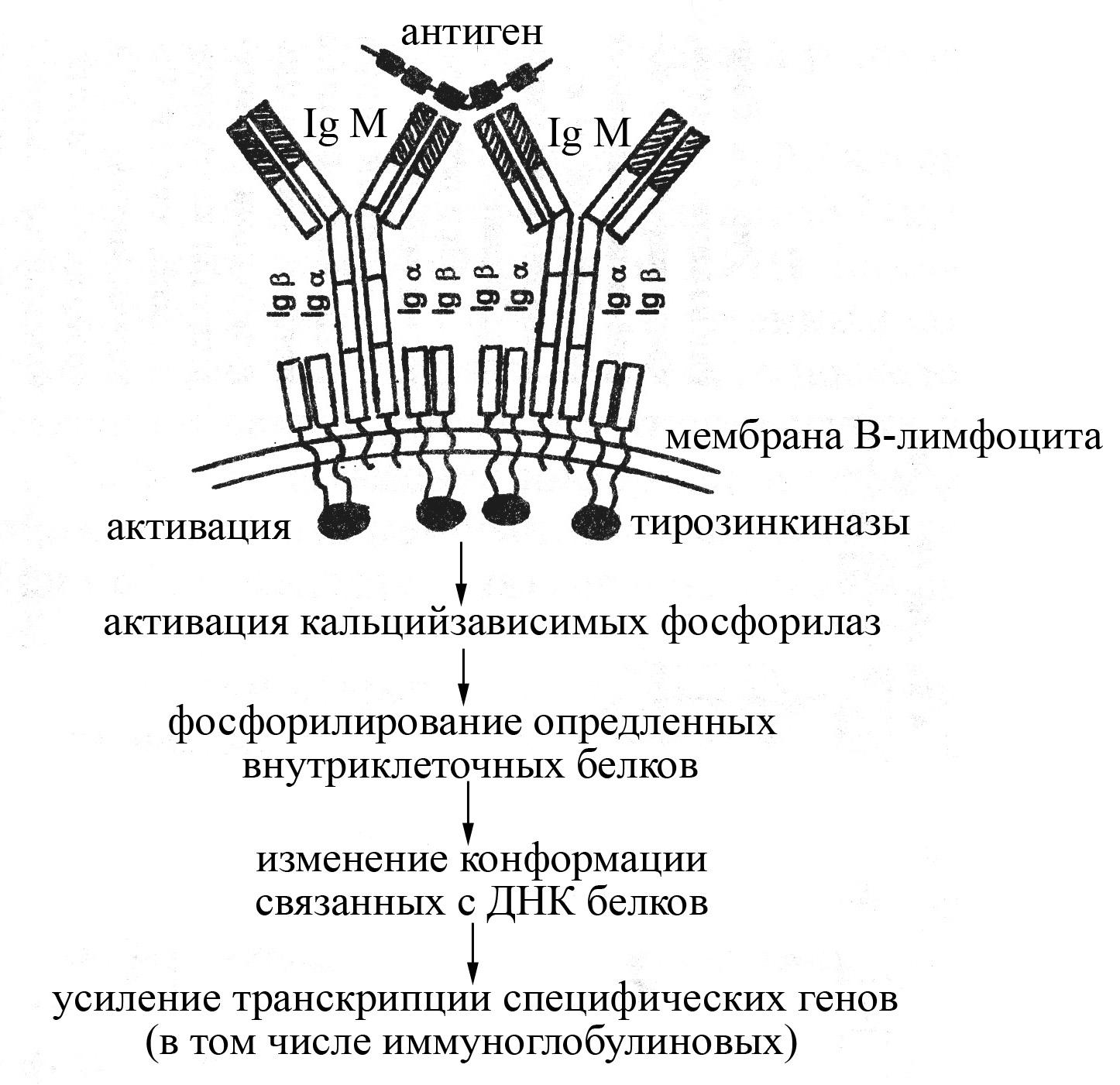
Рис. Схема строения антигенраспознающего рецептора В-лимфоцитов и механизма их активации после взаимодействия с антигеном. Антигенраспознающий рецептор В-лимфоцитов представлен мембранной формой IgМ, окруженного специальными вспомогательными белками – Igα и Igβ, принимающими участие в передачи сигнала от IgМ внутрь клетки
М ембранная
форма иммуноглобулина М отличается от
секреторной не только тем, что является
мономерной, но и некоторыми особенностями
строения самого мономера IgМ:
в его состав входит гидрофобный
трансмембранный участок и короткий
гидрофильный цитоплазматический хвост.
В то же время мономерная молекула
секреторной формы иммуноглобулина М
имеет на С-конце углеводные остатки,
увеличивающие растворимость молекулы,
и цистеиновый остаток, необходимый для
полимеризации мономеров в пентамерную
форму с помощью J-цепи.
Молекула мембранного иммуноглобулина
М кодируется теми же рекомбинантными
иммуноглобулиновыми локусами, что и
секреторного иммуноглобулина (χ- или
-локусом, кодирующим
легкую цепь, и локусом тяжелых цепей).
Некоторые же отличия в строении С-конца
тяжелых цепей секреторного и мембранного
IgМ обусловлены особенностями
считывания информации с генов локуса
тяжелой цепи, лежащих за С-геном.
В частности, за этим геном расположены
короткие гены – Ск и Мк, кодирующие
короткие аминокислотные последовательности
дистальной части тяжелой цепи
соответственно секреторного иммуноглобулина
(ген Ск) и мембранного иммуноглобулина
(ген Мк). При образовании секреторной
формы IgМ, после считывания
информации с С-гена
транскрибируется только ген Ск, кодирующий
концевой участок тяжелой цепи секреторной
формы. При образовании тяжелых цепей
мембранного IgМ
транскрибируется более длинный участок
генома за С-геном,
включающий гены и Ск и Мк. Затем в
результате процессинга участок мРНК,
комплементарный Ск-гену, вырезается
(подвергается делеции), а остальная
часть длинной мРНК, кодирующей тяжелую
цепь -типа, путем
сплайсинга сшивается с коротким
фрагментом мРНК, комплементарным
Мк-гену, в результате чего возникает
зрелая мРНК, кодирующая мембранную
форму IgМ. Таким образом,
трансляция тяжелой цепи мембранного
иммуноглобулина М представляет собой
более сложный процесс, требующий больших
энергозатрат, чем секреторной формы,
поскольку предполагает считывание
информации с более длинного участка
генома и последующий процессинг и
сплайсинг пре-мРНК, в связи с чем
мембранной формы иммуноглобулина в
В-лимфоцитах образуется гораздо меньше,
чем секреторной. Синтез мембранной
формы IgМ начинается на
заключительных этапах дифференцировки
В-лимфоцитов в красном костном мозге.
Зрелые В-лимфоциты экспрессируют
достаточно большое количество мембранного
IgМ на своей поверхности:
2х105 молекул на клетку. Мембранная
форма иммуноглобулина М на поверхности
В-лимфоцитов может непосредственно
взаимодействовать с любыми формами
антигенов: как свободными корпускулярными
(вирусами, бактериями) и молекулярными,
так и связанными с рецепторами
антигенпредставляющих клеток (моноцитов,
макрофагов, дендритных клеток). Но в то
же время молекулы мембранного IgМ
сохраняют свою специфичность: молекулы
каждого клона В-лимфоцитов проявляют
сродство к строго определенным антигенным
детерминантам, оставаясь равнодушными
к другим.
ембранная
форма иммуноглобулина М отличается от
секреторной не только тем, что является
мономерной, но и некоторыми особенностями
строения самого мономера IgМ:
в его состав входит гидрофобный
трансмембранный участок и короткий
гидрофильный цитоплазматический хвост.
В то же время мономерная молекула
секреторной формы иммуноглобулина М
имеет на С-конце углеводные остатки,
увеличивающие растворимость молекулы,
и цистеиновый остаток, необходимый для
полимеризации мономеров в пентамерную
форму с помощью J-цепи.
Молекула мембранного иммуноглобулина
М кодируется теми же рекомбинантными
иммуноглобулиновыми локусами, что и
секреторного иммуноглобулина (χ- или
-локусом, кодирующим
легкую цепь, и локусом тяжелых цепей).
Некоторые же отличия в строении С-конца
тяжелых цепей секреторного и мембранного
IgМ обусловлены особенностями
считывания информации с генов локуса
тяжелой цепи, лежащих за С-геном.
В частности, за этим геном расположены
короткие гены – Ск и Мк, кодирующие
короткие аминокислотные последовательности
дистальной части тяжелой цепи
соответственно секреторного иммуноглобулина
(ген Ск) и мембранного иммуноглобулина
(ген Мк). При образовании секреторной
формы IgМ, после считывания
информации с С-гена
транскрибируется только ген Ск, кодирующий
концевой участок тяжелой цепи секреторной
формы. При образовании тяжелых цепей
мембранного IgМ
транскрибируется более длинный участок
генома за С-геном,
включающий гены и Ск и Мк. Затем в
результате процессинга участок мРНК,
комплементарный Ск-гену, вырезается
(подвергается делеции), а остальная
часть длинной мРНК, кодирующей тяжелую
цепь -типа, путем
сплайсинга сшивается с коротким
фрагментом мРНК, комплементарным
Мк-гену, в результате чего возникает
зрелая мРНК, кодирующая мембранную
форму IgМ. Таким образом,
трансляция тяжелой цепи мембранного
иммуноглобулина М представляет собой
более сложный процесс, требующий больших
энергозатрат, чем секреторной формы,
поскольку предполагает считывание
информации с более длинного участка
генома и последующий процессинг и
сплайсинг пре-мРНК, в связи с чем
мембранной формы иммуноглобулина в
В-лимфоцитах образуется гораздо меньше,
чем секреторной. Синтез мембранной
формы IgМ начинается на
заключительных этапах дифференцировки
В-лимфоцитов в красном костном мозге.
Зрелые В-лимфоциты экспрессируют
достаточно большое количество мембранного
IgМ на своей поверхности:
2х105 молекул на клетку. Мембранная
форма иммуноглобулина М на поверхности
В-лимфоцитов может непосредственно
взаимодействовать с любыми формами
антигенов: как свободными корпускулярными
(вирусами, бактериями) и молекулярными,
так и связанными с рецепторами
антигенпредставляющих клеток (моноцитов,
макрофагов, дендритных клеток). Но в то
же время молекулы мембранного IgМ
сохраняют свою специфичность: молекулы
каждого клона В-лимфоцитов проявляют
сродство к строго определенным антигенным
детерминантам, оставаясь равнодушными
к другим.

Рис. Схема генетического контроля синтеза мембранного и секреторного IgM. При образовании мембранной или секреторной форм IgM процесс реорганизации генома В-лимфоцита характеризуется следующими особенностями. Рекомбинантная ДНК содержит последовательность нуклеотидов от лидерного участка (L) до терминальной последовательности полиаденина (рАm – полиаденин мембранного пути развития) включительно. В реорганизованный локус ДНК входят экзон Ск (секреторный компонент) и два экзона Мк (мембранный компонент), один из которых контролирует трансмембранную последовательность, а второй – цитоплазматическую последовательность аминокислотных остатков рецепторного иммуноглобулина. В том случае, когда образующийся первичный транскрипт (пре-мРНК) включает экзоны Мк, синтезируется μ-цепь мембранного иммуноглобулина. При этом Ск и рАс (рАс – полиаденин секреторного пути реорганизации) подвергаются делеции при сплайсинге пре-мРНК. Если первичный транскрипт не включает последовательность Мк и рАm, но сохраняет Ск и рАс, то в результате последующих преобразований синтезируется μ-цепь секреторного иммуноглобулина
Взаимодействие мембранной формы IgМ В-лимфоцитов с определенным антигеном сопровождается активацией В-лимфоцитов, в результате которой В-лимфоциты превращаются в антителопродуцирующие клетки (плазматические клетки). Активация В-лимфоцита может происходить как самостоятельно после взаимодействия антигена с рецептором, так и зачастую с помощью цитокинов, продуцируемых активированными Т-хелперами. Вместе с тем сам по себе мембранный иммуноглобулин М после взаимодействия с антигеном активировать В-лимфоцит не может, поскольку имеет очень короткий цитоплазматический хвост, включающий всего несколько аминокислотных остатков, который не способен вступать в реакционные отношения с внутриклеточными ферментами и процессами. Для активации же В-лимфоцитов после присоединения к их антигенраспознающим рецепторам антигенов служат специальные вспомогательные низкомолекулярные белки – Ig и Ig, расположенные в непосредственной близости от мембранного IgМ в плазматической мембране В-лимфоцита и имеющие гораздо более длинные цитоплазматические концы. Эти белки после присоединения к мембранному IgМ антигенных эпитопов несколько изменяют свою конформацию, в результате чего становятся способными взаимодействовать с внутриклеточными тирозинкиназами, активируя их. Активированные тирозинкиназы, в свою очередь, активируют Са2+-зависимые фосфорилазы, катализирующие фосфорилирование определенных внутриклеточных белков. Образующиеся фосфорилированные белки влияют на конформацию связанных с ДНК белков таким образом, что усиливают транскрипцию специфических генов.
Большинство антигенов являются тимусзависимыми и для активации В-лимфоцитов требуют участия Т-хелперов. Тимуснезависимыми антигенами являются, как правило, полисахариды бактерий, имеющие множество повторяющихся одинаковых антигенных эпитопов, которые перекрестно сшиваются с большим количеством молекул мембранного IgМ на поверхности одного В-лимфоцита, что приводит к активации большого количества тирозинкиназ внутри В-лимфоцита и последующей его активации без участия Т-хелперов.
