
- •1 Курс, 1 Семестр.
- •2002Г. Содержание:
- •Вопрос № 1: Идеальный и реальный газы:
- •Закон равного распределения энергии по степеням свободы:
- •Цикл Карно:
- •Вопрос № 11: Методы статистической физики:
- •Вопрос № 12: Вероятность случайного события:
- •Перенос импульса – вязкость:
- •Перенос энергии – теплопроводность:
- •Диффузия – перенос массы:
Московский Авиационный Институт
Конспект по физике
Молекулярная физика и
Термодинамика
1 Курс, 1 Семестр.
Москва
2002Г. Содержание:
Вопрос № 1“ Идеальный и реальный газы ” 3
Вопрос № 2“ Число степеней свободы ” 3
Вопрос № 3“ Первое начало термодинамики ” 4
Вопрос № 4“ Изопроцессы ” 5
Вопрос № 5 “ Теплоёмкость при постоянном объёме и давлении ” 7
Вопрос № 6“ Работа при изотермическом расширении ” 8
Вопрос № 7“ Работа газа при адиабатическом процессе ” 8
Вопрос № 8“ Второе начало термодинамики в формулировках Клаузиса и Томпсона ” 8
Вопрос № 9“ Запись первого начала термодинамики через энтропию ” 9
Вопрос № 10“ Круговые процессы (циклы) ” 9
Вопрос № 11“ Методы статистической физики ” 10
Вопрос № 12“ Вероятность случайного события ” 11
Вопрос № 13“ Среднее значение случайной величины ” 11
Вопрос № 14“ Распределение Максвелла молекул газа по проекциям скорости ” 12
Вопрос № 15“ Распределение Максвелла молекул газа по модулю скорости ” 13
Вопрос № 16“ Распределение Максвелла молекул газа по энергии ” 14
Вопрос № 17“ Распределение Максвелла молекул газа по импульсу ” 14
Вопрос № 18“ Наиболее вероятная скорость движения молекул ” 14
Вопрос № 19“ Среднеарифметическая и среднеквадратичная скорости движения молекул ” 15
Вопрос № 20“ Распределение Больцмана ” 15
Вопрос № 21“Явления переноса” 16
Вопрос № 1: Идеальный и реальный газы:
Уравнение состояния идеального газа (три формы записи)
Идеальный газ– это газ, молекулы которого рассматриваются как материальные точки, между которыми отсутствуют силы взаимодействия.
Реальный газ– газ, в котором между молекулами действуют силы притяжения и отталкивания.
Уравнение состояния:
Для фиксированной массы можно записать:
![]()
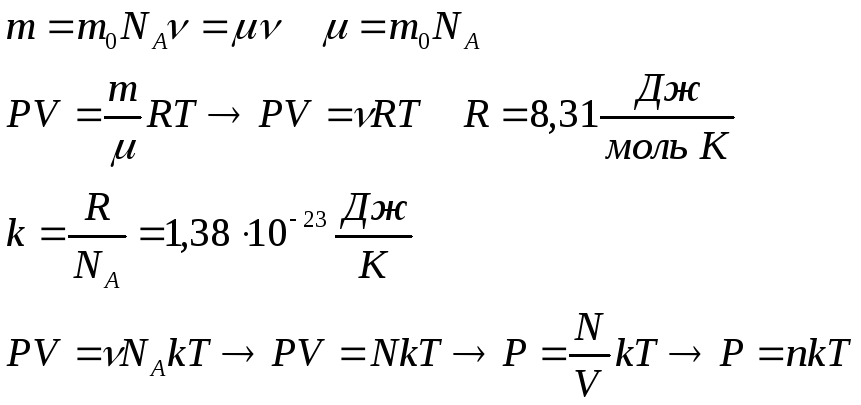
Нормальными– называются условия, при которых давление составляет 101325 Па или 105Па, температура – 273 К. Число Авогадро = 6,02 1023моль-
Уравнение состояния для одного моля:
![]()
Уравнение состояния для произвольной массы:
![]()
a– добавка, необходимая для учёта взаимодействия молекул реального газа.
б – добавка, учитывающая реальные объемы молекул реального газа.
Внутренняя энергия системы:
![]() –
то есть полная энергия системы равна
сумме кинетической энергии системы,
как единого целого, потенциальной
энергии молекулярного взаимодействия,
энергии электронных оболочек и энергии
взаимодействия нуклонов в ядре.
–
то есть полная энергия системы равна
сумме кинетической энергии системы,
как единого целого, потенциальной
энергии молекулярного взаимодействия,
энергии электронных оболочек и энергии
взаимодействия нуклонов в ядре.
![]()
Вопрос № 2: Число степеней свободы:
Закон равномерного распределения по степеням свободы.
Внутренняя энергия идеального газа.
Число независимых координат, которые необходимо задать, что бы полностью определить положение тела в пространстве называют числом степеней свободы. Число степеней свободы складывается из числапоступательных, числавращательныхи числаколебательныхстепеней свободы.
В одноатомном газе число степеней свободы равно трём, в двухатомном – (три поступательных и две вращательных – жёсткая гантель) равно пяти, в трёх и более – шести.
Закон равного распределения энергии по степеням свободы:
На каждую степень свободы приходится
энергия:
![]() следовательно
следовательно![]()
Рассмотрим идеальный газ, состоящий из Nмолекул:
![]()
В реальном газе внутренняя энергия включает в себя ещё и энергию межмолекулярного взаимодействия.
![]()
Вопрос № 3: Первое начало термодинамики:
Дифференциальная, интегральная формы записи.
Работа газа.
Теплоёмкость.
Удельная.
Молярная.
Связь.
Запись первого начала термодинамики с учётом теплоёмкостей.
Обмен энергией между термодинамической системой и внешними телами осуществляется двумя путями: совершением работы и теплообменом.
![]()
Дифференциальная
форма записи первого начала термодинамики:

Интегральная форма записи первого начала термодинамики:

Теплоёмкость:
Физическая величина, численно равная
отношению
![]() к дифференциалу
к дифференциалу![]() тела
в рассматриваемом термодинамическом
процессе называется теплоёмкостью.
тела
в рассматриваемом термодинамическом
процессе называется теплоёмкостью.
![]() зависит
от химического состояния вещества,
массы тела, термодинамического состояния
и от вида процесса, в котором поступает
теплота.
зависит
от химического состояния вещества,
массы тела, термодинамического состояния
и от вида процесса, в котором поступает
теплота.
Удельная теплоёмкость– это отношение теплоёмкости к массе
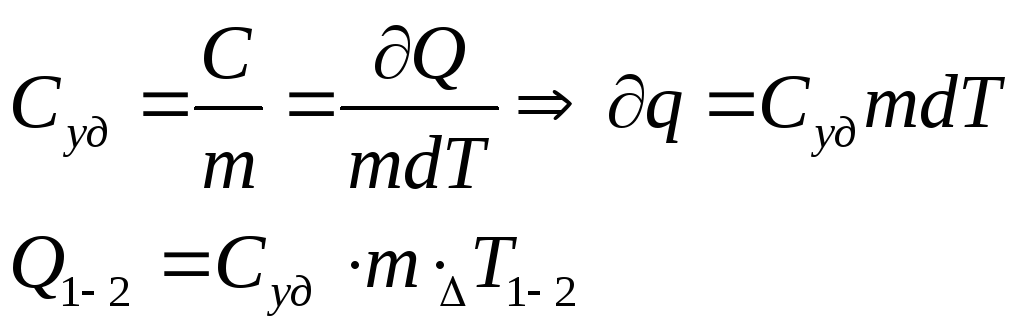
Молярная теплоёмкость–![]()
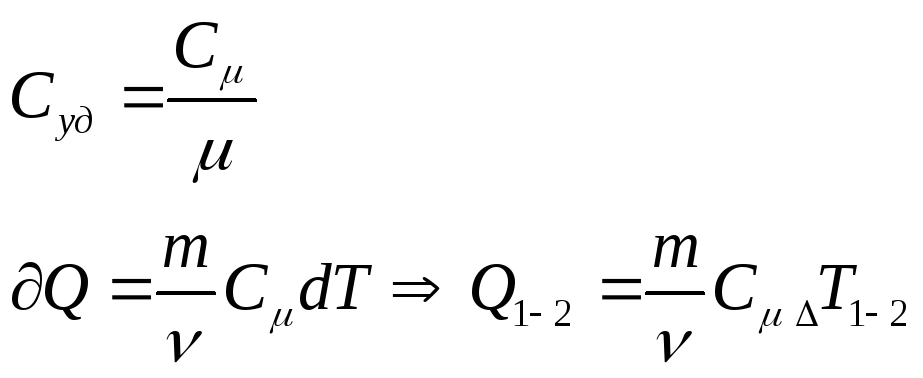
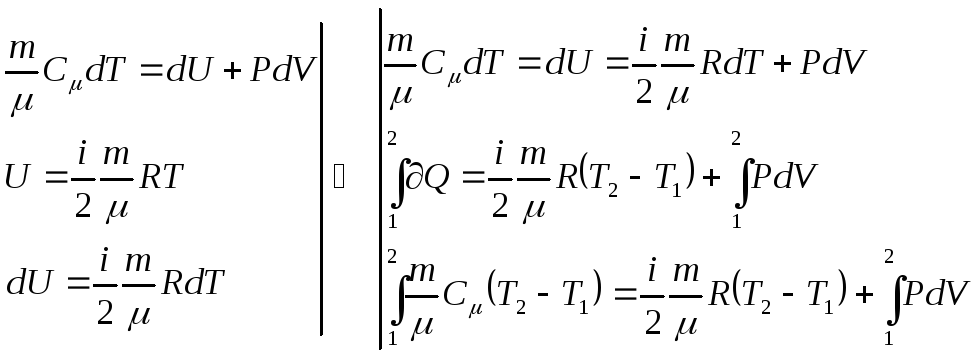
![]()
Вопрос № 4: Изопроцессы:
Законы для изопроцессов.
Графики.
Адиабатный процесс.
Закон Паусона.
Изохорный процесс:
Объём неизменен.
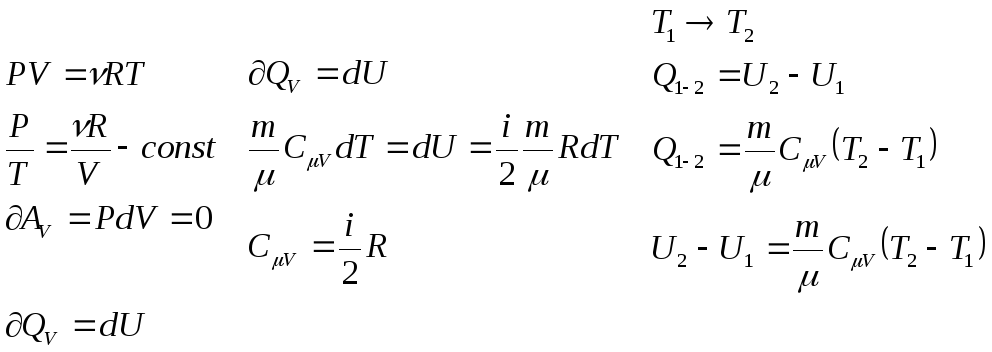
Изобарный процесс:
Д авление
неизменно.
авление
неизменно.
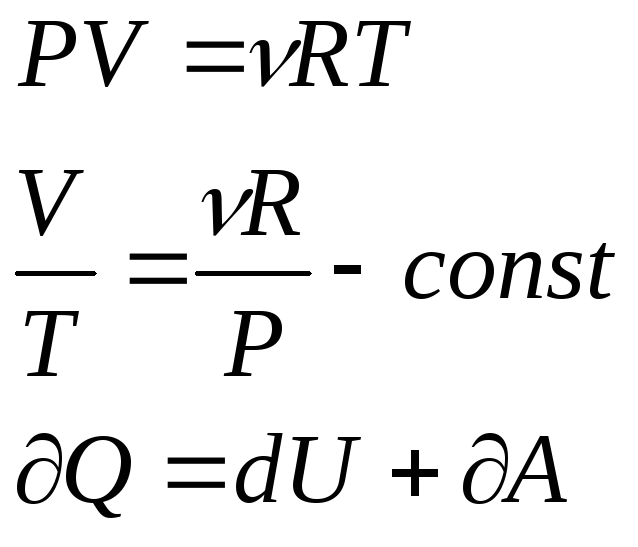
Работа в изобарном процессе:
![]() –
так как давление неизменно!
–
так как давление неизменно!
Изотермический процесс:
Т емпература
неизменна.
емпература
неизменна.
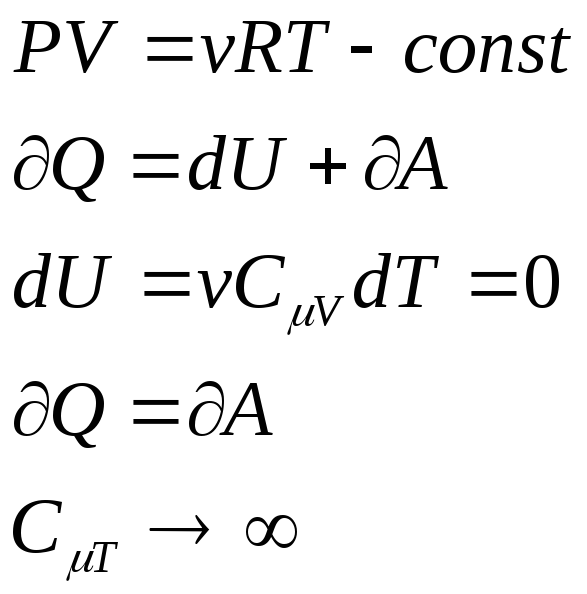
А диабатический
процесс:
диабатический
процесс:
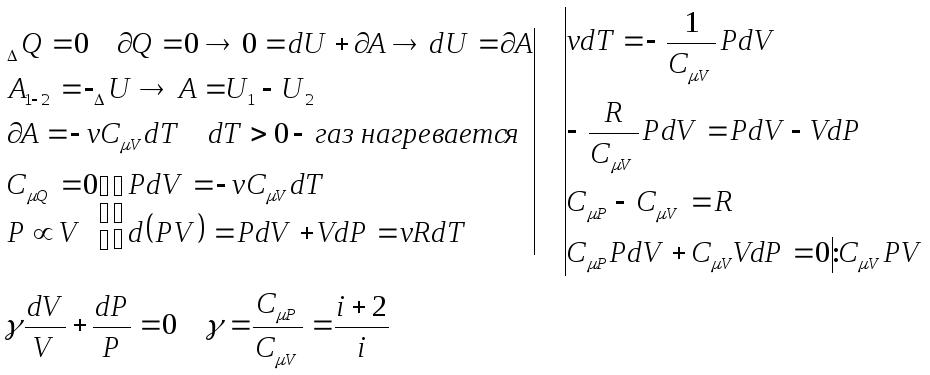
где γ– показатель адиабаты.
![]() –
уравнение Паусона.
–
уравнение Паусона.

![]()
Вопрос № 5: Теплоёмкость при постоянном объёме и давлении:
Вывод уравнения Маера.
Теплоёмкость при постоянном объёме:
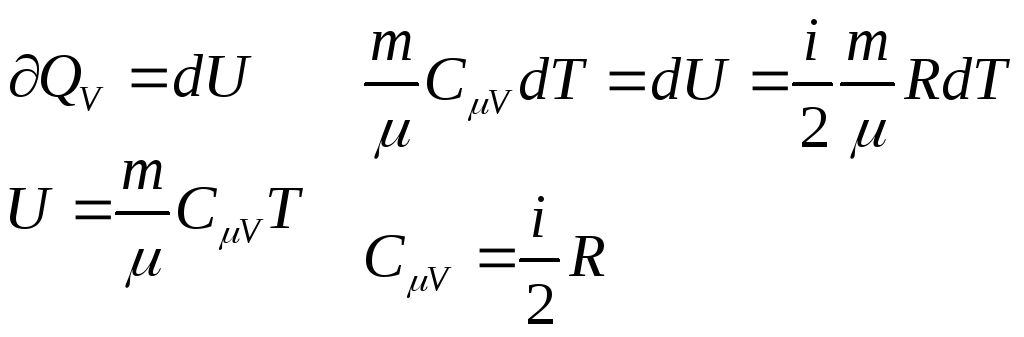
Теплоёмкость при постоянном давлении:

Вывод уравнения Маера:
![]()
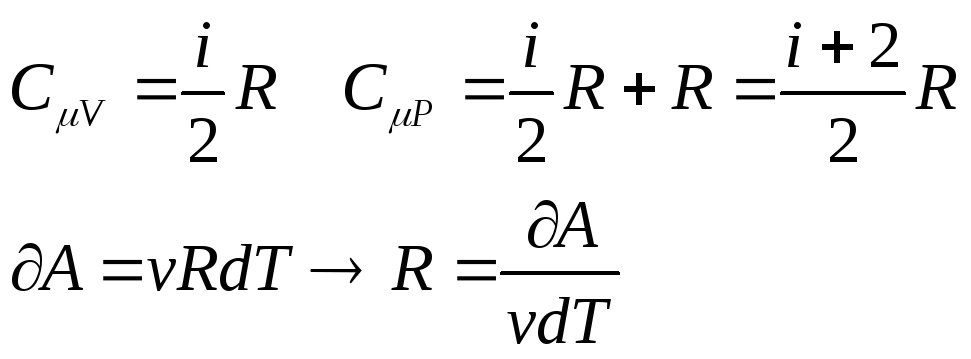 –
газовая постоянная численно равна
работе, совершаемой одним молем идеального
газа при его изобарном нагреве на один
градус кельвина.
–
газовая постоянная численно равна
работе, совершаемой одним молем идеального
газа при его изобарном нагреве на один
градус кельвина.
Физический смысл уравнения Маера заключается в том, что при изобарном нагревании газа к нему необходимо подвести большее количество теплоты, нежели при таком же изохорном.
![]()
Вопрос № 6: Работа при изотермическом расширении:
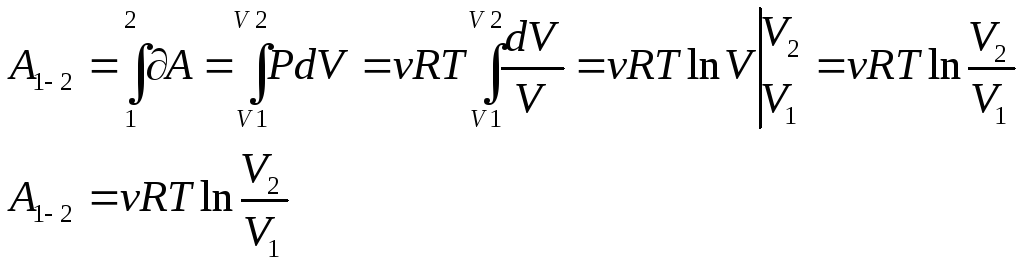
![]()
Вопрос № 7: Работа газа при адиабатическом процессе:
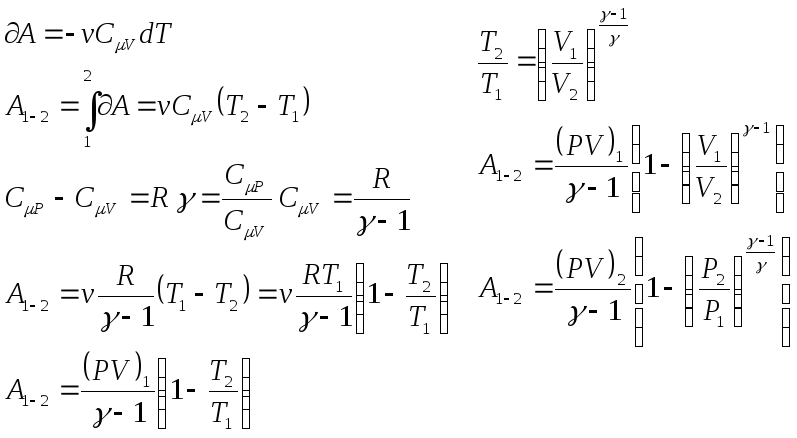
![]()
Вопрос № 8: Второе начало термодинамики в формулировках Клаузиса и Томпсона:
Энтропия.
Формулировка второго начала термодинамики через энтропию.
Второе начало термодинамики по Клаузису:
Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему.
Второе начало термодинамики по Томпсону:
Невозможен процесс, единственным результатом которого является совершение работы за счёт охлаждения одного тела.
Энтропия:
Энтропия– это функция состояния термодинамической системы.
Для обратимых процессов –
![]() ,
,![]() .
.
Для необратимых процессов –
![]() .
.
В изолированной системе энтропия неизменна. Если в системе присутствуют необратимые процессы, то энтропия будет возрастать.
Формулировка второго начала термодинамики через энтропию:
Энтропия замкнутой системы не может убывать при любых происходящих в ней процессах.
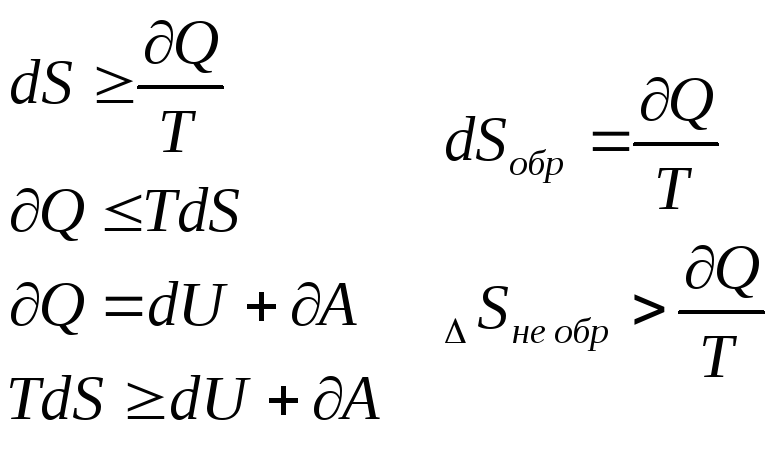
Внутренняя энергия и энтропия являются функциями состояния, а работа и теплота – нет, по этом по энтропии и внутренней энергии берутся полные дифференциалы, а по работе и теплоте – частичные.
Т – S– диаграмма:
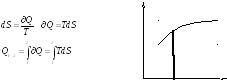
![]()
Вопрос № 9: Запись первого начала термодинамики через энтропию:
Энтропия в изопроцессах.
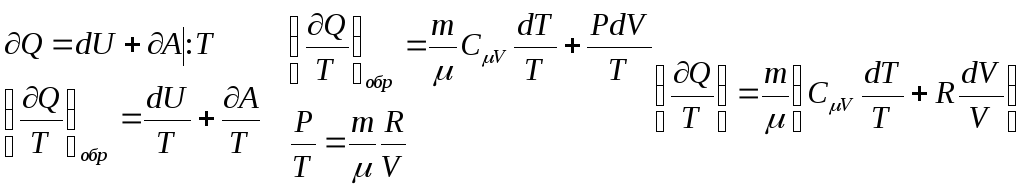
Энтропия в изохорном процессе:
![]()
![]()
Вопрос № 10: Круговые процессы (циклы):
Цикл Карно
Расчёт К.П.Д. цикла Карно.
Цикломназывается такая совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние.
Тепловая машина– устройство, преобразующее тепло в работу.
Для непрерывного цикла необходимо:
нагреватель,рабочее тело,холодильник.Холодильникнеобходим, чтобы вернуть рабочее тело
в исходное состояние.![]()
К.П.Д.цикла рассчитывается как отношение работы цикла к затраченному теплу. Или как отношение разности между затраченным и выделившимся теплом к затраченному теплу.
