
- •Химическая связь
- •Взаимное влияние атомов в органических молекулах
- •Пространственное строение органических молекул
- •Физико-химические методы идентификации
- •Общие закономерности реакционной способности органических соединений
- •Реакционная способность насыщенных углеводородов
- •Непредельные углеводороды
- •Ароматические углеводороды Арены
- •Галогенпроиводные углеводороды
- •Гидроксопроизводные углеводороды
- •Простые эфиры
- •Оксосоединения
- •Овр карбонильныхсоединений
- •Карбоновые кислоты
- •Функциональные производные карбновых кислот
- •Ароматические карбоновые кислоты
Гидроксопроизводные углеводороды
-
Спирты связаны с sp3 – гибридизованным атомом С.
-
Фенолы связаны с sp2 – гибридизованным атомом С.
Спирты
Изомерия:
-
По положению – OH-группы(бутанол-1, бутанол-2);
-
По строению углеродного скелета:
а) у алифатических C
|
С – С – С – С – OH C – C –C – OH
Бутанол-1 2 метил пропанол-1
б) по строению углеводородного радикала
- насыщенные;
- ненасыщенные
3 2 1
CH2=CH – CH2 – OH 2-пропенол-1(алмеловый спирт);
- ароматические
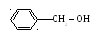 бензиловый спирт
бензиловый спирт
-
В зависимости от атома С, у которого находится – OH группа:
- первичные H3C – CH2 – CH2 – OH;
- вторичные CH3 – CH – CH3;
|
OH
CH3
|
- третичные H3C – C – CH3;
|
OH
-
По числу – OH-групп:
-одноатомные(1– OH);
-двухатомные(2– OH);
-многоатомные(больше 2х – OH).
Физические свойства:
Спирты менее летучи, лучше растворимы в воде, чем соответствующие им углеводороды. Это связано с полярностью – OH-группы и возникновением водородных связей, приводящих к ассоциации молекул.

При растворении в воде с ее молекулами образуется водородная связь. В полиолах возрастает количество межмолекулярных водородных связей.
Способы получения:
- Гидролиз галогеналканов водным раствром щелочей;
- Гидратация алкенов;
- Восстановление альдегидов и кетонов;

- С использованием реактивов Биньяра

- Гидролиз сложных эфиров

- Из «синтез-газа»:
CH4 + H2O→ t,p,кат. CO(г.) + 3H2(г.)
nCO + 2nH2→ t,p,кат. CnH2n+1OH + (n-1)H2O
CO(г.) + 2H2O(г.)↔ CH3OH – метанол в промышленности (условия реакции те же)
- Брожение сахаристых веществ:
C6H12O6→ фермент C2H5OH + 2CO2
Кислотные свойства спиртов:

Спирты более слабые кислоты по Брестеду и жесткие по Пирсену, чем H2O (pk=18). Алкоголят-анион не стабилен, т.к. радикал за счет +I повышает электронную плотность и затрудняет диссоциацию – OH-группы
R – O – H → R→O-
+ H+
– O – H → R→O-
+ H+
+I (ЭД)
2R – OH + 2Me→2R – ONa + H2↑
Алкоголят
Алкоголяты, как соединения, образованные сильным основанием и слабой кислотой, легко гидролизуются.
RONa + HOH→R – OH + NaOH
Основные свойства:
Связаны с наличием неподеленной пары электронов атома О. Слабые основания по Брестеду и жесткие по Пирсену.

Т.о. спирты имею амфотерный характер, слествием чего является образование водородных связей.
В ряду : первичные – вторичные – третичные спирты – основные свойства возрастают, а кислотные убывают.
Реакции с участием нуклеофильного центра:
а) О-алкилирование (образование простых эфиров)
R – ONa + ClR→R – O – R + NaCl (по Вильямсону)
Для возрастания нуклеофильности используют алкоголяты.

б) О-ацилирование (образование сложных эфиров)

Реагируют с неорганическими кислотами:
C2H5OH + H2SO4→ 0 ° C2H5OSO3H + H2O
2C2H5OH + H2SO4→ t (C2H5O)2SO2 + H2O
Реакции с участием электрофильного центра:
C2H5OH + HBr→ H+ C2H5Br + H2O
Первичные спирты реагируют по механизу SN2. Кислотный катализатор необходим для того, чтобы превратить плохо уходящую группу – OH в хорошо уходящую стабильную молекулу H2O.
Механизм реакции:

Третичные спирты реагируют по механизму SN1:

CH3

(CH3)3C+ + Br- →быстро (CH3)3CBr
ROH + PCl5→R – Cl + ROCl3 + HCl
ROH + PCl3→R – Cl + H3PO3
ROH + SOCl2→R – Cl + SO2 + HCl
Замена – OH на аминогруппу:
R – OH + H – NH2 →t, кат. R – NH2 + H2
Реакции с участием CH-кислотного центра:
Внутримолекулярная дегидратация
Происходит при нагревании(t>150°) в присутствии серной кислоты
(в промышленности t>300-350°, Al2O3)

Первичные спирты дегидрируются по механизму E2. Третичные спирты – по E1. (механизм смотреть у галогенводородов)
По правилу Зайцева:

Реакции окисления:

Третичные спирты этим реагентом не окисляются. При их окислении в жестких условиях происходит разрыв С – С связей.
Дегидрирование:
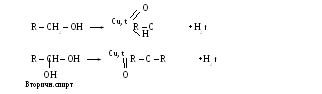
Многоатомные спирты
Двухатомные :
OH – CH2 – CH2 – OH этиленгликоль (этандиол-1,2)
Получение:
- Мягкое окисление этилена;
- Гидролиз вицинальных диалогеналканов водными растворами щелочей;
- Гидролиз этиленоксида в кислой или щелочной среде;
CH2 – CH2 + HOH→CH2 – CH2

 | |
| |
O OH OH
Трехатомные:
CH2 – CH – CH2
| | |
OH OH OH глицерин(пропангликоль-1,2,3)
Получение:
- Гидролиз тригалоген алканов;
- Гидролиз жиров
CH2OCOR CH2 – OH
| |
CHOCOR + 3NaOH → CH – OH + 3RCOONa
| |
CH2OCOR CH2 – OH
- Из пропилена

Многоатомные спирты дают все реакции одноатомных, но образуют двухатомных – 2 ряда производных, трехатомных – 3 ряда производных. Гликоли более кислотны, чем одноатомные спирты. Они реагируют не только с щелочными Ме, но и с щелочами. Также легко идет замещение атома Н ионами тяжелых металлов, в результате образуются хелатные соединения.





 CH2
– OH CH2
– O O – CH2 –
CH2
– OH CH2
– O O – CH2 –
2
 | + Cu(OH)2
+ 2NaOH→ | Cu | 2 Na+
| + Cu(OH)2
+ 2NaOH→ | Cu | 2 Na+

 CH2
– OH CH2
– O O – CH2
CH2
– OH CH2
– O O – CH2
Производные глицерина:
Образование сложных эфиров с
- органическими кислотами:
O


C H2
– OH HO
– C – R
CH2 –
OCOOR
H2
– OH HO
– C – R
CH2 –
OCOOR


 O
O
C H
– OH HO – C – R CH2
– OCOOR
H
– OH HO – C – R CH2
– OCOOR

 O
-3H2O
O
-3H2O


CH2 – OH HO – C – R CH2 – OCOOR
- с азотной кислотой:
CH2 – OH HO – NO2 CH2 – O – NO2


C H2
– OH + HO – NO2
CH2
– O – NO2
H2
– OH + HO – NO2
CH2
– O – NO2

 -
3H2O
-
3H2O
CH2 – OH HO – NO2 CH2 – O – NO2
Лекция №10
Непредельные спирты
Простейший виниловый спирт неустойчив и перегруппировывается в альдегид.

П


 равило
Эльтекова: соединения, содержащие –
OH-группу при двойной связи, называемые
виниловыми спиртами, неустойчивы и тут
же перегруппировываются в карбоновые
соединения.
равило
Эльтекова: соединения, содержащие –
OH-группу при двойной связи, называемые
виниловыми спиртами, неустойчивы и тут
же перегруппировываются в карбоновые
соединения.
CH3 – CH=CH – CH3 →CH3 – CH2 – C – CH3

 | ||
| ||
O
 H
O
H
O
Эфиры виниловых спиртов вполне устойчивы.
CH3=CH – OCOCH3 винилацетат
n CH2=CH
→ кат.
– CH2 – CH
–
CH2=CH
→ кат.
– CH2 – CH
–
| |
OCOCH3 OCOCH3 n поливинилацетат
Фенолы:
– ОН-группа связана с бензольным кольцом
-
Одноатомные


-
Двухатомные

-
Трехатомные

Одноатомные фенолы. Способы получения:
-
Перегонка каменно-угольной смолы;
-
Кумольный способ

-
Из хлорбензола

-
Из солей диазония

-
Щелочное плавление бензол сульфаната

Химические свойства:
I) По фенольному гидроксилу
- кислотно-основные свойства:
Фенолы более кислотны, чем одноатомные спирты, т.к. фенолят-анион стабилен за счет делокализации отрицательного заряда по сопряженной системе π-связей.
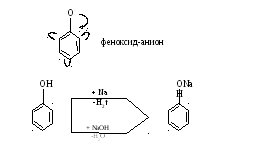
Фенолы более слабая кислота, чем минеральные кислоты.

Фенол практически не проявляет основных свойств, т.к. неподеленная пара находится в сопряжении с π-электронами кольца.

Образование простых эфиров происходит в услових реакции Вильямсона:

Образование сложных эфиров:
Этерификация труднее, чем у спиртов из-за слабых нуклеофильных свойств.

Качественная реакция
Реагент FeCl3, который дает фенолят железа фиолетового цвета.

II) По ароматическому кольцу
– ОН –группа является ориентантом I рода, и фенолы реагируют активнее, чем бензол в реакции SE.
-
Галогенирование

-
Нитрование

-
Сульфирование

-
Нирозирование

-
Карбоксилирование(реакция Кольбе)

-
Гидроксилметилирование
 При
дальнейшем действии формальдегидные
цепи растут, и в результате реакция
поликонденсации образуетсяфенолформальдегидная
смола сегенской структуры.
При
дальнейшем действии формальдегидные
цепи растут, и в результате реакция
поликонденсации образуетсяфенолформальдегидная
смола сегенской структуры.
-
Формирования(реакция Раймера – Гимана)
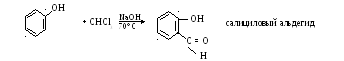
III) Окисление

