- •Химическая связь
- •Взаимное влияние атомов в органических молекулах
- •Пространственное строение органических молекул
- •Физико-химические методы идентификации
- •Общие закономерности реакционной способности органических соединений
- •Реакционная способность насыщенных углеводородов
- •Непредельные углеводороды
- •Ароматические углеводороды Арены
- •Галогенпроиводные углеводороды
- •Гидроксопроизводные углеводороды
- •Простые эфиры
- •Оксосоединения
- •Овр карбонильныхсоединений
- •Карбоновые кислоты
- •Функциональные производные карбновых кислот
- •Ароматические карбоновые кислоты
Лекция №1
Химическая связь
Ковалентная связь
-
Образуется между атомами равными или близкими по ЭО;
-
Электронная оболочка инертного газа образуется за счет обобществления валентного ĕ и формирования одной или нескольких электронных пар;
-
Простые связи представляются одной парой ĕ, а кратные двумя или тремя парами ĕ;
-
Бывает:
- Неполярная
Ковалентная неполярная связь образуется между атомами с одинаковой ЭО, и общая электронная пара располагается симметрично относительно центров обоих атомов.
Н3С-CH3 Н3С
(:) CH3
Н2С=CH2 НС≡CH
–
ковалентная неполярная связь

–
- Полярная
Ковалентная полярная связь образуется между атомами с разной ЭО, и общая электронная пара смещена к более электроотрицательному элементу.
ЭО – способность атомов приятгивать ĕ.

- Донорно-акцепторная
Донорно-акцепторная связь – разновидность ковалентной связи, образованной за счет пары ĕ, предоставляемой одним из атомов.

Для описания КС с позиции квантовой механики используют два основных метода:
-
Метод молекулярных орбиталей (МО)
-
Метод валентных связей (ВС)
Согласно МВС КС рассматривается как результат перекрывания АО, несущих по одному ĕ с противоположными спинами; при этом АО сохраняет свою индивидуальность.
Описание молекулы сводится составлением max резонансных структур.
Н - H
Н+H-
↔ H-Н+
ММО предполагает перекрывание одноэлектронных АО, вместо них образуется такое же количество МО.
Существует три типа МО:
-
Связывающие - образуются путем сложения или перекрывания АО;
-
Разрыхляющие - образуются путем вычитания или отталкивания АО;
-
Несвязывающие – состоят из АО, которые переходят в молекулу в неизменном виде; на них обычно располагаются π-электроны.
-Ковалентные σ- и π-связи
σ-связи образуются в результате перекрывания вдоль линии соединений ядер атомов
Химическая связь, согласно теории МО, образуется в том случае, если число ĕ на связующем больше числа ĕ на разрыхляющем.

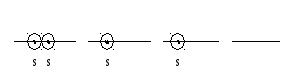

π-связь – боковое перекрывание негибридизованных p-орбиталей.

-
Основные характеристики ковалентных связей:
-
Длина связи.
Это расстояние между центрами связанных атомов в молекуле. Оно зависит от природы и типа гибридизации атомов, образующих связь.
l Csp3
lC-C
0, 154нм
Csp3
lC-C
0, 154нм
l Csp2
lC=C
0, 134нм
Csp2
lC=C
0, 134нм
l Csp
lC≡C
0, 154нм
Csp
lC≡C
0, 154нм
lC=C > lC=N > lC=O
lC≡C > lC≡N
-
Энергия связи.
Это энергия, которая выделяется при образовании связи
EC-C 347 кДж/моль
EC=C 610 кДж/моль
EC≡C 836 кДж/моль
-
Полярность.
Это неравномерное распределение электронной плотности, обусловленное различной электроотрицательностью.
ЭОsp>ЭОsp2>ЭОsp3
-
Поляризуемость связи.
Это способность электронного облака к поляризации при действии внешнего электронного поля или электрически заряженных частиц.
π-связи более поляризуемы, чем σ-связи.
Ионная связь
Это электростатическое притяжение разноименно заряженных ионов; образуется между атомами, которые значительно различаются по ЭО.

Она образуется при взаимности атомов, имеющих неподеленные пары ĕ (доноры) с электронейтральными частицами, которые содержат секстед ĕ.
Атомы связываются двояко: ковалентной и ионной связями.


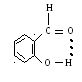
Водородная связь
Дополнительный вид связи, образованный в результате электростатическим взаимодействием между сильно полярными атомами H+ и атомами с неподеленной парой ĕ.
Межмолекулярные ВС:

Внутримолекулярные ВС: