
- •Химическая связь
- •Взаимное влияние атомов в органических молекулах
- •Пространственное строение органических молекул
- •Физико-химические методы идентификации
- •Общие закономерности реакционной способности органических соединений
- •Реакционная способность насыщенных углеводородов
- •Непредельные углеводороды
- •Ароматические углеводороды Арены
- •Галогенпроиводные углеводороды
- •Гидроксопроизводные углеводороды
- •Простые эфиры
- •Оксосоединения
- •Овр карбонильныхсоединений
- •Карбоновые кислоты
- •Функциональные производные карбновых кислот
- •Ароматические карбоновые кислоты
Овр карбонильныхсоединений
Окисление альдегидов:
Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов:
- аммиачным раствором серебра(реакция Толленса):

Окисление кетонов:
- Проводят в жестких условиях. Окисление идет с разушением С – С связей.
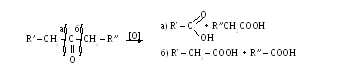
- Пероксидными соединениями (H2О2, монопероксидной кислотой). Образуются сложные эфиры. Реакция Байера – Виллигера:

- Реакция Конницца Тищенко (самоокисление – самовосстановление, реакция дисмутации)
В эту реакцию вступают в щелочной среде лишь те альдегиды, у которых у α-углеродного атома нет ни одного атома Н.

Формальдегид вступает в эту реакцию даже в нейтральной среде.

Механизм реакции в щелочной среде:

Восстановление:
Альдегиды – до первичных спиртов, кетоны – до вторичных.
Реагенты:
-
+ H2 (кат.)

-
Комплексные гибриды щелочных металлов: NaBH4, JiAlH4, которые являются источником нуклеофильного гидрид-иона.
Восстановление, как AN

Восстановление до углеводородов.
а) По Клемменсону

б) По Кижнеру-Вольфу
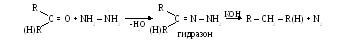
Лекция №12
Хиноны
Это дикетоны, их получают:
В химическом отношени 1,4 – хетоны ведут себя как α,β – ненасыщенные кетоны, т.е. вступают в реакции 1,2 – или 1,4 – приоединения (спирты, амины, органические и неорганические кислоты)

Хионовый фрагмент входит в состав витаминов группы К.

Антрохионы являются действующими веществами листьев сенны, крумины, настойки отваров которых принмают как слабительное. Это в основном ди - , три – гидрооксоантрохионы, объединенные в группы эмодинов.

Амины
Это органические производные аммиака. В зависимостиот числа алкильны или арильных групп различают: первичные, вторичные и третичные амины.
|
|
Алифатические |
Жирно-ароматические |
Ароматические |
|
первичные |
R – NH2 CH3 – NH2 Метиламин 3 2 1 CH3 – CH2 – CH2 – NH2 Пропанамин-1 (пропиламин) |
|
Ar – NH2
|
|
Вто ричные |
R – NH – R CH3 – NH – C2H5 метилэтиламин |
R CH3 – NH2 –
метилфениламин |
Ar – NH – Ar Дифениламин
|
|
Тре тичные |
R
R CH3=N – C2H5
C3H7 метилэтилпропиламин |
R
R
H
N,N - диметиламин |
A
Ar
|
К аминам относят и четвертичные аммониевые соли.

Диамины:
H2N – CH2CH2CH2CH2 – NH2 (тетраметилендиамин, 1,4 – бутандиамин, путресцин)
H2N – CH2CH2CH2CH2 CH2 – NH2 (пентаметилендиамин, 1,5 – пентандиамин, каэаверин)
Они образуются при декарбоксилировании диаминовых кислот.
Способы получения:
Действия аммиака на алкилгалогениды (реакции Гофмана)
+NH3
R – Cl + NH3 → [RNH3]+Cl- → R – NH2 первичный амин
-NH4Cl
+NH3
R – Cl + R – NH2 → [R2NH2]+Cl- → R – NH – R вторичный амин
-NH4Cl
+NH3
R – Cl + R
– NH – R
→ [R3NH]+Cl-
→ R – N
– R третичный амин
– Cl + R
– NH – R
→ [R3NH]+Cl-
→ R – N
– R третичный амин
-NH4Cl
R
R – Cl + R3N → [R4N]Cl четвертичная аммониевая соль
Восстановление :
- Нитрилов
R – C≡N + [H] → H2,кат. R – CH2 – NH2
- Оксимов
R –C=N – OH + [H]→R – CH2 – NH2 + H2O
- Гидрозонов
R – CH=N – NH – C6H5 + [H] → R – CH2NH2 + C6H5NH2
- Через перегруппировку Гофмана

- Амидов

- Нитросоединений (в основном для получения ароматических аминов). Реакция Зинина:

В завсимости от ph среды восстановлние идет следующим образом:
а)в кислой среде

б)в щелочной среде

Физические свойства:

Молекулы аминов ассоциированы в следствии образования водородной связи, но в меньшей степени, чем у спиртов.

Пространственная модель аминов представляет собой пирамиду, в которой легко происходит инверсия, у правильных аминов отсутствует оптическая изомерия.

При протонировании и образовании солей строение становится близко к тетраэдрическому, и становится возможной оптическая изомерия.
Химические свойства:
Химические свойства очень слабые, и лишь в присутствии сильных оснований возможен отрыв протона.
R – NH2 + B- → BH + R – NH-
О сновные
свойства связаны с наличием неподеленной
пары электронов на атоме N.
Алифатические амины более основны, чем
ароматические
сновные
свойства связаны с наличием неподеленной
пары электронов на атоме N.
Алифатические амины более основны, чем
ароматические
..
R – NH2 + HOH → [R – NH3]+OH- обнаруживается индикатором.
R – NH2 + HCl → [R – NH3]Cl соль
И с другими органическими кислотами.
У алифатических аминов алкильные радикалы за счет +I увеличивают электронную плотность у атомов N.
R→NH2 R→NH←R вторичные более осноны, чем первичные
+I(ЭД) +I(ЭД) +I(ЭД)
Основность в водном растворе у алифатических аминов зависит от сальватации аллилламониевого иона. Чем больше атомов Н связано с атомом N в катионе, тем больше возможностей для сильной сальватации за счет образования водородной связи.

В тертичных аминах большое значение имеет простанственная доступность для протона электронной пары N. С учетом комбинации трех факторов алифатичсекие амины в водном растворе по убыванию основности располагают следующим образом:
Вторичные>Первичные>Третичные>Аммиак
Ароматические амины
Более слабые основания, чем алифатические, т.к. у них неподеленная пара электронов N, отвечающая за основные свойства, находится в рπ-сопряжении с π-электронами бензольного кольца.

Основные свойства прявляются лишь при взаимодействии с сильными минеральными кислотами. Заместители в бензольном кольце влияют н. а основные свойства: электро-донорные – повышают, а электроно-акцепторные – понижают.
Нуклеофильные свойства:
а) Алкилирование аминов (реакция Гофмана):
.. Sn
R – NH2 + R – Cl → R – NH – R + HCl
б) Ацилирование
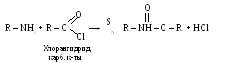
в)Раскрытие α-оксидного цикла
C


 H3
– CH2 + NH3→CH2
– CH2
H3
– CH2 + NH3→CH2
– CH2
O OH NH2 коламин(биогенный аминоспирт)
C


 H3
– CH2
+R – NH2 →CH2
– CH2
H3
– CH2
+R – NH2 →CH2
– CH2
O OH NHR
г) С азотистой кислотой (реакция позволяет различать первичные, вторичные, третичные алифатические амины)
Первичные :
- алифатические:
R – NH2 + HO – NO → R – OH + N2↑ + H2O
(низшие) азотистая первичный
кислота спирт
- ароматические

Вторичные:
Алифатические и ароматические дают нитропроизводные желтого цвета, малорастворимые в воде.
R – NH – R + HO – NO → R – N – R
– NH – R + HO – NO → R – N – R
-H2O
N=O
Третичные :
Алифатические не могут нитрозироваться, обрзуют неустойчивые соли
R 3N
+ HNO2 →
3N
+ HNO2 →
Жирно-ароматические нитрозируются в кольцо в пара-положение к нитрозирующей группе

Реакции с хлороформом:
Реагируют только первичные амины, при этом образуются изонитрилы с крайне приятным запахом.
R – NH2 + CHCl3 → OH- R – N+≡C- + 3HCl
изонитрил
Взаимодействие с альдегидами и кетонами с образованием иминов
R
 R
R
 C=O + R’ – NH2
→ C=N – R’ + H2O
C=O + R’ – NH2
→ C=N – R’ + H2O
 (H)R
R
имин(основание Шиффа)
(H)R
R
имин(основание Шиффа)
Окисление:

Легко окисляются третичные
Первичные при окислении озоном дают нитроалканы:
R – NH2 + O3 →R – NO2 + H2O В более жестких условиях и первичные, и вторичные, и третичные дают разложившиеся продукты: альдегиды, кетона, карбоновые кислоты.
Реакция окисления анилина:
а) на воздухе кислородом

б) H2SO5

в)
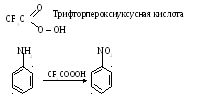
Реакции SE в кольце.
NH2-группа – ориентант I рода активирует кольцо устанавливается в орто- и пара- положении.
Лекция №13
1) Бромирование

2
NH2


 )
Сульфирование
)
Сульфирование

-
Нитрование

Реакция осложняется образованием аммониевой соли, в которой NH3+группа- орентант II рода. Следовательно, занимает мета-положение. Нитрующая смесь легко окисляет NH2 – группу, поэтому ее нужно защищить.
Диазо – и азотосоединения:
Ароматические соединения с общей формулой ArN2X, в молекулах которых содержатся групы их двух атомов N.
Они бывают двух типов:
- Собственно диазосоединения
Ar – N=N – X, где связь N – X – ковалентная, Х – остаток минеральной кислоты, а также остато уксусной кислоты или OH-.
- Соли диазония
[Ar – N+≡N]X- Связь – ионная, Х – остаток сильной минеральной кислоты.
Соли диазония:

4-метилбензолдазония хлорид.
Строение диазосоединений зависи от ph среды.
[Ar – N≡N]Cl → +KOH [Ar – N≡N ]OH ↔ Ar – N=N – OH
+NaOH +HCl


Ar – N=N – ONa Ar – NH – N=O
Диазотат Na н-нитрозоамин
Получение солей диазония:
Реакция диазотирования:
Условия: NaNO2 и HCl (2,5 моль), t от 0° до +5°С

Механизм реакции:
Диазотирущие реагенты:
а) протонированная HNO3 H – O+ - NO

+ H
б) N=O
в) N2O3
HO – NO + H+→H – O+– N=O↔ N+O + H2O
б )
)
Н а)
N+O + :O – N=O → O=N – O+– N=O → N2O3 + H+
в
 )
)
Н Н
H H
N+O + :N – Ar → O=N – N+ – Ar → Ar – N – N=O → Ar – N=N – OH → +HCl [Ar - N≡N]Cl-


 -H+
-H+
Н Н H
В сухом виде – взрывчатые вещества.
Хмические свойства солей диазония:
2 типа реакции
- реакции, идущие с выделением N2
- реакции, идущие без выделения N2
1) В этих реакциях происходит замещение диазогруппы н анион.
Замена на OH- (получение фенола)

Замена на галоген
а) фториды
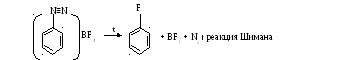
б)хлориды, бромиды

в) йодиды

Замена на -CN (проводится в условиях реакции Зандмейера)

Замена на NO2

Замена на H2

Замена на алокси-группу
При действии спиртов параллельно идет замена на OR группу

Реакция идет по механизму SN1
C6H5 – N+≡N ↔ N2 + C6H5+
C 6H5+
+ RӦH → C6H5
– O+–
R → C6H5OR
+ H+
6H5+
+ RӦH → C6H5
– O+–
R → C6H5OR
+ H+
Н
Реакции, идущие без выделения азота:
Ионы диазония являются слабыми электрофилами. Они вступают в реакции SE с ароматическими соединениями, содержащими электроно-донорные заместители. В результате образуется азосоединения. Реакция называется азосочитанием; полученные соединения имеют яркую окраску и используются в качестве красителей.

Сочетание проводят либо в слабокислой, либо в слабощелочной среде.

Сочетание с фенолами проводят в соабощелочной среде, и атаке электрофилов подвергается не фенол, а фенолят-ион.

Замещение идет в основном в пара, а не в ортоположени из-за значительного объема атакующего электрофила.
Индикаторы:
- Метиловый оранжевый

- Конгокрасный

(Хромофоры, ауксохромы)
Образование диазопроизводных

![]()
Восстановление
[H]
[ C6H5N≡N]Cl
C6H5
– NH – NH2
+ SnCl4 фенилгидрозин
C6H5N≡N]Cl
C6H5
– NH – NH2
+ SnCl4 фенилгидрозин
SnCl2 + HCl
В кислой среде: C6H5 – NH – NH2 ∙ HCl
Диазосоединения алифатического ряда
CH2=N+=N- ↔ -CH2 – N+≡N
Диазометан, ядовитый, желто-зеленый газ, растворим в эфире.
Получение:
-
СH3 – NH – C – NH2 + HO – NO → CH3 – N – C – NH2 → +2NaOH
метилмочевина
→ CH2=N+=N- + Na2CO3 + NH3 + H2O
-
C



 H3
– NH – C – O – C2H5
+ HONO → CH3
– N – C – O – C2H5
→
+2NaOH
CH2=N+=N-
H3
– NH – C – O – C2H5
+ HONO → CH3
– N – C – O – C2H5
→
+2NaOH
CH2=N+=N-
O NO O
Метилуретан
→ CH2=N+=N-
-
В кислой среде
-CH2 – N+≡N + H+→CH3 – N+≡N → +CH3 + N2↑
+CH3 + H2O→CH3OH + H+
Метанол
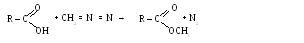
-
С фенолами

-
Со спиртами (в присутствии кислот Льюиса)
ROH + ZnCl2→[ROZnCl2]-H+ → +CH2N2 R – O – CH3 + N2 + ZnCl2
-
С альдегидами (происходит присоединение, а затем гидридное перемещение)

-
С кетонами (идет перегруппировка скелета)

Лекция №14





 – NH2 – Ar
– NH2 – Ar
 – N – R
– N – R
 – N – Ar
– N – Ar 3C
– N – CH3
3C
– N – CH3



 r
– N – Ar
r
– N – Ar трифениламин
трифениламин