
- •Практична робота №1
- •Хід роботи
- •1. Розрахунок мольної частки амоніаку.
- •2. Розрахунок циклу синтезу амоніаку.
- •Розрахунок:
- •2. Визначення вмісту циркуляційного газу на виході з колони.
- •4. Визначення обсягу продувних газів:
- •5. Визначення обсягу газу, що надходить у конденсаційну колону:
- •7. Визначення необхідного обсягу свіжого газу:
- •Практична робота №3
- •Загальні положення
- •Джерела надходження сполук Хрому в стічні води
- •Реагентне очищення стічних вод від Хрому(VI)
- •3.2. Хід роботи
- •Варіанти завдання
- •23,07 Кмоль/год. Або 738 кг/год.
- •Розрахунок витратних коефіцієнтів
- •3.4.2. Технологічний розрахунок реактора (контактного апарату)
- •Розрахунок реактора (контактного апарату)
Реагентне очищення стічних вод від Хрому(VI)
Як реагенти-відновники найбільше застосовуються натрієві солі сульфатної кислоти - Na2SO3, NaHSO3, Na2S2O5, а також натрій дітіонід (Na2S2O4). Відновлення Сr6+ до Сr3+ відбувається за реакціями:
відновлення натрій сульфітом
![]()
відновлення натрій бісульфітом
![]()
відновлення натрій піросульфітом
![]()
відновлення натрій дітіонідом
![]()
Теоретичні дози реагентів-відновників складають (мг/1мг Сr6+): для натрій сульфіту 3,63; натрій бісульфіту 3,0; натрій піросульфіту 2,88; натрій дітіоніту 1,67.
Солі сульфатної кислоти додають до стічних вод у вигляді 10%-них водних розчинів. Доза відновника залежить від початкової концентрації Сr3+ в стічній воді і величини рН. Швидкість і повнота реакцій відновлення Сr6+ до Сr3+ у великій мірі також залежать від величини рН реакційної суміші. Найбільша швидкість реакцій відновлення досягається в кислому середовищі при рН = 2-2,5, що зазвичай вимагає додаткового підкислення стічних вод 10-15%-ним розчином сульфатної кислоти (можливе використання розчинів інших мінеральних кислот).
Передозування відновника неприпустиме; перевитрата реагенту навіть на 10% приводить до утворення комплексних солей Хрому(ІІІ) і сульфатної кислоти, які не повністю руйнуються при подальшій нейтралізації стічних вод.
Як реагенти-відновники можна також використовувати відходи заліза (у вигляді сталевої стружки, скрапу і тому подібне), або Ферум(ІІІ) сульфату. У першому випадку стічні води підкислюють до рН = 2 після чого фільтрують через шар залізної стружки, що знаходиться в реакторі, при постійному барботуванні повітрям. У другому випадку розчин Ферум(ІІ) сульфату (у вигляді 10%-ного водного розчину) вводять в реактор, в який поступають стічні води. На відміну від солей сульфатної кислоти відновлення Сr6+ до Сr3+ солями Ферум(ІІ) протікає з достатньо високою швидкістю не тільки в кислому, але і в нейтральному і лужному середовищах за реакціями:
![]()
![]()
Тому у разі застосування сульфату Fe2+ як реагента-відновника попереднє підкиснення стічних вод не потрібне, а для повного відновлення Сr6+ до Сr3+ необхідний лише незначний надлишок реагента (близько 5% від стехіометричної кількості) незалежно від початкової концентрації Сr6+ в стічних водах і величини рН. Недоліком використання Ферум(ІІ) сульфату, а також залізовмісної суспензії за методом ферритизації, як реагенти-відновники в порівнянні з солями сульфатної кислоти є більш ніж 4-кратне збільшення об'єму твердих осадів, що утворюються при подальшій нейтралізації, оскільки на 1 масову частку осаду Хрому(ІІІ) гідроокису додатково утворюється 3,12 масових частин осаду Ферум(ІІІ) гідроксиду.
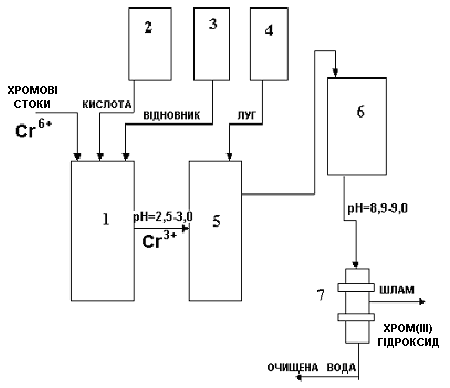 Рис.
2. Принципова схема очищення хромовмістних
стічних вод реагентним методом: 1 -
реактор-накопичувач хромових стоків;
2 - дозатор кислоти; 3 - дозатор відновника;
4 - дозатор лугу; 5 - реактор-нейтралізатор;
6 – відстійник; 7 - механічний фільтр
Рис.
2. Принципова схема очищення хромовмістних
стічних вод реагентним методом: 1 -
реактор-накопичувач хромових стоків;
2 - дозатор кислоти; 3 - дозатор відновника;
4 - дозатор лугу; 5 - реактор-нейтралізатор;
6 – відстійник; 7 - механічний фільтр
Як реагенти для відновлення Сr6+ до Сr3+ можна також застосовувати гідрогену пероксид (у кислому середовищі), SO2 та гідразин (у нейтральному або слаболужному середовищі).
Після закінчення реакції відновлення Сr6+ в кислому середовищі стічні води піддають нейтралізації з метою осадження Сr3+ у вигляді гідроксиду за реакцією:
![]()
Принципова схема очищення хромовмістних стічних вод з початковою концентрацією йонів Хрому(VI) до 600 мг/л реагент-ним методом представлена на рис. 2.
